Водородно-калиевая АТФаза
| АТФаза, обмен H+/K+, альфа-полипептид | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | АТФ4А | ||
| ген NCBI | 495 | ||
| HGNC | 819 | ||
| МОЙ БОГ | 137216 | ||
| RefSeq | НМ_000704 | ||
| ЮниПрот | P20648 | ||
| Другие данные | |||
| Номер ЕС | 7.2.2.19 | ||
| Локус | Хр. 19 q13.1 | ||
| |||
| АТФаза, обмен H+/K+, бета-полипептид | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | АТФ4Б | ||
| ген NCBI | 496 | ||
| HGNC | 820 | ||
| МОЙ БОГ | 137217 | ||
| RefSeq | НМ_000705 | ||
| ЮниПрот | P51164 | ||
| Другие данные | |||
| Номер ЕС | 7.2.2.19 | ||
| Локус | Хр. 13 q34 | ||
| |||
Желудочная водородно-калиевая АТФаза , также известная как H + /К + АТФаза – это фермент , который способствует подкислению желудка. [1] Он является членом АТФаз P-типа , также известных как АТФазы E 1 -E 2 из-за двух состояний. [2]
Биологическая функция и расположение
[ редактировать ]Желудочная водородно-калиевая АТФаза или H + /К + АТФаза — насос желудка . протонный кишечника Он обменивает калий из просвета с цитоплазматическим гидроксием. [2] и является ферментом, главным образом ответственным за подкисление содержимого желудка и активацию пищеварительного фермента пепсина. [3] (см. желудочная кислота ).
Н + /К + АТФаза обнаружена в париетальных клетках , которые представляют собой высокоспециализированные эпителиальные клетки, расположенные во внутренней клеточной оболочке желудка, называемой слизистой оболочкой желудка . Париетальные клетки обладают обширной секреторной мембранной системой и H + /К + АТФаза является основным белковым компонентом этих мембран. Небольшое количество H + /К + АТФаза также обнаруживается в мозговом веществе почек . [2]
Гены и структура белка
[ редактировать ]Н + /К + АТФаза — гетеродимерный белок , продукт двух генов. Ген АТФ4А [4] кодирует H + /К + α-субъединица АТФазы представляет собой белок, содержащий около 1000 аминокислот, который содержит каталитические центры фермента и образует поры через клеточную мембрану, которые позволяют транспортировать ионы. Ионы гидроксония связываются с двумя активными центрами, присутствующими в α-субъединице. [5] Субъединица α также имеет сайт фосфорилирования (Asp 385 ). [6] Ген ATP4B [7] кодирует β-субъединицу H + /К + АТФаза, которая представляет собой белок, содержащий ~300 аминокислот с N-концевым цитоплазматическим доменом из 36 аминокислот, одним трансмембранным доменом и высокогликозилированным внеклеточным доменом.
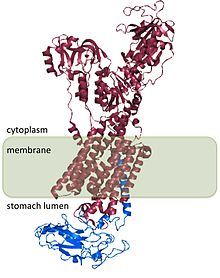
Н + /К + Субъединица β-АТФазы стабилизирует H + /К + α-субъединица АТФазы и необходима для функционирования фермента. Субъединица β предотвращает работу насоса в обратном направлении. [8] и он также, по-видимому, содержит сигналы, которые направляют гетеродимер к местам назначения на мембране внутри клетки, хотя некоторые из этих сигналов подчинены сигналам, обнаруженным в H. + /К + α-субъединица АТФазы.
Структура H + /К + АТФаза была определена для людей, собак, свиней, крыс и кроликов и на 98% гомологична для всех видов. [2]
Ферментный механизм и активность
[ редактировать ]ЧАС + /К + АТФаза представляет собой АТФазу Р2 - типа, члена эукариотического класса АТФаз Р-типа . [9] Как Ка 2+ и На + /К + АТФазы, H + /К + АТФаза функционирует как протомер α, β. [10] В отличие от других эукариотических АТФаз, H + /К + АТФаза электронейтральна и переносит один протон в просвет желудка на каждый ион калия, извлеченный из просвета желудка. [9] В качестве ионного насоса H + /К + АТФаза способна транспортировать ионы против градиента концентрации, используя энергию, полученную в результате гидролиза АТФ. Как и все АТФазы P-типа, фосфатная группа переносится с аденозинтрифосфата (АТФ) на H. + /К + АТФаза во время транспортного цикла. Этот перенос фосфата приводит к конформационным изменениям фермента, который способствует транспорту ионов. [ нужна ссылка ]
Водородно-калиевая АТФаза косвенно активируется гастрином , который заставляет клетки ECL выделять гистамин . [11] Гистамин связывается с H2-рецепторами на париетальных клетках, активируя цАМФ-зависимый путь , который заставляет фермент перемещаться от цитоплазматических мембран канальцев к глубоко складчатым канальцам стимулированных париетальных клеток. [2] После локализации фермент поочередно меняет две конформации: E1 и E2, чтобы транспортировать ионы через мембрану.

Конформация E1 связывает фосфат АТФ и ион гидроксония на цитоплазматической стороне. Затем фермент переходит в конформацию E2, позволяя гидроксонию высвобождаться в просвет. Конформация E2 связывает калий и возвращается к конформации E1 с высвобождением фосфата и калия. + в цитоплазму, где другой АТФ может быть гидролизован для повторения цикла. [2] Субъединица β предотвращает возврат конформации E2-P к конформации E1-P, делая перекачку протонов однонаправленной. [8] Количество ионов, переносимых на одну АТФ, варьируется от 2H + /2К + до 1 часа + /1К + в зависимости от pH желудка. [12]
Актуальность и ингибирование заболевания
[ редактировать ]Ингибирование водородно-калиевого насоса для снижения кислотности желудка было наиболее распространенным методом лечения заболеваний, включая гастроэзофагеальную рефлюксную болезнь (ГЭРБ/ГЭРБ) и язвенную болезнь (ЯБ). [13] Снижение кислотности облегчает симптомы заболевания, но не лечит фактическую причину ГЭРБ (аномальное расслабление пищеводного сфинктера) или ЯБП ( Helicobacter pylori и НПВП ). [14]
Для ингибирования H использовались три класса препаратов. + /К + -АТФазы. H 2 Антагонисты -рецепторов , такие как циметидин (тагамет), ингибируют сигнальный путь, который приводит к активации АТФазы. Этот тип ингибиторов эффективен при лечении язв, но не предотвращает их образование, и примерно через неделю у пациентов развивается толерантность к ним, что приводит к снижению эффективности на 50%. [15] Позже были разработаны ингибиторы протонной помпы (ИПП), начиная с тимопразола в 1975 году. [15] ИПП представляют собой активируемые кислотой пролекарства , которые ингибируют водородно-калийную АТФазу путем ковалентного связывания с активными насосами. [16] Современные ИПП, такие как омепразол, имеют короткий период полувыведения — около 90 минут. [17] Антагонисты кислотного насоса (АПА) или блокаторы кислоты, конкурирующие с калием (PCAB), представляют собой третий тип ингибиторов, которые блокируют секрецию кислоты путем связывания с K + активный сайт. [15] APA обеспечивают более быстрое ингибирование, чем PPI, поскольку они не требуют активации кислоты. Ревапразан был первым APA, использованным клинически в Восточной Азии, и в настоящее время разрабатываются другие APA, поскольку они, по данным клинических испытаний, обеспечивают лучший контроль кислотности. [17]
Инактивация протонной помпы также может привести к проблемам со здоровьем. Исследование на мышах, проведенное Krieg et al. [18] обнаружили, что мутация α-субъединицы насоса приводит к ахлоргидрии , что приводит к проблемам с абсорбцией железа, что приводит к дефициту железа и анемии . Использование ИПП не коррелировало с повышенным риском развития анемии, поэтому H + /К + Считается, что АТФаза способствует усвоению железа, но это не обязательно. [18]
Текущая связь деменции и ИПП была документирована в Германии и в исследовательских статьях, показывающих, как производные бензимидазола, астемизол (АСТ) и лансопразол (ЛНС) взаимодействуют с аномальными агрегатами тау-белка ( нейрофибриллярными клубками ). [19] [20] [21] Современные теории включают неселективную блокаду натриево-калиевых насосов в головном мозге, вызывающую осмотический дисбаланс или отек клеток. [авторское мнение]Взаимодействие ИПП с другими препаратами, влияющими на натрий-калиевую помпу, например, с дигоксином, варфарином и т. д., хорошо документировано. [22] Память связана с астроцитами, а альфа3-субъединица аденозинового рецептора, обнаруженная в водородных/натрий-калиевых насосах, может быть центральной точкой при деменции. [23] [24] [25] Хроническое использование ИПП может привести к снижению регуляции субъединицы альфа3, что приведет к повреждению астроцитов. [26] Остеопетроз, обусловленный геном TCIRG1, тесно связан с предстарческим слабоумием. [27] [28]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Сакаи Х., Фуджи Т., Такегучи Н. (2016). «Глава 13. Протон-калиевые (H+/K+) АТФазы: свойства и роль в здоровье и болезнях». В Астрид С., Хельмут С., Роланд К.О. С. (ред.). Ионы щелочных металлов: их роль в жизни . Ионы металлов в науках о жизни. Том. 16. Спрингер. стр. 459–483. дои : 10.1007/978-3-319-21756-7_13 . ISBN 978-3-319-21755-0 . ПМИД 26860309 .
- ^ Перейти обратно: а б с д и ж г Шин Дж. М., Мансон К., Вагин О., Сакс Г. (2009). «Желудочная НК-АТФаза: структура, функции и ингибирование» . Архив Pflügers: Европейский журнал физиологии . 457 (3): 609–622. дои : 10.1007/s00424-008-0495-4 . ПМК 3079481 . ПМИД 18536934 .
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2012). Биохимия (7-е изд.). Нью-Йорк: WH Freeman and Company.
- ^ ATP4A АТФаза H+/K+, транспортирующая альфа-субъединицу
- ^ Чурасия М., Састри Г.М., Састри. ГН (2005). «Сайты связывания протонов и конформационный анализ H + K +-АТФазы». Связь с биохимическими и биофизическими исследованиями . 336 (3): 961–966. дои : 10.1016/j.bbrc.2005.08.205 . ПМИД 16157306 .
- ^ Шайрлинкс Ф., Рауссен В., Рюйсшерт Ж.-М., Гурмахтиг Э. (2004). «Конформационные изменения желудочной H+/K+-АТФазы, контролируемые с помощью разностной инфракрасной спектроскопии с преобразованием Фурье и обмена водорода/дейтерия» . Биохимический журнал . 382 (Часть 1) (Изд. Часть 1): 121–129. дои : 10.1042/BJ20040277 . ПМЦ 1133922 . ПМИД 15096097 .
- ^ ATP4B АТФаза H+/K+, транспортирующая бета-субъединицу
- ^ Перейти обратно: а б Абэ К., Тани К., Нисидзава Т., Фудзиёси Ю. (2009). «Межсубъединичное взаимодействие желудочного H + ,К + -АТФаза предотвращает обратную реакцию транспортного цикла» . The EMBO Journal . 28 (11): 1637–1643. : 10.1038 /emboj.2009.102 . PMC 2693145. . PMID 19387495 doi
- ^ Перейти обратно: а б Шин Дж. М., Сакс Г. (2009). «Ионно-движущие АТФазы: АТФазы P-типа». ЭЛС . дои : 10.1002/9780470015902.a0001379.pub2 . ISBN 978-0-470-01617-6 .
- ^ Дач И., Олесен Дж., Синьор Л., Ниссен П., Ле Мэр М., Мёллер Дж. В., Эбель Дж. (2012). «Активное моющее средство, солюбилизированное H + ,К + -АТФаза является мономером» . Журнал биологической химии . 287 (50): 41963–41978. : 10.1074 /jbc.M112.398768 . PMC 3516743. . PMID 23055529 doi
- ^ Принц К., Каджимура М., Скотт Д., Хеландер Х., Шин Дж., Безансон М., Бамберг К., Херси С., Сакс Г. (1992). «Кислотная секреция и H,K-АТФаза желудка» . Йельский журнал биологии и медицины . 65 (6): 577–596. ПМК 2589780 . ПМИД 1341065 .
- ^ Абэ К., Тани К., Фридрих Т., Фудзиеси Ю. (2012). «Крио-ЭМ структура желудочной H+,K+-АТФазы с одним занятым катионсвязывающим сайтом» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (45): 18401–18406. Бибкод : 2012PNAS..10918401A . дои : 10.1073/pnas.1212294109 . ПМЦ 3494912 . ПМИД 23091039 .
- ^ Шин Дж. М., Вагин О., Мансон К., Кидд М., Модлин И. М., Сакс Г. (2008). «Молекулярные механизмы в терапии кислотозависимых заболеваний» . Клеточные и молекулярные науки о жизни . 65 (2): 264–281. дои : 10.1007/s00018-007-7249-x . ПМК 3081136 . ПМИД 17928953 .
- ^ Йоманс, Северная Дакота (2011). «Язвенники: В поисках причины язвенной болезни» . Журнал гастроэнтерологии и гепатологии . 26 : 35–41. дои : 10.1111/j.1440-1746.2010.06537.x . ПМИД 21199512 . S2CID 42592868 .
- ^ Перейти обратно: а б с Сакс Г., Шин Дж. М., Вагин О., Ламбрехт Н., Якубов И., Мансон К. (2007). «Желудочная H,K-АТФаза как мишень для лекарств: прошлое, настоящее и будущее» . Журнал клинической гастроэнтерологии . 41 (Приложение 2): S226–S242. дои : 10.1097/MCG.0b013e31803233b7 . ПМК 2860960 . ПМИД 17575528 .
- ^ Шин Дж. М., Сакс Г. (2008). «Фармакология ингибиторов протонной помпы» . Текущие отчеты гастроэнтерологии . 10 (6): 528–534. дои : 10.1007/s11894-008-0098-4 . ПМЦ 2855237 . ПМИД 19006606 .
- ^ Перейти обратно: а б Шин Дж. М., Сакс Г. (2009). «Длительные ингибиторы желудочной H,K-АТФазы» . Экспертное обозрение клинической фармакологии . 2 (5): 461–468. дои : 10.1586/ecp.09.33 . ПМЦ 2995460 . ПМИД 21132072 .
- ^ Перейти обратно: а б Криг Л., Мильштейн О., Кребс П., Ся Ю., Бойтлер Б., Ду Х. (2011). «Мутация альфа-субъединицы водородно-калийной АТФазы желудка вызывает железодефицитную анемию у мышей» . Кровь . 118 (24): 6418–6425. doi : 10.1182/blood-2011-04-350082 . ПМК 3236123 . ПМИД 21976678 .
- ^ Гомм В., фон Хольт К., Томе Ф., Бройх К., Майер В., Финк А., Добльхаммер Г., Хениш Б. (2016). «Связь ингибиторов протонной помпы с риском деменции: анализ данных фармакоэпидемиологических заявлений» . ДЖАМА Нейрол . 73 (4): 410–416. дои : 10.1001/jamaneurol.2015.4791 . ПМИД 26882076 .
- ^ Рохо Л.Е., Альзате-Моралес Дж., Сааведра И.Н., Дэвис П., Макчиони Р.Б. (2010). «Селективное взаимодействие лансопразола и астемизола с тау-полимерами: потенциальное новое клиническое применение в диагностике болезни Альцгеймера» . Дж. Альцгеймерс Дис . 19 (2): 573–89. дои : 10.3233/JAD-2010-1262 . ПМЦ 2951486 . ПМИД 20110603 .
- ^ Фаваз М.В., Брукс А.Ф., Родник М.Е., Карпентер Г.М., Шао X, Десмонд Т.Дж., Шерман П., Кесада К.А., Хокли Б.Г., Килборн М.Р., Альбин Р.Л., Фрей К.А., Скотт П.Дж. (2014). «Радиофармацевтические препараты с высоким сродством на основе лансопразола для ПЭТ-визуализации агрегированного тау при болезни Альцгеймера и прогрессирующем супрануклеарном параличе: синтез, доклиническая оценка и выбор свинца» . ACS Chem Neurosci . 5 (8): 718–30. дои : 10.1021/cn500103u . ПМК 4140593 . ПМИД 24896980 . Epub 2014, 16 июня.
- ^ Трифиро Дж., Коррао С., Алаква М., Моретти С., Тари М., Капути А.П., Аркорачи В. (2006). «Риск взаимодействия с ингибиторами протонной помпы в общей практике: значительные разногласия между различными источниками информации о лекарствах» . Бр Дж Клин Фармакол . 62 (5): 582–90. дои : 10.1111/j.1365-2125.2006.02687.x . ПМК 1885178 . ПМИД 16822281 .
- ^ Бьёрклунд О., Шан М., Тонаццини И., Даре Э., Фредхольм Б.Б. (2008). «Аденозиновые рецепторы А1 и А3 защищают астроциты от гипоксического повреждения». Эур Дж Фармакол . 596 (1–3): 6–13. дои : 10.1016/j.ejphar.2008.08.002 . ПМИД 18727925 . Электронная публикация 2008 г., 13 августа.
- ^ Кармона М.А., Мурай К.К., Ван Л., Робертс А.Дж., Паскуале Э.Б. (2009). «Глиальный эфрин-А3 регулирует морфологию дендритных шипов гиппокампа и транспорт глутамата» . Proc Natl Acad Sci США . 106 (30): 12524–12529. Бибкод : 2009PNAS..10612524C . дои : 10.1073/pnas.0903328106 . ПМЦ 2718351 . ПМИД 19592509 .
- ^ Бен Хаим Л., Каррильо-де Соваж М.А., Сейзериат К., Эскартин С. (2015). «Неуловимая роль реактивных астроцитов при нейродегенеративных заболеваниях» . Переднеклеточные нейроны . 9 : 278. дои : 10.3389/fncel.2015.00278 . ПМЦ 4522610 . ПМИД 26283915 . Электронная коллекция 2015
- ^ Гесси С., Мериги С., Стефанелли А., Фацци Д., Варани К., Бореа П.А. (2013). «Аденозиновые рецепторы A (1) и A (3) ингибируют LPS-индуцированное гипоксией накопление фактора-1 в мышиных астроцитах». Фармакол Рез . 76 : 157–70. дои : 10.1016/j.phrs.2013.08.002 . ПМИД 23969284 . Epub 2013, 19 августа.
- ^ «TCIRG1» . Домашний справочник по генетике .
- ^ Кайфу Т, Накахара Дж, Инуи М, Мисима К, Момияма Т, Кадзи М, Сугахара А, Който Х, Удзике-Асаи А, Накамура А, Канадзава К, Тан-Такеучи К, Ивасаки К, Ёкояма ВМ, Кудо А, Фудзивара М., Асу Х., Такай Т. (2003). «Остеопетроз и таламический гипомиелиноз с синаптической дегенерацией у мышей с дефицитом DAP12» . Джей Клин Инвест . 111 (3): 323–32. дои : 10.1172/JCI16923 . ПМК 151867 . ПМИД 12569157 .
Внешние ссылки
[ редактировать ]- Яо X, Форте JG (2003). «Клеточная биология секреции кислоты париетальными клетками» . Анну. Преподобный физиол . 65 : 103–31. дои : 10.1146/annurev.phyol.65.072302.114200 . ПМИД 12500969 .
- Кюльбрандт В. (апрель 2004 г.). «Биология, структура и механизм АТФаз Р-типа». Нат. Преподобный мол. Клеточная Биол . 5 (4): 282–95. дои : 10.1038/nrm1354 . ПМИД 15071553 . S2CID 24927167 .
- Данбар Л.А., Каплан М.Дж. (август 2001 г.). «Ионные насосы в поляризованных клетках: сортировка и регулирование Na + , К + - и Х + , К + -АТФазы» . J. Biol. Chem . 276 (32): 29617–20. doi : 10.1074/jbc.R100023200 . PMID 11404365 .
- Сакс Г., Шин Дж. М., Бривинг С., Уоллмарк Б., Херси С. (1995). «Фармакология желудочного кислотного насоса: H + ,К + АТФаза» . Annu. Rev. Pharmacol. Toxicol . 35 : 277–305. doi : 10.1146/annurev.pa.35.040195.001425 . PMID 7598495 .
- Калий + водород + АТФаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)