Саркоплазматическая сеть
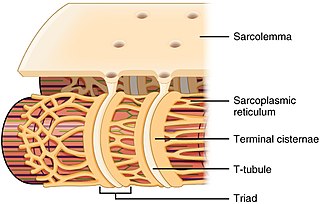
Саркоплазматический ретикулум ( СР ) представляет собой мембраносвязанную структуру, обнаруженную в мышечных клетках и похожую на гладкую эндоплазматическую сеть в других клетках . Основная функция СР — хранение ионов кальция (Ca 2+ ). Уровни ионов кальция остаются относительно постоянными: концентрация ионов кальция внутри клетки в 10 000 раз меньше, чем концентрация ионов кальция вне клетки. [1] Это означает, что небольшое увеличение количества ионов кальция внутри клетки легко обнаружить и может вызвать важные клеточные изменения (кальций считается вторичным мессенджером ). Кальций используется для производства карбоната кальция (содержащегося в меле) и фосфата кальция — двух соединений, которые организм использует для формирования зубов и костей . Это означает, что слишком много кальция внутри клеток может привести к затвердению ( кальцификации ) определенных внутриклеточных структур, включая митохондрии . [2] приводящие к гибели клеток. Поэтому жизненно важно, чтобы уровень ионов кальция строго контролировался и при необходимости мог высвобождаться в клетку, а затем удаляться из клетки.
Структура [ править ]
Саркоплазматический ретикулум представляет собой сеть канальцев, которые проходят через мышечные клетки , охватывая (но не находясь в прямом контакте с ними) миофибриллы (сократительные единицы клетки). Клетки сердечной и скелетных мышц содержат структуры, называемые поперечными канальцами (Т-трубочки) , которые являются расширениями клеточной мембраны и направляются в центр клетки. Т-трубочки тесно связаны с определенной областью SR, известной как терминальные цистерны в скелетных мышцах, на расстоянии примерно 12 нанометров , разделяющем их. Это основное место высвобождения кальция. [3] Продольные SR представляют собой более тонкие выступы, которые проходят между терминальными цистернами/переходными SR и являются местом, где ионные каналы, необходимые для абсорбции ионов кальция, наиболее распространены. [4] Эти процессы более подробно объяснены ниже и имеют основополагающее значение для процесса взаимодействия возбуждения и сокращения в скелетных , сердечных и гладких мышцах .
Усвоение кальция [ править ]
СР содержит внутри своей мембраны насосы ионных каналов , которые отвечают за перекачку кальция. 2+ в СР. Поскольку концентрация ионов кальция внутри СР выше, чем в остальной части клетки, ионы кальция не могут свободно поступать в СР, и поэтому требуются насосы, использующие энергию, которую они получают от молекулы, называемой аденозинтрифосфат (АТФ). ) . Эти кальциевые насосы называются Сарко(эндо)плазматической сетью Са. 2+ АТФазы (SERCA) . Существует множество различных форм SERCA, причем SERCA 2a обнаруживается преимущественно в сердечной и скелетных мышцах. [5]
SERCA состоит из 13 субъединиц (обозначенных M1-M10, N, P и A). Ионы кальция связываются с субъединицами M1-M10 (которые расположены внутри мембраны), тогда как АТФ связывается с субъединицами N, P и A (которые расположены вне SR). Когда 2 иона кальция вместе с молекулой АТФ связываются с цитозольной стороной насоса (т.е. областью насоса вне СР), насос открывается. Это происходит потому, что АТФ (которая содержит три фосфатные группы ) высвобождает одну фосфатную группу (становящуюся аденозиндифосфатом ). Высвободившаяся фосфатная группа затем связывается с насосом, заставляя насос менять форму. Это изменение формы приводит к открытию цитозольной стороны насоса, позволяя двум Ca 2+ войти. Затем цитозольная сторона насоса закрывается, а сторона саркоплазматического ретикулума открывается, высвобождая Ca. 2+ в СР. [6]
Было показано, что белок , обнаруженный в сердечной мышце, под названием фосфоламбан (PLB), препятствует работе SERCA. Он делает это путем связывания с SERCA и уменьшения его притяжения (сродства) к кальцию, тем самым предотвращая попадание кальция в SR. Неспособность удалить Ca 2+ из цитозоля, предотвращает мышечную релаксацию и, следовательно, означает, что также происходит уменьшение мышечного сокращения. Однако такие молекулы, как адреналин и норадреналин , могут препятствовать ингибированию PLB SERCA. Когда эти гормоны связываются с рецептором, называемым бета-1-адренорецептором , расположенным на клеточной мембране, они вызывают серию реакций (известных как путь циклического АМФ ), в результате которых вырабатывается фермент, называемый протеинкиназой А (ПКА) . PKA может добавлять фосфат к PLB (это известно как фосфорилирование), предотвращая ингибирование SERCA и обеспечивая мышечную релаксацию. [7]
Хранение кальция [ править ]
Внутри SR находится белок под названием кальсеквестрин . Этот белок может связывать около 50 Ca. 2+ , что уменьшает количество свободного Ca 2+ в пределах СР (так как большее количество связано с кальсеквестрином). [8] Следовательно, может храниться больше кальция (кальсеквестрин называется буфером). Он преимущественно расположен в соединительном СР/ просветном пространстве , в тесной связи с каналом высвобождения кальция (описанным ниже). [9]
Высвобождение кальция [ править ]
Высвобождение ионов кальция из SR происходит в соединительных SR/ терминальных цистернах через рианодиновый рецептор (RyR) и известно как кальциевая искра . [10] Существует три типа рианодиновых рецепторов: RyR1 (в скелетных мышцах ), RyR2 (в сердечной мышце ) и RyR3 (в головном мозге ). [11] Высвобождение кальция через рианодиновые рецепторы в СР запускается по-разному в разных мышцах. В сердце и гладких мышцах электрический импульс ( потенциал действия ) заставляет ионы кальция проникать в клетку через кальциевый канал L-типа , расположенный в клеточной мембране (гладкая мышца) или мембране Т-канальцев (сердечная мышца). Эти ионы кальция связываются с RyR и активируют его, вызывая большее увеличение внутриклеточного кальция. Однако в скелетных мышцах кальциевый канал L-типа связан с RyR. Таким образом, активация кальциевого канала L-типа посредством потенциала действия напрямую активирует RyR, вызывая высвобождение кальция ( см. В разделе «Искры кальция »). подробнее [12] Кроме того, кофеин (содержащийся в кофе) может связываться с RyR и стимулировать его. Кофеин делает RyR более чувствительным либо к потенциалу действия (скелетные мышцы), либо к кальцию (сердечные или гладкие мышцы), тем самым чаще вызывая кальциевые искры (это частично ответственно за влияние кофеина на частоту сердечных сокращений). [13]
Триадин и Юнктин — это белки, обнаруженные внутри мембраны SR и связанные с RyR. Основная роль этих белков заключается в закреплении кальсеквестрина (см. выше) на рианодиновом рецепторе. При «нормальных» (физиологических) уровнях кальция SR кальсеквестрин связывается с RyR, триадином и джанктином, что предотвращает открытие RyR. [14] Если концентрация кальция в SR упадет слишком низко, с кальсеквестрином будет связано меньше кальция. Это означает, что у кальсеквестрина больше места для связывания с соединительными, триадиновыми и рианодиновыми рецепторами, поэтому он связывается более прочно. Однако если уровень кальция в SR повышается слишком высоко, больше кальция связывается с кальсеквестрином и, следовательно, он менее прочно связывается с комплексом соединения-триадин-RyR. Таким образом, RyR может открываться и высвобождать кальций в клетку. [15]
В дополнение к эффектам, которые ПКА оказала на фосфоламбан (см. выше), что привело к усилению расслабления сердечной мышцы, ПКА (а также другой фермент, называемый кальмодулинкиназой II ) также может фосфорилировать рианодиновые рецепторы. При фосфорилировании RyR более чувствительны к кальцию, поэтому открываются чаще и на более длительные периоды времени. Это увеличивает высвобождение кальция из СР, увеличивая скорость сокращения. [16] Таким образом, в сердечной мышце активация ПКА через путь циклического АМФ приводит к усилению мышечного сокращения (посредством фосфорилирования RyR2 ) и усилению расслабления (посредством фосфорилирования фосфоламбана ), что увеличивает частоту сердечных сокращений.
Механизм прекращения высвобождения кальция через RyR до сих пор полностью не изучен. Некоторые исследователи полагают, что это происходит из-за случайного закрытия рианодиновых рецепторов (известного как стохастическое истощение) или из-за того, что рианодиновые рецепторы становятся неактивными после кальциевой искры. [17] в то время как другие полагают, что снижение уровня кальция в SR вызывает закрытие рецепторов ( см. В разделе « Искры кальция более подробную информацию »).
Роль окоченении в трупном
Разрушение саркоплазматической сети, наряду с последующим высвобождением кальция, является важным фактором трупного окоченения , окоченения мышц после смерти.
Увеличение концентрации кальция в саркоплазме также может вызывать ригидность мышц.
Ссылки [ править ]
- ^ Броннер, Ф. (2003) «Внеклеточная и внутриклеточная регуляция гомеостаза кальция», TheScientificWorldJournal., 1, стр. 919–25.
- ^ Трамп Б., Березский И., Лайхо К., Осорнио А., Мергнер В. и Смит М. (1980) «Роль кальция в повреждении клеток. Обзор», Сканирующая электронная микроскопия., стр. 437–62.
- ^ Анатомия саркоплазматического ретикулума в скелетных мышцах позвоночных: ее значение для связи возбуждения и сокращения», Zeitschrift für Naturforschung. Раздел C, Биологические науки, 37, стр. 665–78.
- ^ Арай, М.; Мацуи, Х.; Периасами, М. (1 апреля 1994 г.). «Экспрессия генов саркоплазматической сети при гипертрофии сердца и сердечной недостаточности» . Исследование кровообращения . 74 (4): 555–564. дои : 10.1161/01.RES.74.4.555 . ISSN 0009-7330 . ПМИД 8137493 .
- ^ Периасами М. и Кальянасундарам А. (2007) «Изоформы насоса SERCA: их роль в транспорте ионов кальция и заболеваниях», Muscle & Nerve, 35 (4), стр. 430–42.
- ^ Кекенес-Хаски, П.М., Мецгер, В.Т., Грант, Б.Дж. и Маккаммон, А.Дж. (2012b) «Механизмы связывания кальция и аллостерические сигнальные механизмы для саркоплазматического ретикулума Ca 2+ АТФаза», 21(10).
- ^ Акин Б., Херли Т., Чен З. и Джонс Л. (2013) «Структурная основа ингибирования фосфоламбаном кальциевого насоса в саркоплазматическом ретикулуме», Журнал биологической химии, 288 (42). , стр. 30181–91.
- ^ Борода, Северная Каролина; Лейвер, доктор медицинских наук; Далханти, А.Ф. (1 мая 2004 г.). «Кальсеквестрин и канал высвобождения кальция скелетных и сердечных мышц» . Прогресс биофизики и молекулярной биологии . 85 (1): 33–69. doi : 10.1016/j.pbiomolbio.2003.07.001 . ISSN 0079-6107 . ПМИД 15050380 .
- ^ Кобаяши, Ю.М.; Алсейхан, бакалавр; Джонс, Л.Р. (2000): Локализация и характеристика кальсеквестрин-связывающего домена триадина 1. Доказательства наличия заряженной бета-цепи в опосредовании белок-белкового взаимодействия. В Журнале биологической химии 275 (23), стр. 17639–17646. DOI: 10.1074/jbc.M002091200.
- ^ Ченг, Х.; Ледерер, В.Дж.; Каннелл, МБ (29 октября 1993 г.). «Кальциевые искры: элементарные события, лежащие в основе связи возбуждения-сокращения в сердечной мышце». Наука . 262 (5134): 740–744. Бибкод : 1993Sci...262..740C . дои : 10.1126/science.8235594 . ISSN 0036-8075 . ПМИД 8235594 .
- ^ Ланнер, Дж. Т., Георгиу, Д. К., Джоши, А. Д. и Гамильтон, С. Л. (2010b) «Рианодиновые рецепторы: структура, экспрессия, молекулярные детали и функция при высвобождении кальция», 2 (11).
- ^ Ченг, Х. и Ледерер, В. (2008) «Искры кальция», Physiological Reviews., 88 (4), стр. 1491–545.
- ^ Сицапесан Р. , Уильямс А.Дж. Механизмы активации кофеином одиночных кальцийвысвобождающих каналов сердечного саркоплазматического ретикулума овец. J Physiol (Лондон) 1990; 423: 425–439]
- ^ Чжан, Л; Келли, Дж; Шмайссер, Г; Кобаяши, Ю.М.; Джонс, ЛР (1997). «Образование комплекса между джанктином, триадином, кальсеквестрином и рианодиновым рецептором: белки мембраны саркоплазматического ретикулума сердечного соединения» . J Биол Хим . 272 (37): 23389–23397. дои : 10.1074/jbc.272.37.23389 . ПМИД 9287354 .
- ^ Дьерке И., Хестер Н., Джонс ЛР и Дьерке С. (2004) «Роль кальсеквестрина, триадина и джанктина в обеспечении чувствительности сердечных рианодиновых рецепторов к люминальному кальцию», 86 (4).
- ^ Берс, Д.М. (2006) «Фосфорилирование сердечных рианодиновых рецепторов: целевые сайты и функциональные последствия», 396 (1).
- ^ Шам, JSK; и др. (1998). «Прекращение высвобождения Ca2+ путем локальной инактивации рианодиновых рецепторов в кардиомиоцитах» . Учеб. Натл. акад. наук. США . 95 (25): 15096–15101. Бибкод : 1998PNAS...9515096S . дои : 10.1073/pnas.95.25.15096 . ПМК 24581 . ПМИД 9844021 .