Трансцитоз
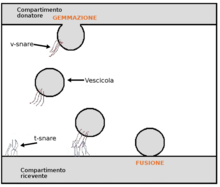
Трансцитоз (также известный как цитопемпсис ) [1] представляет собой тип трансклеточного транспорта , при котором различные макромолекулы транспортируются внутрь клетки . Макромолекулы захватываются везикулами на одной стороне клетки, тянутся через клетку и выбрасываются на другой стороне. Примеры транспортируемых макромолекул включают IgA , [2] трансферрин , [3] и инсулин . [4] Хотя трансцитоз чаще всего наблюдается в эпителиальных клетках , этот процесс также присутствует и в других местах. Кровеносные капилляры являются хорошо известным местом трансцитоза. [5] хотя это происходит и в других клетках, включая нейроны , [6] остеокласты [7] и М-клетки кишечника . [8]
Регулирование
[ редактировать ]Регуляция трансцитоза сильно различается из-за множества различных тканей, в которых наблюдается этот процесс. Выявлены различные тканеспецифические механизмы трансцитоза. брефелдин А , широко используемый ингибитор транспорта ER в аппарат Гольджи , ингибирует трансцитоз в клетках почек собак, что дало первые сведения о природе регуляции трансцитоза. Было показано, что [9] Также было показано, что трансцитоз в клетках почек собак регулируется на апикальной мембране с помощью Rab17 . [10] а также Rab11a и Rab25 . [11] Дальнейшая работа на клетках почек собак показала, что сигнальный каскад , включающий фосфорилирование EGFR с помощью Yes, ведущий к активации Rab11FIP5 с помощью MAPK1, усиливает трансцитоз. [12] Было показано, что трансцитоз ингибируется комбинацией прогестерона и эстрадиола с последующей активацией, опосредованной пролактином, в молочной железе кролика во время беременности . [13] В железе щитовидной трансцитоз фолликулярных клеток положительно регулируется ТТГ. [ нужна ссылка ] . кавеолина фосфорилирование 1 , индуцированное перекисью водорода, Было показано, что имеет решающее значение для активации трансцитоза в легочной сосудистой ткани . [14] Таким образом, можно сделать вывод, что регуляция трансцитоза представляет собой сложный процесс, который варьируется в зависимости от ткани.
Роль в патогенезе
[ редактировать ]Благодаря функции трансцитоза как процесса транспортировки макромолекул между клетками, он может быть удобным механизмом проникновения патогенов в ткань. Было показано, что трансцитоз имеет решающее значение для проникновения Cronobacter sakazakii через эпителий кишечника, а также через гематоэнцефалический барьер . [15] Listeria monocytogenes Было показано, что проникает в просвет кишечника посредством трансцитоза через бокаловидные клетки . [16] шига-токсин, секретируемый энтерогеморрагической кишечной палочкой, трансцитозируется в просвет кишечника. Было показано, что [17] Из этих примеров можно сказать, что трансцитоз имеет жизненно важное значение для процесса патогенеза различных инфекционных агентов.
Клинические применения
[ редактировать ]Фармацевтические компании, такие как Lundbeck , в настоящее время изучают возможность использования трансцитоза в качестве механизма транспортировки терапевтических препаратов через гематоэнцефалический барьер человека (ГЭБ). [ нужна ссылка ] Использование собственного транспортного механизма организма может помочь преодолеть высокую селективность ГЭБ, который обычно блокирует поступление большинства терапевтических антител в мозг и центральную нервную систему (ЦНС). Фармацевтическая компания Genentech после синтеза терапевтического антитела , которое эффективно ингибировала ферментативную функцию BACE1 , столкнулась с проблемами переноса адекватных и эффективных уровней антител в мозг. BACE1 — это фермент, который перерабатывает белки-предшественники амилоида в пептиды амилоида-β , включая те виды, которые агрегируют с образованием амилоидных бляшек, связанных с болезнью Альцгеймера . [ нужна ссылка ]
Молекулы транспортируются через эпителиальный или эндотелиальный барьер одним из двух путей: 1) трансклеточным путем через внутриклеточный компартмент клетки или 2) парацеллюлярным путем через внеклеточное пространство между соседними клетками. [18] Трансклеточный путь также называется трансцитозом. Трансцитоз может быть рецептор-опосредованным и состоит из трех стадий: 1) рецептор-опосредованный эндоцитоз молекулы на одной стороне клетки, например на просветной стороне; 2) движение молекулы через внутриклеточный компартмент, обычно внутри эндосомальной системы; и 3) экзоцитоз молекулы во внеклеточное пространство на другой стороне клетки, например на аблюминальной стороне.
Трансцитоз может быть однонаправленным или двунаправленным. Однонаправленный трансцитоз может происходить выборочно в направлении от просвета к просвету или в обратном направлении, от просвета к просвету.
Трансцитоз играет важную роль в микрососудистом транспорте пептидов и белков головного мозга. [19] потому что эндотелий микрососудов головного мозга, который образует гематоэнцефалический барьер (ГЭБ) in vivo, образует уникальные, эпителиоподобные, высокорезистентные плотные соединения . [20] Плотные эндотелиальные соединения головного мозга практически исключают парацеллюлярный путь транспорта растворенных веществ через эндотелиальную стенку микрососудистых сосудов головного мозга. Напротив, эндотелиальный барьер в периферических органах не имеет плотных соединений, и движение растворенных веществ по парацеллюлярному пути заметно на эндотелиальном барьере в органах, отличных от головного или спинного мозга. [21]
Рецепторно-опосредованный трансцитоз, или RMT, через ГЭБ является потенциальным путем доставки лекарств в мозг , особенно биологических препаратов, таких как рекомбинантные белки. [22] Нетранспортируемое лекарство или терапевтический белок генетически слито с белком-транспортером. Белок-переносчик может представлять собой эндогенный пептид или пептидомиметическое моноклональное антитело, которое подвергается RMT через ГЭБ путем транспорта на эндотелиальные рецепторы головного мозга, такие как рецептор инсулина или рецептор трансферрина. Белок-транспортер действует как молекулярный «троянский конь», переправляя в мозг терапевтический белок, генетически слитый со специфичным для рецептора белком «троянского коня».
Троянские кони моноклональных антител, нацеленные на инсулиновый рецептор ГЭБ или рецептор трансферрина, уже более 10 лет разрабатывают лекарства в биотехнологической компании ArmaGen, Inc. в Лос-Анджелесе. Компания ArmaGen разработала генетически модифицированные антитела против рецепторов инсулина и трансферрина и соединила с этими антителами различные терапевтические белки, включая лизосомальные ферменты, терапевтические антитела, рецепторы-ловушки и нейротрофины. [23] Эти терапевтические белки сами по себе не пересекают ГЭБ, но после генетического слияния с антителом троянского коня терапевтический белок проникает через ГЭБ со скоростью, сравнимой со скоростью малых молекул. В 2015 году ArmaGen первой приступит к клиническим испытаниям на людях слитых белков BBB «Троянский конь», которые доставляют белковые лекарства в мозг посредством пути трансцитоза. Заболевания человека, на которые изначально нацелена ArmaGen, представляют собой лизосомальные болезни накопления, которые отрицательно влияют на мозг. Наследственные заболевания создают состояние, при котором не вырабатывается специфический лизосомальный фермент, что приводит к серьезным заболеваниям головного мозга, включая умственную отсталость, поведенческие проблемы, а затем и деменцию. Хотя недостающий фермент может быть произведен фармацевтическими компаниями, сам по себе ферментный препарат не лечит мозг, поскольку сам по себе фермент не проникает через ГЭБ. ArmaGen реконструировала недостающий лизосомальный фермент в слитый белок «троянский конь-фермент», который пересекает ГЭБ. Первые клинические испытания новой технологии слитых белков «троянского коня» позволят лечить мозг при лизосомальных нарушениях накопления, в том числе при одном из мукополисахаридоз I типа (MPSIH), также называемый синдромом Гурлера , и MPS типа II, также называемый синдромом Хантера .
Исследователи из Genentech предложили создать биспецифическое антитело , которое могло бы связываться с мембраной ГЭБ, вызывать рецептор-опосредованный трансцитоз и высвобождаться на другой стороне в мозг и ЦНС. Они использовали мышиное биспецифическое антитело с двумя активными центрами, выполняющими разные функции. с низким сродством В одной руке был сайт связывания антитрансферринового рецептора , который индуцирует трансцитоз. Сайт связывания с высоким сродством приведет к тому, что антитело не сможет высвободиться из мембраны ГЭБ после трансцитоза. Таким образом, количество транспортируемых антител зависит от концентрации антител по обе стороны барьера. Другая группа имела ранее разработанный высокоаффинный сайт связывания анти-BACE1, который ингибировал функцию BACE1 и предотвращал образование амилоидных бляшек. Genentech удалось продемонстрировать на моделях мышей, что новое биспецифическое антитело способно достигать терапевтического уровня в мозге. [24] Метод Genentech по маскировке и транспортировке терапевтического антитела путем присоединения его к рецептор-опосредованному активатору трансцитоза получил название метода «Троянского коня».
Ссылки
[ редактировать ]- ^ «цитопэмпсис» . Бесплатный словарь .
- ^ Перес, Дж. Х.; Бранч, штат Вашингтон; Смит, Л.; Маллок, Б.М.; Луцио, JP (1988). «Исследование эндосомальных компартментов, участвующих в эндоцитозе и трансцитозе полимерного иммуноглобулина А, путем субклеточного фракционирования перфузированной изолированной печени крыс» . Биохимический журнал . 251 (3): 763–770. дои : 10.1042/bj2510763 . ПМК 1149069 . ПМИД 3415644 .
- ^ Фишман, Дж.Б.; Рубин, Дж.Б.; Хандрахан, СП; Коннор-младший; Хорошо, RE (1987). «Рецепторно-опосредованный трансцитоз трансферрина через гематоэнцефалический барьер». Журнал нейробиологических исследований . 18 (2): 299–304. дои : 10.1002/jnr.490180206 . ПМИД 3694713 . S2CID 37435066 .
- ^ Даффи, КР; Пардридж, WM (1987). «Трансцитоз инсулина через гематоэнцефалический барьер у развивающихся кроликов». Исследования мозга . 420 (1): 32–38. дои : 10.1016/0006-8993(87)90236-8 . ПМИД 3315116 . S2CID 20376106 .
- ^ Уильямс, СК; Гринер, Д.А.; Соленски, Нью-Джерси (1984). «Эндоцитоз и экзоцитоз белка в эндотелии капилляров». Журнал клеточной физиологии . 120 (2): 157–162. дои : 10.1002/jcp.1041200208 . ПМИД 6430919 . S2CID 24779404 .
- ^ Фабиан, Р.Х. (1991). «Ретроградный аксональный транспорт и трансцитоз иммуноглобулинов: значение для патогенеза аутоиммунного заболевания двигательных нейронов». Достижения в неврологии . 56 : 433–444. ПМИД 1853776 .
- ^ Сало, Дж.; Лехенкари, П.; Мулари, М.; Метсикко, К.; Вяэнянен, Гонконг (1997). «Удаление продуктов резорбции кости остеокластов путем трансцитоза». Наука . 276 (5310): 270–273. дои : 10.1126/science.276.5310.270 . ПМИД 9092479 .
- ^ Ландсверк, Т. (1987). «Фолликул-ассоциированный эпителий пейеровой бляшки подвздошной кишки у жвачных животных отличается выделением частиц размером 50 нм». Иммунология и клеточная биология . 65 (3): 251–261. дои : 10.1038/icb.1987.28 . ПМИД 3623609 . S2CID 22439008 .
- ^ Тауб, Мэн; Шен, WC (1993). «Регуляция путей трансцитоза внутри культивируемых эпителиальных клеток конъюгата пероксидазы и полилизина, связанного с базальной мембраной». Журнал клеточной науки . 106 (4): 1313–1321. дои : 10.1242/jcs.106.4.1313 . ПМИД 8126110 .
- ^ Ханзикер, В.; Питерс, П.Дж. (1998). «Rab17 локализуется в рециркулирующих эндосомах и регулирует рецептор-опосредованный трансцитоз в эпителиальных клетках» . Журнал биологической химии . 273 (25): 15734–15741. дои : 10.1074/jbc.273.25.15734 . ПМИД 9624171 .
- ^ Казанова, Дж. Э.; Ван, X.; Кумар, Р.; Бхартур, СГ; Наварра, Дж.; Вудрам, Дж. Э.; Альтшулер, Ю.; Рэй, GS; Голденринг, младший (1999). «Ассоциация Rab25 и Rab11a с апикальной системой рециркуляции поляризованных клеток почек собак Мадина-Дарби» . Молекулярная биология клетки . 10 (1): 47–61. дои : 10.1091/mbc.10.1.47 . ПМК 25153 . ПМИД 9880326 .
- ^ Су, Т.; Брайант, DM; Лутон, Рузвельт; Вержес, М.; Ульрих, С.М.; Хансен, КЦ; Датта, А.; Истберн, диджей; Берлингейм, Алабама; Шокат, К.М.; Мостов, К.Э. (2010). «Киназный каскад, ведущий к Rab11-FIP5, контролирует трансцитоз полимерного рецептора иммуноглобулина» . Природная клеточная биология . 12 (12): 1143–1153. дои : 10.1038/ncb2118 . ПМЦ 3072784 . ПМИД 21037565 .
- ^ Розато, Р.; Джемс, Х.; Белэр, Л.; Пюиссант, К.; Креэнбюль, JP; Джиан, Дж. (1995). «Экспрессия гена рецептора полимерного Ig в молочной железе кролика во время беременности и лактации: эволюция и гормональная регуляция». Молекулярная и клеточная эндокринология . 110 (1–2): 81–87. дои : 10.1016/0303-7207(95)03519-д . ПМИД 7672455 . S2CID 10960352 .
- ^ Сан, Ю.; Обнимать.; Чжан, X.; Миншалл, Р.Д. (2009). «Фосфорилирование кавеолина-1 регулирует индуцированную оксидантами проницаемость легочных сосудов через парацеллюлярные и трансклеточные пути» . Исследование кровообращения . 105 (7): 676–685, 15 685 после 685. doi : 10.1161/CIRCRESAHA.109.201673 . ПМЦ 2776728 . ПМИД 19713536 .
- ^ Гири, КП; Шима, К.; Высокий, BD; Кертис, С.; Сатьямурти, В.; Ханиш, Б.; Ким, Канзас; Копецко, диджей (2011). « Cronobacter Вид (ранее Enterobacter sakazakii ) проникает и перемещается как через культивируемые эпителиальные клетки кишечника человека, так и через эндотелиальные клетки микрососудистых сосудов головного мозга человека» . Микробный патогенез . 52 (2): 140–7. дои : 10.1016/j.micpath.2011.10.003 . ПМИД 22023990 .
- ^ Никитас, Г.; Дешам, К.; Диссон, О.; Нио, Т.; Коссар, П.; Лекуит, М. (2011). «Трансцитоз Listeria monocytogenes через кишечный барьер при специфическом нацеливании на доступный для бокаловидных клеток E-кадгерин» . Журнал экспериментальной медицины . 208 (11): 2263–2277. дои : 10.1084/jem.20110560 . ПМК 3201198 . ПМИД 21967767 .
- ^ Лукьяненко В.; Малюкова И.; Хаббард, А.; Деланной, М.; Бодекер, Э.; Чжу, К.; Чеботару, Л.; Ковбаснюк, О. (2011). «Энтерогеморрагическая инфекция, вызванная Escherichia coli, стимулирует макропиноцитоз и трансцитоз шига-токсина 1 через эпителиальные клетки кишечника» . AJP: Клеточная физиология . 301 (5): C1140–C1149. doi : 10.1152/ajpcell.00036.2011 . ПМЦ 3213915 . ПМИД 21832249 .
- ^ Симионеску, Н.; Симионеску, М. (1985). «Взаимодействие эндогенных липопротеинов с эндотелием капилляров у крыс со спонтанной гиперлипопротеинемией». Микрососудистые исследования . 30 (3): 314–332. дои : 10.1016/0026-2862(85)90063-9 . ПМИД 4088094 .
- ^ Пардридж, WM (1986). «Рецепторно-опосредованный транспорт пептидов через гематоэнцефалический барьер». Эндокринные обзоры . 7 (3): 314–330. дои : 10.1210/edrv-7-3-314 . ПМИД 3017689 .
- ^ Брайтман, Миссури; Риз, Т.С. (1969). «Соединения между тесно прилегающими клеточными мембранами в мозге позвоночных» . Журнал клеточной биологии . 40 (3): 648–677. дои : 10.1083/jcb.40.3.648 . ПМК 2107650 . ПМИД 5765759 .
- ^ Бундгаард, М (1984). «Трехмерная организация плотных контактов в эндотелии капилляров, выявленная с помощью электронной микроскопии серийных срезов». Журнал исследований ультраструктуры . 88 (1): 1–17. дои : 10.1016/s0022-5320(84)90177-1 . ПМИД 6545375 .
- ^ Пардридж, WM (2007). «Лекарственное воздействие на мозг». Фармацевтические исследования . 24 (9): 1733–1744. дои : 10.1007/s11095-007-9324-2 . ПМИД 17554607 . S2CID 845668 .
- ^ Пардридж, штат Вашингтон; Боадо, Р.Дж. (2012). Реинжиниринг биофармацевтических препаратов для адресной доставки через гематоэнцефалический барьер . Методы энзимологии. Том. 503. стр. 269–292. дои : 10.1016/B978-0-12-396962-0.00011-2 . ISBN 9780123969620 . ПМИД 22230573 .
- ^ Ю, Ю. Джой; и др. (2001). «Повышение усвоения мозгом терапевтического антитела за счет снижения его сродства к мишени трансцитоза». Наука трансляционной медицины . 3 (84): 84. doi : 10.1126/scitranslmed.3002230 . ПМИД 21613623 . S2CID 34161824 .