Брефельдин А
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
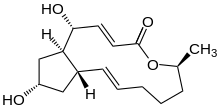
( 1R , 2E , 6S ,10E 11aS , , ,13S -1,13 14aR ) -Дигидрокси-6-метил-1,6,7,8,9,11а,12,13,14 ,14a-декагидро- 4H- циклопента[ f ][1]оксациклотридецин-4-он | |
| Другие имена
γ,4-Дигидрокси-2-(6-гидрокси-1-гептенил)-4-циклопентанкротоновая кислота λ-лактон [ нужна ссылка ]
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.127.053 |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 16 Н 24 О 4 | |
| Молярная масса | 280.36 g/mol |
| Появление | Кристаллический порошок от белого до почти белого цвета |
| Температура плавления | От 204 до 205 ° C (от 399 до 401 ° F; от 477 до 478 К) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Брефелдин А — лактонный противовирусный препарат , вырабатываемый грибом Penicillium brefeldianum . [ 1 ] Брефельдин А косвенно ингибирует транспорт белка из эндоплазматического ретикулума в комплекс Гольджи, предотвращая ассоциацию оболочки COP-I. [ 2 ] Гольджи к мембране . Брефелдин А изначально был выделен с надеждой стать противовирусным препаратом. [ 3 ] но в настоящее время в основном используется в исследованиях по изучению транспорта белков.
История
[ редактировать ]Соединение получило свое название от вида гриба анаморфного рода Penicillium , известного как Eupenicillium brefeldianum , хотя оно встречается у множества видов, охватывающих несколько родов. [ 4 ] Впервые он был выделен из Penicillium decumbens в 1958 году В.Л. Синглтоном, который первоначально назвал его Decumbin. [ 5 ] Позже он был идентифицирован как метаболит Х.П. Сиггсом, который затем определил химическую структуру соединения в 1971 году. [ 5 ] несколько успешных методов полного синтеза . С тех пор было описано [ 5 ] Интерес к исследованию брефелдина А изначально отсутствовал из-за плохой противовирусной активности. [ 5 ] Однако после открытия Такацуки и Тамурой в 1985 году его механизма, включающего нарушение транспорта белков, а также цитотоксических эффектов, наблюдаемых в некоторых линиях раковых клеток , исследовательские усилия были активизированы. [ 5 ] В настоящее время он используется исключительно в исследованиях, в основном как инструмент анализа для изучения мембранного трафика и динамики транспорта везикул между эндоплазматической сетью и аппаратом Гольджи. [ нужна ссылка ]
Физические свойства и информация о хранении
[ редактировать ]Брефелдин А встречается в природе в виде кристаллического твердого вещества от белого до почти белого цвета. При растворении образует прозрачный бесцветный раствор. Он растворим в метаноле (10 мг/мл), этаноле (5 мг/мл), ДМСО (20 мг/мл), ацетоне и этилацетате (1 мг/мл) без нагревания. [ 6 ] Плохо растворяется в воде (слабо смешивается ). [ 6 ] Он продается на коммерческой основе с чистотой 98% или выше. [ 6 ] Рекомендуется хранить в сухом месте при температуре -20°C, вдали от прямых солнечных лучей. Рекомендуемый срок годности для использования составляет 6 месяцев в твердом виде и 1 месяц в виде раствора при плотно закрытом хранении при температуре -20 °C. Поскольку соединение горючее, следует избегать загрязнения окислителями во избежание риска возгорания. Прямого контакта также следует избегать. [ нужна ссылка ]
Механизм действия
[ редактировать ]
В клетках млекопитающих и дрожжей основной мишенью брефелдина А является фактор обмена гуаниновых нуклеотидов (GEF), называемый GBF1 . [ 7 ] GBF1 является членом семейства GEF Arf, которые рекрутируются на мембранах Гольджи. [ 8 ] Он отвечает за регуляцию Arf1p- GTPase . [ 8 ] Это достигается путем преобразования неактивной формы Arf1p, связанной с ВВП, в активную форму, связанную с GTP. [ 8 ] Обмен нуклеотидов происходит в каталитическом домене Sec7 GBF1. Активированный Arf1p затем рекрутирует белок оболочки β-COP, субъединицу комплекса COP-I, к рецепторам, связанным с грузом, на мембране. [ 8 ] Рекрутирование белков оболочки необходимо для правильного формирования и транспорта пузырьков. Брефельдин А обратимо ингибирует функцию GBF1 неконкурентно , связываясь с комплексом, который он образует с GDP-связанным Arf1p, и предотвращая преобразование в GTP-связанную форму. [ 8 ] Отсутствие активного Arf1p предотвращает рекрутирование белков оболочки, что затем в конечном итоге индуцирует слияние соседних мембран ER и Гольджи из-за отсутствия образования пузырьков. Это связано с тем, что отсутствие образования везикул приводит к накоплению белков SNARE в аппарате Гольджи, которые в противном случае были бы связаны с покрытием покрытых белком везикул и удалены вместе с везикулами, как только они отпочковываются. [ 9 ] Белки SNARE опосредуют слияние мембран, и предполагается, что описанное накопление SNARE в аппарате Гольджи увеличивает вероятность аберрантного слияния мембраны Гольджи с мембраной ЭР. [ 9 ] Коллапс аппарата Гольджи в ЭР запускает активацию ответа развернутого белка (UPR) (или стресс ЭР ). [ 10 ] [ 11 ] что может привести к апоптозу .
Токсичность
[ редактировать ]Токсикологическое действие брефельдина А еще недостаточно изучено. [ 12 ] некоторых значениях ЛД 50 у животных, включая 250 мг/кг у мышей (межбрюшинно) и 275 мг/кг у крыс (перорально). Сообщалось о [ 12 ] В целом было показано, что антибиотики -макролиды , которые имеют макроциклическое лактонное кольцо, аналогичное брефелдину А, вызывают желудочно-кишечный дискомфорт в качестве наиболее распространенного побочного эффекта. [ 13 ] Было показано, что некоторые макролиды вызывают аллергические реакции , и, хотя это и редкость, такую возможность в случае брефелдина А пока нельзя игнорировать. [ 13 ] Соединение может связываться с гемоглобином и ингибировать поглощение кислорода, что приводит к метгемоглобинемии , форме кислородного голодания, хотя это не подтверждено. [ 13 ] Брефельдин А не считается вредным при прямом воздействии на кожу или глаза, за исключением временного раздражения. [ 13 ] При вдыхании может вызвать раздражение дыхательных путей . [ 13 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Хатчинсон, ЧР; Шу-Вэнь, Л.; Макиннес, AG; Уолтер, Дж. А. (1983). «Сравнительная биохимия жирных кислот и макролидного антибиотика (брефельдина а). Образование в пенициллах брефельдианум». Тетраэдр . 39 (21): 3507. doi : 10.1016/S0040-4020(01)88660-9 .
- ^ Хелмс, Дж. Бернд; Ротман, Джеймс Э. (1992). «Ингибирование брефельдином А мембранного фермента Гольджи, который катализирует обмен гуаниновых нуклеотидов, связанных с ARF». Природа . 360 (6402): 352–354. Бибкод : 1992Natur.360..352H . дои : 10.1038/360352a0 . ПМИД 1448152 . S2CID 4306100 .
- ^ Тамура Г, Андо К, Сузуки С, Такацуки А, Арима К (февраль 1968 г.). «Противовирусная активность брефельдина А и веррукарина А» . Дж. Антибиот . 21 (2): 160–1. дои : 10.7164/антибиотики.21.160 . ПМИД 4299889 .
- ^ Ван, Цзяньфэн; Хуан, Яоцзянь; Фанг, Мэйцзюань; Чжан, Юнцзе; Чжэн, Чжунхуэй; Чжао, Юфэнь; Су, Вэньцзинь (1 сентября 2002 г.). «Брефельдин А, цитотоксин, продуцируемый Paecilomyces sp. и Aspergillus clavatus, выделенный из Taxus mairei и Torreya grandis » . FEMS Иммунология и медицинская микробиология . 34 (1): 51–57. дои : 10.1111/j.1574-695X.2002.tb00602.x . ISSN 0928-8244 . ПМИД 12208606 .
- ^ Jump up to: а б с д и МакКлауд, Т.Г.; Бернс, член парламента; Маджадли, Федеральный округ; Мущик, генеральный менеджер; Миллер, Д.А.; Пул, КК; Роуч, Дж. М.; Росс, Джей Ти; Лебхерц, ВБ (1 июля 1995 г.). «Производство брефелдина-А» . Журнал промышленной микробиологии . 15 (1): 5–9. дои : 10.1007/BF01570006 . ISSN 0169-4146 . ПМИД 7662298 . S2CID 8511645 .
- ^ Jump up to: а б с «Брефельдин А (CAS 20350-15-6)» . Биотехнология Санта-Крус . 8 мая 2017 г.
- ^ «Ген GBF1 - GeneCards | Белок GBF1 | Антитело GBF1» . www.genecards.org .
- ^ Jump up to: а б с д и Ню, Тин-Куанг; Пфайфер, Андреа К.; Липпинкотт-Шварц, Дженнифер; Джексон, Кэтрин Л. (01 марта 2005 г.). «Динамика GBF1, брефельдина А-чувствительного фактора обмена Arf1 в аппарате Гольджи» . Молекулярная биология клетки . 16 (3): 1213–1222. doi : 10.1091/mbc.E04-07-0599 . ISSN 1059-1524 . ПМК 551486 . ПМИД 15616190 .
- ^ Jump up to: а б Небенфюр, Андреас; Ритценталер, Кристоф; Робинсон, Дэвид Г. (1 ноября 2002 г.). «Брефельдин А: расшифровка загадочного ингибитора секреции» . Физиология растений . 130 (3): 1102–1108. дои : 10.1104/стр.011569 . ISSN 1532-2548 . ПМК 1540261 . ПМИД 12427977 .
- ^ Паль Х.Л., Бауэрле (июнь 1995 г.). «Новый путь передачи сигнала из эндоплазматической сети в ядро опосредован транскрипционным фактором NF-каппа B» . ЭМБО Дж . 14 (11): 2580–8. дои : 10.1002/j.1460-2075.1995.tb07256.x . ПМЦ 398372 . ПМИД 7781611 .
- ^ Кобер Л., Зехе С., Боде Дж. (октябрь 2012 г.). «Разработка новой системы селекции на основе стресса ER для выделения высокопродуктивных клонов». Биотехнология. Биоинж . 109 (10): 2599–611. дои : 10.1002/бит.24527 . ПМИД 22510960 . S2CID 25858120 .
- ^ Jump up to: а б «ПАСПОРТ БЕЗОПАСНОСТИ Брефельдин А» (PDF) . Кайман Кемикал . 6 февраля 2015 г.
- ^ Jump up to: а б с д и «Паспорт безопасности материала. Брефельдин А (BFA) sc-200861» (PDF) . Биотехнология Санта-Крус . 20 января 2009 г.
Внешние ссылки
[ редактировать ]- Клаузнер Р.Д., Дональдсон Дж.Г., Липпинкотт-Шварц Дж. (март 1992 г.). «Брефельдин А: понимание контроля мембранного движения и структуры органелл» . Дж. Клеточная Биол . 116 (5): 1071–80. дои : 10.1083/jcb.116.5.1071 . ПМК 2289364 . ПМИД 1740466 .
- Небенфюр А., Ритценталер С., Робинсон Д.Г. (ноябрь 2002 г.). «Брефелдин А: расшифровка загадочного ингибитора секреции» . Физиол растений . 130 (3): 1102–8. дои : 10.1104/стр.011569 . ПМК 1540261 . ПМИД 12427977 .
- NCI Фредерик, Структура и данные Брефельдина А. (Изображение)