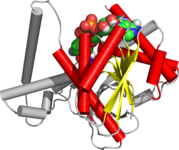
Россманн складка
В этой статье отсутствует информация о других ненуклеотидных функциях. ( февраль 2021 г. ) |
| Сэндвич-складка, подобная Россманну, альфа/бета/альфа | |
|---|---|
 НАД/НАДФ связывают домены складки Россмана. На картинке изображена бета-альфа-свертка алкогольдегидрогеназы. | |
| Идентификаторы | |
| Символ | Россманн-подобный_a/b/a_fold |
| Пфам Клан | CL0039 |
| ИнтерПро | ИПР014729 |
Складка Россмана — это третичная складка, обнаруженная в белках, связывающих нуклеотиды , таких как кофакторы ферментов FAD , NAD. + и НАДФ + . Эта складка состоит из чередующихся бета-нитей и альфа-спиральных сегментов, где бета-цепи связаны водородными связями друг с другом, образуя расширенный бета-лист , а альфа-спирали окружают обе стороны листа, образуя трехслойный сэндвич. Классическая складка Россмана содержит шесть бета-нитей, тогда как складки, подобные Россманну, иногда называемые складками Россманноида , содержат только пять нитей. Начальная бета-альфа-бета-складка (bab) является наиболее консервативным сегментом складки Россмана. [ 1 ] Мотив назван в честь Майкла Россмана, который впервые заметил этот структурный мотив в ферменте лактатдегидрогеназе в 1970 году и который позже заметил, что этот мотив часто встречается в нуклеотидсвязывающих белках. [ 2 ]
Складчатые белки Россмана и Россманноида чрезвычайно распространены. Они составляют 20% белков с известными структурами в Банке данных белков и обнаруживаются более чем в 38% метаболических путей KEGG . [ 3 ] Складка чрезвычайно универсальна, поскольку может вмещать широкий спектр лигандов. Помимо традиционной роли, они могут функционировать как метаболические ферменты, связывающие ДНК/РНК и регуляторные белки. [ 4 ]
История
[ редактировать ]Складка Россмана была впервые описана доктором Майклом Россманном и его коллегами в 1974 году. [ 5 ] Он был первым, кто определил структуру лактатдегидрогеназы и охарактеризовал структурный мотив этого фермента, который позже будет назван складкой Россмана. Впоследствии было обнаружено, что большинство дегидрогеназ, которые используют НАД или НАДФ, содержат тот же структурно консервативный мотив складки Россмана. [ 5 ] [ 6 ]
В 1989 году Исраэль Ханукоглу из Института науки Вейцмана обнаружил, что консенсусная последовательность НАДФ + сайт связывания в некоторых ферментах, которые используют НАДФ + отличается от НАД + связующий мотив. [ 7 ] Это открытие было использовано для перепроектирования коферментных специфичностей ферментов. [ 8 ]
Структура
[ редактировать ]
Складка Россмана состоит из шести параллельных бета-тяжей , образующих расширенный бета-лист . Первые три цепи соединены α-спиралями, образуя структуру бета-альфа-бета-альфа-бета. Этот паттерн дублируется один раз, образуя инвертированный тандемный повтор, содержащий шесть нитей. Всего нити расположены в порядке 321456 (1 = N-концевой, 6 = C-концевой). [ 9 ] Пять нитевидных складок типа Россмана расположены в порядке 32145. [ 10 ] Общая третичная структура складки напоминает трехслойный сэндвич, в котором начинка состоит из удлиненного бета-листа, а два ломтика хлеба образованы соединяющимися параллельными альфа-спиралями. [ 1 ]
Одной из особенностей складки Россмана является ее специфичность связывания кофактора . Путем анализа четырех НАДН-связывающих ферментов было обнаружено, что во всех четырех ферментах нуклеотидный кофактор имеет одинаковую конформацию и ориентацию по отношению к полипептидной цепи. [ 1 ]
Складка может содержать дополнительные пряди, соединенные короткими спиралями или клубками. [ 1 ] Наиболее консервативным сегментом складок Россмана является первый сегмент бета-альфа-бета. Фосфатсвязывающая петля расположена между первой бета-цепью и альфа-спиралью. На кончике второй бета-цепи имеется консервативный остаток аспартата, который участвует в связывании рибозы. [ 11 ] Поскольку этот сегмент находится в контакте с частью ADP динуклеотидов, таких как FAD , NAD и NADP, его также называют «ADP-связывающей бета-бета-складкой».
Функция
[ редактировать ]Функция складки Россмана в ферментах заключается в связывании нуклеотидных кофакторов. Это также часто способствует связыванию субстрата.
Метаболические ферменты обычно имеют одну специфическую функцию, а в случае УДФ-глюкозо-6-дегидрогеназы основная функция заключается в катализе двухстадийного НАД(+)-зависимого окисления УДФ-глюкозы в УДФ-глюкуроновую кислоту . [ 12 ] N- и C-концевые домены UgdG имеют общие структурные особенности с древними митохондриальными рибонуклеазами, называемыми MAR. MAR присутствуют у низших эукариотических микроорганизмов, имеют Россманноидную складку и принадлежат к суперсемейству изохоризматаз. Это наблюдение подтверждает, что структурные мотивы Россмана, обнаруженные в НАД(+)-зависимых дегидрогеназах, могут иметь двойную функцию, работая как домен связывания нуклеотидного кофактора и как рибонуклеаза.
Эволюция
[ редактировать ]Россман и Россманноиды
[ редактировать ]Эволюционная связь между складкой Россмана и складками, подобными Россманну, неясна. Эти складки называются россманноидами. Была выдвинута гипотеза, что все эти складки, включая складку Россмана, произошли от одной общей предковой складки, которая обладала способностью связывать нуклеотиды в дополнение к неспецифической каталитической активности. [ 5 ]
Однако анализ PDB обнаруживает свидетельства конвергентной эволюции. [ 3 ] со 156 отдельными H-группами доказуемой гомологии, из которых можно найти 123 X-группы вероятной гомологии. Группы были интегрированы в ECOD . [ 4 ]
Обычная группа Россмана
[ редактировать ]Филогенетический анализ НАДФ-связывающего фермента адренодоксинредуктазы показал, что от прокариот, многоклеточных животных и вплоть до приматов отличие мотива последовательности от большинства сайтов связывания FAD и НАД строго сохраняется. [ 13 ]
Во многих статьях и учебниках складку Россмана определяют как строгую повторяющуюся серию структур βαβ. Тем не менее, комплексное исследование складок Россмана во многих сайтах связывания NAD(P) и FAD показало, что только первая βα-структура строго консервативна. В некоторых ферментах между бета-цепями, образующими бета-лист, может быть множество петель и несколько спиралей (т. е. не одна спираль). [ 1 ] По словам Ханукоглу, эти ферменты имеют общее происхождение, о чем свидетельствуют консервативные последовательности и структурные особенности. [ 13 ]
Результат Ханукоглу (2017) подтверждается Медведевым и др. (2020) в форме «H-группы» ECOD, названной « связанной с Россманном ». Даже внутри этой группы ECOD описывает широкий спектр ненуклеотидных активностей. [ 4 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Ханукоглу I (2015). «Протеопедия: складка Россмана: бета-альфа-бета-складка в сайтах связывания динуклеотидов» . Образование в области биохимии и молекулярной биологии . 43 (3): 206–9. дои : 10.1002/bmb.20849 . ПМИД 25704928 .
- ^ Кокс М.М., Нельсон Д.Л. (2013). Ленингерские принципы биохимии (6-е изд.). Нью-Йорк: WH Freeman. ISBN 978-1-4292-3414-6 .
- ^ Jump up to: а б Медведев К.Е., Кинч Л.Н., Шеффер Р.Д., Гришин Н.В. (декабрь 2019 г.). «Функциональный анализ Россманноподобных доменов показывает конвергентную эволюцию топологии и путей реакции» . PLOS Вычислительная биология . 15 (12): e1007569. Бибкод : 2019PLSCB..15E7569M . дои : 10.1371/journal.pcbi.1007569 . ПМК 6957218 . ПМИД 31869345 .
- ^ Jump up to: а б с Медведев К.Э., Кинч Л.Н., Дастин Шеффер Р., Пей Дж., Гришин Н.В. (февраль 2021 г.). «Пятая часть белкового мира: Россманноподобные белки как эволюционно успешная структурная единица» . Журнал молекулярной биологии . 433 (4): 166788. doi : 10.1016/j.jmb.2020.166788 . ПМЦ 7870570 . ПМИД 33387532 .
Медведев К.Е. и др. «Проект Россманна» . Гришинская лаборатория . Юго-западный медицинский центр UT. - ^ Jump up to: а б с Кессель А (2010). Введение в белки: структура, функции и движение . Флорида: CRC Press. п. 143. ИСБН 978-1-4398-1071-2 .
- ^ Рао С.Т., Россманн М.Г. (май 1973 г.). «Сравнение супервторичных структур белков». Журнал молекулярной биологии . 76 (2): 241–56. дои : 10.1016/0022-2836(73)90388-4 . ПМИД 4737475 .
- ^ Ханукоглу I, Гутфингер Т (март 1989 г.). «Последовательность кДНК адренодоксинредуктазы. Идентификация сайтов связывания НАДФ в оксидоредуктазах» . Европейский журнал биохимии . 180 (2): 479–84. дои : 10.1111/j.1432-1033.1989.tb14671.x . ПМИД 2924777 .
- ^ Скраттон Н.С., Берри А., Перхэм Р.Н. (январь 1990 г.). «Изменение коферментной специфичности дегидрогеназы путем белковой инженерии». Природа . 343 (6253): 38–43. Бибкод : 1990Natur.343...38S . дои : 10.1038/343038a0 . ПМИД 2296288 . S2CID 1580419 .
- ^ «NAD(P)-связывающие домены Россмана» . SCOP: Структурная классификация белков . Архивировано из оригинала 21 ноября 2018 г. Проверено 17 декабря 2017 г.
- ^ «Нуклеотид-связывающий домен» . SCOP: Структурная классификация белков . Архивировано из оригинала 07 декабря 2018 г. Проверено 17 декабря 2017 г.
- ^ Лонго Л.М., Яблоньска Дж., Вяс П., Канаде М., Колодный Р., Бен-Тал Н., Тауфик Д.С. (декабрь 2020 г.). Дин С.М., Баудкер О. (ред.). «О появлении P-петли NTPазы и ферментов Россмана из предкового фрагмента бета-альфа-бета» . электронная жизнь . 9 : е64415. doi : 10.7554/eLife.64415 . ПМЦ 7758060 . ПМИД 33295875 .
- ^ Бхаттачарья М., Упадхьяй Р., Вишвешвара С. (2012). «Сигнатуры взаимодействия, стабилизирующие NAD(P)-связывающую складку Россмана: подход структурной сети» . ПЛОС ОДИН . 7 (12): e51676. Бибкод : 2012PLoSO...751676B . дои : 10.1371/journal.pone.0051676 . ПМЦ 3524241 . ПМИД 23284738 .
- ^ Jump up to: а б Ханукоглу I (2017). «Сохранение фермент-коферментных интерфейсов в FAD и НАДФ-связывающем адренодоксинредуктазе-повсеместном ферменте». Журнал молекулярной эволюции . 85 (5): 205–218. Бибкод : 2017JMolE..85..205H . дои : 10.1007/s00239-017-9821-9 . ПМИД 29177972 . S2CID 7120148 .