КОМАНДА бочка
| Ствол ТИМ типа альдолазы | |
|---|---|
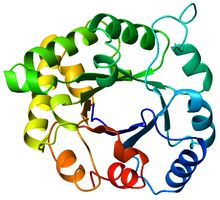 Вид сверху на цилиндр триозофосфатизомеразы (TIM) ( PDB : 8TIM ), окрашенный в цвет от синего ( N-конец ) до красного (C-конец). | |
| Идентификаторы | |
| Символ | Альдолаза_TIM |
| Пфам Клан | CL0036 |
| ИнтерПро | ИПР013785 |
| КАТ | 8 команда |
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 8тим / СКОПе / СУПФАМ |
ТИМ -цилиндр (триозофосфат-изомераза), также известный как альфа/бета-цилиндр , [ 1 ] : 252 представляет собой консервативную белковую складку, состоящую из восьми альфа-спиралей (α-спиралей) и восьми параллельных бета-цепей (β-цепей), которые чередуются вдоль пептидного остова . [ 2 ] Структура названа в честь триозофосфатизомеразы , консервативного метаболического фермента . [ 3 ] Стволы TIM распространены повсеместно: примерно 10% всех ферментов имеют эту складку. [ 4 ] Кроме того, пять из семи классов ферментов Комиссии по ферментам (EC) включают бочковые белки TIM. [ 5 ] [ 6 ] Бочкообразная складка ТИМ является эволюционно древней , и многие из ее членов мало похожи . сегодня [ 7 ] вместо этого попадая в сумеречную зону сходства последовательностей . [ 8 ] [ 9 ]
Внутренняя бета-бочка (β-бочка) во многих случаях стабилизируется сложной сетью соляных мостиков . [ 10 ] Петли на С-концевых концах β-цилиндра отвечают за каталитическую активность. [ 11 ] [ 12 ] тогда как N-концевые петли важны для стабильности ТИМ-цилиндров. Структурные вставки, начиная от расширенных петель и заканчивая независимыми белковыми доменами, могут быть вставлены вместо этих петель или на N-конце/С-конце. Стволы TIM, по-видимому, возникли в результате дупликации генов и событий слияния доменов белков-полубочек. [ 13 ] при этом большинство стволов TIM происходят от общего предка . Это привело к тому, что многие стволы TIM приобрели внутреннюю симметрию. [ 14 ] Дальнейшие события дупликации генов этого предкового ствола TIM привели к расхождению ферментов, обладающих функциональным разнообразием, наблюдаемым сегодня. Бочки TIM также долгое время были объектом внимания дизайнеров белков . Успешные конструкции стволов TIM включают как слияния доменов существующих белков, так и конструкции de novo . Эксперименты по слиянию доменов привели к созданию множества успешных проектов. [ 15 ] [ 16 ] [ 17 ] [ 18 ] [ 19 ] [ 20 ] [ 21 ] тогда как проекты de novo принесли успех только после 28 лет постепенного развития. [ 22 ]
Структура
[ редактировать ]

Топология
[ редактировать ]Бочонок ТИМ получил свое название от фермента триозофосфат-изомеразы (ТИМ), который был первым белком, имеющим складку, подлежащую кристаллизации . [ 3 ] Стволы ТИМ содержат 200-250 аминокислотных остатков, [ 2 ] свернуты в 8 альфа-спиралей (α-спирали) и 8 бета-цепей (β-нити). β-нити расположены в параллельный бета-цилиндр (β-цилиндр) и окружены 8 α-спиралями. Определяющим свойством β-цилиндров TIM является то, что они всегда имеют число сдвига 8. [ 2 ] Число сдвига определяется путем выбора остатка x на β-цепи-1 и перемещения вдоль β-цилиндра в направлении, перпендикулярном направлению нитей, до тех пор, пока не будет достигнут остаток y на исходной β-цепи-1. Количество остатков между начальным и конечным положениями (|y-x|) представляет собой число сдвига. [ 24 ] Поскольку количество нитей равно числу сдвига, боковые цепи направлены попеременно к поре и ядру, обеспечивая 4-кратную симметрию. α-спирали окружают и полностью окружают внутренний β-цилиндр. Короткие петли обычно соединяют вторичные структуры α и β, образуя топологию (βα) 8 повторов. В некоторых случаях вместо этих петель могут быть вставлены структуры, начиная от расширенных петель и заканчивая независимыми доменами, или могут быть присоединены к N/C-концам. Все ферменты ствола TIM обладают каталитическими сайтами на С-концевом конце β-цилиндра. [ 25 ] и структурные вставки, находящиеся рядом с этим концом, могут способствовать каталитической активности.
Ядро и поровые области
[ редактировать ]Стволы TIM содержат две отдельные скрытые области, где аминокислотные остатки полностью окружены своими соседями и не имеют доступа к растворителю. Термин «пора» является неправильным, поскольку в этой области не существует каналов растворителя. Центральная область состоит из всех остатков, составляющих границу раздела α-β, и расположена снаружи центрального β-цилиндра. Пористая область состоит из всех внутренних остатков β-цилиндра, которые окружены основной цепью β-цилиндра.
Из-за складчатой природы β-цепей чередующиеся остатки вдоль цепи почти равномерно распределены между порой (53%) и ядром (47%). В случае β-бочек захоронено 95% остатков ядра. Только 11% их основных остатков являются полярными , обладают сродством к воде и обладают способностью образовывать водородные связи или солевые мостики. [ 10 ] Аналогично, 84% остатков пор β-цепи скрыты. Однако 42% остатков их пор полярны. Эти остатки образуют сложную сеть солевых мостиков, чтобы компенсировать отсутствие доступа к растворителям.
Элементы стабилизации ствола ТИМ
[ редактировать ]
Считается, что солевые мостики в порах ствола TIM способствуют общей стабильности складки. Пример большой сети солевых мостиков можно найти в 2-дезоксирибозо-5-фосфатальдолазе . Было обнаружено, что эта сеть консервативна во всем семействе альдолаз класса I.
Точная причина чрезмерного представительства полярных остатков и солевых мостиков внутри поры остается неясной. Одно исследование предполагает, что они улучшают складность , а не термодинамическую стабильность стволов TIM. В процессе сворачивания остатки внутренних пор β-нитей будут подвергаться воздействию воды. Частично свернутые модули βαβα, называемые фолдонами, на этой стадии сворачивания будут энергетически стабилизированы остатками полярных пор.
В другом исследовании с участием S. solfataricus бочкового белка TIM индол-3-глицеринфосфатсинтазы было обнаружено, что консервативный модуль βαβαβ является важной матрицей сворачивания, которая направляет сворачивание других вторичных структур. Закрытие β-ствола произошло только в конце процесса складывания. Однако в этом случае авторы приписывают стабильность фолдона разветвленным алифатическим аминокислотам (валину, лейцину и изолейцину).
Еще одним стабилизирующим элементом стволов ТИМ является шпилька бета-хомута . Доноры Н-связей боковой цепи на N-концах β-цепей с четными номерами часто образуют Н-связи с амидными водородами основной цепи в предшествующих β-нитях с нечетными номерами. Эти зажимы (или аналоги гидрофобных мостиков боковой цепи) консервативны в ортологах 3-индол-3-глицеринфосфат-синтазы TIM из бактериального и архейного царств, что означает, что они возникли у своего последнего общего предка и сохранились более миллиарда лет.
Структурные вставки
[ редактировать ]
N/C-концевые и петлевые области бочкообразных белков TIM способны содержать структурные вставки, варьирующиеся от простых вторичных структурных мотивов до полных доменов . Эти домены способствуют распознаванию субстрата и каталитической активности. Ниже обсуждаются четыре различных примера стволов TIM, содержащих дополнительные мотивы и домены.
Bacillus subtilis Оротидин-5'-фосфатдекарбоксилаза ( PDB : 1DBT ) представляет собой белок ствола TIM, демонстрирующий 4 α-спирали вместо петель βα, обычно присутствующих на C-конце β-цилиндра (остатки 35–42, 89–91). , 126–133 и 215–219). Одна из этих спиралей (R215→K219) содержит консервативный остаток аргинина (R215), необходимый для взаимодействия с фосфатным фрагментом оротидин-5'-монофосфата. Не было обнаружено, что другие спирали содержат остатки, критические для каталитической активности, и могут выполнять структурную роль.
Бифункциональная изомераза биосинтеза гистидина/триптофана Mycobacterium Tuberculosis (PriA) ( PDB : 2Y85 ) обладает способностью катализировать две реакции: (i) реакцию HisA: превращение N-[(5-фосфорибозил)формимино]-5-аминоимидазол-4- карбоксамидрибонуклеотид (ProFAR) с N-[(5-фосфорибулозил)формимино]-5-аминоимидазол-4-карбоксамидрибонуклеотидом (PRFAR) и (ii) реакция TrpF: N-(5'-фосфорибозил)антранилат (PRA) с 1-(О-карбоксифениламино)-1'-дезоксирибулозо-5'-фосфат (CdRP). PriA представляет собой фермент-цилиндр TIM, который приспосабливает оба субстрата с помощью петель активного центра (петли 1, 5 и 6, расширенные петли βα на С-концевом конце β-цилиндра), которые меняют конформацию в зависимости от присутствующего реагента. Цикл 1 охватывает активный сайт только при наличии ProFAR. Loop5 оборачивается вокруг активного сайта, принимая конформацию β-листа в присутствии CdRP или узловую конформацию в присутствии ProFAR. Петля 6 охватывает активный центр для всех реагентов.
Lactococcus Lactis Дигидрооротатдегидрогеназа A (DHODA) ( PDB : 2DOR ) является примером ствола TIM, обладающего β-листами и расширенными петлями на С-концевом конце β-цилиндра. DHODA катализирует окисление дигидрооротата в оротат, что является частью de novo пути синтеза уридин-5'-монофосфата (UMP) . Это окисление опосредуется флавинмононуклеотидом (FMN). Здесь β-листы и удлиненные петли окружают активный центр, образуя полость, а также содержат несколько каталитических остатков.
Цилиндр Mmethylophilus methylotropus TIM триметиламиндегидрогеназы ( PDB : 2TMD ) является примером полной вставки домена. Здесь домен складки Россмана вставлен на С-концевой конец TIM-цилиндра. Триметиламиндегидрогеназа катализирует превращение триметиламина в формальдегид. Для этой реакции требуется как восстановленный кофактор 6-S-цистеинилфлавинмононуклеотид (FMN), так и восстановленный железо-серный ([4Fe-4S] + ) центр. ФМН ковалентно связан с С-концевой областью β-цилиндра. [4Fe-4S] + Центр слишком велик, чтобы поместиться внутри цилиндра ТИМ, и вместо этого расположен в непосредственной близости, на расстоянии 7 Å, на границе раздела между стволом ТИМ и складчатыми доменами Россмана.
Складные механизмы
[ редактировать ]Сохранение бочкообразной складки TIM отражается сохранением ее равновесных и кинетических механизмов сворачивания у бактериальных паралогов с филогенетически различными линиями. Химическая денатурация ряда природных [ 27 ] [ 28 ] и 2 разработанных варианта ствола ТИМ [ 28 ] неизменно включает в себя густонаселенный равновесный промежуточный продукт. Кинетические промежуточные продукты, которые появляются после разбавления сильно денатурирующих растворов, включают ранние неправильно свернутые частицы, которые должны хотя бы частично развернуться, чтобы получить доступ к продуктивному пути сворачивания. [ 27 ] [ 28 ] Стадией, лимитирующей скорость сворачивания, является закрытие 8-цепочечного β-цилиндра, при этом предыдущая форма открытого бочонка соответствует равновесному промежуточному продукту. [ 29 ] Нативно-ориентированное моделирование молекулярной динамики резюмирует экспериментальные результаты и указывает путь к тестируемым вычислительным моделям для сложных механизмов складывания. [ 30 ]
Сохранившиеся фитнес-ландшафты
[ редактировать ]Белки TIM-бочонка обладают необычайно высокой пластичностью последовательностей, образуя большие семейства ортологичных и паралогичных ферментов в широко расходящихся организмах. Эта пластичность предполагает ландшафт последовательностей, который позволяет белкам адаптироваться к множеству условий окружающей среды, в значительной степени независимо от филогенетической истории, сохраняя при этом функцию. Глубокое мутационное сканирование [ 31 ] подход и конкурентный анализ [ 32 ] был использован для определения пригодности всех возможных аминокислотных мутантов по положениям в 3-х гипертермофильных индол-3-глицеролфосфатсинтазах (IGPS) бочковых ферментах TIM для поддержки роста дрожжевого хозяина, лишенного IGPS. Хотя 2 бактериальных и 1 архейный фермент IGPS были идентичны по последовательности только на 30-40%, их ландшафты приспособленности были сильно коррелированы: одни и те же аминокислоты в одних и тех же положениях в трех разных белках имели очень схожую приспособленность. Корреляцию можно рассматривать как сохранение ландшафта приспособленности для фермента ствола ТИМ на протяжении эволюционного времени.
Петлевые регионы
[ редактировать ]Из примерно 200 остатков, необходимых для полного формирования ствола TIM, около 160 считаются структурно эквивалентными между различными белками, имеющими эту складку. Остальные остатки расположены на участках петель, связывающих спирали и цепи; петли на С-концевом конце цепей, как правило, содержат активный центр , что является одной из причин, по которой эта складка настолько распространена: остатки, необходимые для поддержания структуры, и остатки, которые влияют на ферментативный катализ, по большей части представляют собой отдельные подмножества: [ 33 ] Фактически, связывающие петли могут быть настолько длинными, что содержат другие белковые домены. Недавно было продемонстрировано, что каталитические петли могут обмениваться между различными ферментами ствола TIM как полуавтономными единицами функциональных групп. [ 34 ]
Эволюция и происхождение
[ редактировать ]

Преобладающая теория эволюции ствола ТИМ предполагает дупликацию и слияние генов, начиная с полуствола, который в конечном итоге образует полный ствол ТИМ. Многочисленные исследования подтверждают теорию дивергентной эволюции от одного предка и обсуждаются ниже.
Эволюция от общего предка
[ редактировать ]В начале 1990-х годов было отмечено, что все ствольные структуры TIM, решенные в то время, были ферментами, что указывает на отклонение от общего предка. [ 11 ] [ 12 ] Кроме того, все TIM-цилиндры обладали активными сайтами на С-конце β-цилиндров. предположили, что общий сайт связывания фосфата, образованный небольшой α-спиралью и бочкообразными петлями TIM-7/8, убедительно указывает на дивергентную эволюцию. [ 35 ] Дальнейшие исследования этих фосфатных групп привели к выводу, что 12 из 23 семейств стволов SCOP TIM произошли от общего предка. [ 36 ] Точно так же были намеки на общее происхождение 17 из 21 семейства стволов CATH TIM. [ 7 ] На основании этих сообщений считается правдоподобным, что большинство бочковых белков TIM произошли от общего предка.
Происхождение посредством дупликации генов и слияния доменов
[ редактировать ]
Многие бочковые белки TIM обладают 2-кратной, 4-кратной или 8-кратной внутренней симметрией, что указывает на то, что стволы TIM произошли от предковых (βα) 4 , (βα) 2 или βα мотивов посредством дупликации генов и слияния доменов . Хороший пример двукратной внутренней симметрии наблюдается у ферментов ProFAR-изомеразы (HisA) и имидазолглицеринфосфатсинтазы (HisF) Thermotoga maritima пути биосинтеза гистидина . [ 13 ] Они катализируют 2 последовательные реакции этого пути, обладают 25% гомологией последовательностей и имеют среднеквадратические отклонения (RMSD) в пределах 1,5–2 Å, что указывает на отклонение от общего предка. Что еще более интересно, петли на C-концах HisA и HisF демонстрируют двукратно повторяющийся паттерн, что позволяет предположить, что их общий предок также обладал двукратной внутренней симметрией. На основе этих наблюдений была построена модель эволюции стволов ТИМ. [ 13 ] Предковая полубочка претерпела бы дупликацию генов и слияние, в результате чего образовался один белок, содержащий два домена полубочки. Произойдут структурные адаптации, приводящие к слиянию этих доменов с образованием закрытого β-цилиндра и образованию предкового ствола TIM. Функциональные адаптации также могли произойти, что привело к развитию новой каталитической активности на С-конце β-цилиндра. В этот момент общий предок HisA и HisF должен был подвергнуться второму событию дупликации генов. Дивергентная эволюция дуплицированных генов предкового ствола TIM привела бы к образованию HisA и HisF.
Интересно, что эта эволюционная модель была экспериментально подтверждена с использованием рационального дизайна белков и направленной эволюции . Хёккер и др. сначала соединил две C-концевые половины HisF, получив HisF-CC. Эту конструкцию затем стабилизировали путем введения внутреннего солевого мостика , получая HisF-C*C. [ 17 ] Дальнейшая ступенчатая стабилизация и солюбилизация HisF-C*C была достигнута за счет оптимизации интерфейса полуцилиндра, генерируя HisF-C**C и HisF-C***C соответственно. [ 15 ] [ 16 ] Кристаллическая структура HisF-C***C выявила двукратно симметричный TIM-цилиндр, что подтверждает возможность естественного слияния доменов. Более того, Хёккер создал первые химерные стволы HisAF и HisFA TIM, используя полустволки HisA и HisF. [ 17 ] Эти эксперименты привели к предложению новых способов диверсификации и эволюции ферментов TIM-бочонка путем обмена доменами (βα)4 полубочонков между ранее существовавшими стволами TIM. В соответствии с этой идеей установлена высокая каталитическая активность конструкции HisAF. [ 18 ] Аналогично, химерные βα 5 -флаводоксин-подобные стволы (CheY)/HisF TIM, [ 19 ] [ 20 ] и идеально двукратно симметричный ствол ТИМ на основе HisF [ 21 ] [ 28 ] также были созданы.
Существование внутренней симметрии 4/8-го порядка было предположено на основе компьютерного анализа последовательностей стволов TIM. [ 14 ] Например, Escherichia coli. KDPG-альдолаза [ 37 ] Было высказано предположение, что ( PDB : 1FQ0 ) обладает отчетливой 4-кратной симметрией с заметной 8-кратной симметрией. Конструкция 4-кратного симметричного ствола ТИМ [ 22 ] подтвердил возможность существования более высоких порядков внутренней симметрии в природных стволах ТИМ и будет подробно обсуждаться в следующем разделе. На сегодняшний день не имеется экспериментальных доказательств существования 8-кратно симметричных стволов ТИМ.
И снова конструкция ствола ТИМ
[ редактировать ]
Бочкообразная складка TIM была давней целью для de novo дизайнеров белков . Как описывалось ранее, многочисленные стволы TIM были успешно спроектированы на основе ранее существовавших натуральных полустволок. Напротив, разработка стволов TIM de novo происходила поэтапно в течение 28 лет. [ 38 ]
Серия Октареллин. [ 39 ] [ 40 ] [ 41 ] [ 42 ] [ 43 ] белков (октареллин I→VI) были первыми попытками создать ствол ТИМ de novo . Поскольку область дизайна белков все еще находилась в зачаточном состоянии, эти попытки дизайна имели лишь ограниченный успех. Хотя они демонстрировали спектры кругового дихроизма, соответствующие белкам αβ, и некоторые характеристики кооперативной складки, все пептиды серии октареллина были нерастворимыми, и их приходилось повторно солюбилизировать из телец включения для дальнейшей характеристики. Интересно, что Октареллин В.1 [ 44 ] продемонстрировал складку, подобную Россману в сокристаллических условиях .
Белки ряда Симметрин (Симметрин-1→4) продемонстрировали более благоприятные биофизические характеристики. Симметрин-1 был легко растворим, демонстрировал спектры кругового дихроизма, соответствующие белкам αβ, и демонстрировал превосходные характеристики совместного разворачивания и рефолдинга. Несмотря на эти достижения, все белки этого семейства показали расплавленные характеристики при анализе с помощью ЯМР ( ядерный магнитный резонанс ), и дальнейшая работа по выяснению их структуры не могла быть продолжена.
Белки серии sTIM [ 22 ] представлял собой первую успешную конструкцию ствола TIM , созданную заново . [ 45 ] [ 38 ] sTIM-11 ( PDB : 5BVL ) был разработан с внутренней 4-кратной симметрией, чтобы уменьшить сложность вычислительного проектирования с использованием пакета программного обеспечения Rosetta. [ 46 ] Ранее полученные первые принципы [ 47 ] использовались для определения топологии и длины вторичной структуры. sTIM-11 оказался высокотермостабильной , складной конструкцией, которая приняла заданную структуру.
См. также
[ редактировать ]Ссылки
[ редактировать ]![]() Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 ( 2020 г. ) ( отчеты рецензента ):
Дипеш Нагараджан; Неха Нанайкар (2020). «Складной ствол ТИМ» (PDF) . Викижурнал науки 3 (1):4.doi : 10.15347 /WJS/2020.004 . ISSN 2470-6345 . Викиданные Q8
Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 ( 2020 г. ) ( отчеты рецензента ):
Дипеш Нагараджан; Неха Нанайкар (2020). «Складной ствол ТИМ» (PDF) . Викижурнал науки 3 (1):4.doi : 10.15347 /WJS/2020.004 . ISSN 2470-6345 . Викиданные Q8
- ^ Воет Д., Воет Дж.Г. (2011). «Глава 8. Трехмерные структуры белков». Биохимия (4-е изд.). Джон Уайли и сыновья, Inc. ISBN 978-0470-91745-9 .
- ^ Jump up to: а б с Веренга РК (март 2001 г.). «ТИМ-бочонок: универсальная основа для эффективных ферментов» . Письма ФЭБС . 492 (3): 193–8. Бибкод : 2001FEBSL.492..193W . дои : 10.1016/s0014-5793(01)02236-0 . ПМИД 11257493 . S2CID 42044123 .
- ^ Янсен Р., Герштейн М. (март 2000 г.). «Анализ транскриптома дрожжей со структурными и функциональными категориями: характеристика высокоэкспрессируемых белков» . Исследования нуклеиновых кислот . 28 (6): 1481–8. дои : 10.1093/нар/28.6.1481 . ПМК 111042 . ПМИД 10684945 .
- ^ Нагано Н., Хатчинсон Э.Г., Торнтон Дж.М. (октябрь 1999 г.). «Бочковые структуры в белках: автоматическая идентификация и классификация, включая анализ последовательности стволов TIM» . Белковая наука . 8 (10): 2072–84. дои : 10.1110/пс.8.10.2072 . ПМК 2144152 . ПМИД 10548053 .
- ^ Уэбб ЕС (1992). Номенклатура ферментов: Рекомендации Номенклатурного комитета Международного союза биохимии и молекулярной биологии по номенклатуре и классификации ферментов . Академическая пресса. ISBN 978-0-12-227164-9 .
- ^ Jump up to: а б Нагано Н., Оренго, Калифорния, Торнтон Дж. М. (август 2002 г.). «Одно сложение со многими функциями: эволюционные отношения между семействами стволов TIM, основанные на их последовательностях, структурах и функциях». Журнал молекулярной биологии . 321 (5): 741–65. дои : 10.1016/s0022-2836(02)00649-6 . ПМИД 12206759 .
- ^ Ливсей ДР, Ла Д (май 2005 г.). «Эволюционное происхождение и каталитическая важность консервативных электростатических сетей внутри белков TIM-бочонка» . Белковая наука . 14 (5): 1158–70. дои : 10.1110/ps.041221105 . ПМЦ 2253277 . ПМИД 15840824 .
- ^ Чунг С.Ю., Суббия С. (октябрь 1996 г.). «Структурное объяснение сумеречной зоны гомологии белковых последовательностей» . Структура . 4 (10): 1123–7. дои : 10.1016/s0969-2126(96)00119-0 . ПМИД 8939745 .
- ^ Jump up to: а б Виджаябаскар М.С., Вишвешвара С. (2012). «Понимание складчатой организации ствола ТИМ на основе взаимодействия структурных сетей, основанных на энергии» . PLOS Вычислительная биология . 8 (5): e1002505. Бибкод : 2012PLSCB...8E2505V . дои : 10.1371/journal.pcbi.1002505 . ПМК 3355060 . ПМИД 22615547 .
- ^ Jump up to: а б Фарбер Г.К., Пецко Г.А. (июнь 1990 г.). «Эволюция ферментов альфа-бета-барреля». Тенденции биохимических наук . 15 (6): 228–34. дои : 10.1016/0968-0004(90)90035-А . ПМИД 2200166 .
- ^ Jump up to: а б Рирдон Д., Фарбер Г.К. (апрель 1995 г.). «Структура и эволюция белков альфа-/бета-бочонка» . Журнал ФАСЭБ . 9 (7): 497–503. дои : 10.1096/fasebj.9.7.7737457 . ПМИД 7737457 . S2CID 23208817 .
- ^ Jump up to: а б с д Ланг Д., Тома Р., Хенн-Сакс М., Штернер Р., Вильманс М. (сентябрь 2000 г.). «Структурные доказательства эволюции каркаса бета- / альфа-цилиндра путем дупликации и слияния генов». Наука . 289 (5484): 1546–50. Бибкод : 2000Sci...289.1546L . дои : 10.1126/science.289.5484.1546 . ПМИД 10968789 .
- ^ Jump up to: а б Сёдинг Дж., Реммерт М., Бигерт А. (июль 2006 г.). «HHrep: обнаружение повторов белка de novo и происхождение стволов TIM» . Исследования нуклеиновых кислот . 34 (проблема с веб-сервером): W137-42. дои : 10.1093/нар/gkl130 . ПМЦ 1538828 . ПМИД 16844977 .
- ^ Jump up to: а б Зейтц Т., Бокола М., Кларен Дж., Стернер Р. (сентябрь 2007 г.). «Стабилизация (βα)8-цилиндрического белка, созданного из идентичных полуцилиндров». Журнал молекулярной биологии . 372 (1): 114–29. дои : 10.1016/j.jmb.2007.06.036 . ПМИД 17631894 .
- ^ Jump up to: а б Хёккер Б., Лохнер А., Зейтц Т., Кларен Дж., Штернер Р. (февраль 2009 г.). «Кристаллическая структура высокого разрешения искусственного (βα) (8)-бочкового белка, созданного из идентичных полубочонков». Биохимия . 48 (6): 1145–7. дои : 10.1021/bi802125b . ПМИД 19166324 .
- ^ Jump up to: а б с Хёккер Б., Кларен Дж., Штернер Р., Макар А.Б., МакМартин К.Е., Палезе М., Тефли Т.Р. (июнь 1975 г.). «Анализ формиата в жидкостях организма: применение при отравлении метанолом» . Биохимическая медицина . 13 (2): 117–26. дои : 10.1016/0006-2944(75)90147-7 . ПМЦ 534502 . ПМИД 15539462 .
- ^ Jump up to: а б Кларен Дж., Малиси С., Хёккер Б., Штернер Р. (март 2009 г.). «Установление уровней каталитической активности дикого типа на природных и искусственных (бета-альфа)8-створчатых белковых каркасах» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (10): 3704–9. Бибкод : 2009PNAS..106.3704C . дои : 10.1073/pnas.0810342106 . ПМК 2656144 . ПМИД 19237570 .
- ^ Jump up to: а б Бхарат Т.А., Эйзенбайс С., Зет К., Хёккер Б. (июль 2008 г.). «Бета-альфа-бочка, построенная из комбинации фрагментов из разных складок» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (29): 9942–7. Бибкод : 2008PNAS..105.9942B . дои : 10.1073/pnas.0802202105 . ПМЦ 2481348 . ПМИД 18632584 .
- ^ Jump up to: а б Эйзенбайс С., Проффитт В., Коулз М., Трюффо В., Шанмугаратнам С., Мейлер Дж., Хёккер Б. (март 2012 г.). «Возможность рекомбинации фрагментов для рационального дизайна белков». Журнал Американского химического общества . 134 (9): 4019–22. дои : 10.1021/ja211657k . ПМИД 22329686 .
- ^ Jump up to: а б Фортенберри С., Боуман Э.А., Проффитт В., Дорр Б., Комбс С., Харп Дж. и др. (ноябрь 2011 г.). «Изучение симметрии как путь к вычислительному дизайну больших белковых доменов» . Журнал Американского химического общества . 133 (45): 18026–9. дои : 10.1021/ja210593m . ПМЦ 3781211 . ПМИД 21978247 .
- ^ Jump up to: а б с Хуанг П.С., Фельдмайер К., Пармеджиани Ф., Веласко Д.А., Хёккер Б., Бейкер Д. (январь 2016 г.). «Разработка de novo четырехкратно симметричного белка TIM-бочонка с точностью на атомном уровне» . Химическая биология природы . 12 (1): 29–34. doi : 10.1038/nchembio.1966 . ПМЦ 4684731 . ПМИД 26595462 .
- ^ Нагараджан Д., Дека Г., Рао М. (август 2015 г.). «Дизайн симметричных бочкообразных белков ТИМ на основе первых принципов» . БМК Биохимия . 16 (1): 18. дои : 10.1186/s12858-015-0047-4 . ПМЦ 4531894 . ПМИД 26264284 .
- ^ Мурзин А.Г., Леск А.М., Чотия С. (март 1994 г.). «Принципы, определяющие структуру стволов бета-листов в белках. I. Теоретический анализ». Журнал молекулярной биологии . 236 (5): 1369–81. дои : 10.1016/0022-2836(94)90064-7 . ПМИД 8126726 .
- ^ Бренден К.И. (1991). «Бочка ТИМ — наиболее часто встречающийся мотив сворачивания в белках». Современное мнение в области структурной биологии . 1 (6): 978–983. дои : 10.1016/0959-440x(91)90094-a .
- ^ Барбер М.Дж., Ним П.Дж., Лим Л.В., Уайт С., Мэтьюз Ф.С. (апрель 1992 г.). «Корреляция выведенных рентгеновскими лучами и экспериментальных аминокислотных последовательностей триметиламиндегидрогеназы» . Журнал биологической химии . 267 (10): 6611–9. дои : 10.1016/S0021-9258(19)50471-9 . ПМИД 1551870 .
- ^ Jump up to: а б Форсайт В.Р., Билсел О., Гу З., Мэтьюз С.Р. (сентябрь 2007 г.). «Топология и последовательность сворачивания бочкообразного белка TIM: глобальный анализ подчеркивает разделение между временными промежуточными продуктами сворачивания вне пути и стабильными промежуточными продуктами сворачивания на пути в сложном механизме сворачивания (βα)8-цилиндра с неизвестной функцией из B. subtilis». Журнал молекулярной биологии . 372 (1): 236–53. дои : 10.1016/j.jmb.2007.06.018 . ПМИД 17619021 .
- ^ Jump up to: а б с д Карстенсен Л., Сперл Дж. М., Бокола М., Лист Ф, Шмид FX, Стернер Р. (август 2012 г.). «Сохранение механизма сворачивания между созданными изначальными (βα) 8-цилиндрическими белками и их современными потомками». Журнал Американского химического общества . 134 (30): 12786–91. дои : 10.1021/ja304951v . ПМИД 22758610 .
- ^ Гу З, Рао М.К., Форсайт В.Р., Финке Дж.М., Мэтьюз С.Р. (ноябрь 2007 г.). «Структурный анализ кинетических промежуточных продуктов сворачивания бочкообразного белка TIM, индол-3-глицеринфосфатсинтазы, с помощью водородообменной масс-спектрометрии и моделирования модели Gō» . Журнал молекулярной биологии . 374 (2): 528–46. дои : 10.1016/j.jmb.2007.09.024 . ПМК 2735044 . ПМИД 17942114 .
- ^ Холлоран К.Т., Ван Ю., Арора К., Чакраварти С., Ирвинг Т.С., Билсел О. и др. (август 2019 г.). «Разрушение и сворачивание бочкообразного белка ТИМ» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (33): 16378–16383. Бибкод : 2019PNAS..11616378H . дои : 10.1073/pnas.1900880116 . ПМК 6697809 . ПМИД 31346089 .
- ^ Чан Ю.Х., Венев С.В., Зельдович К.Б., Мэтьюз Ч.Р. (март 2017 г.). «Корреляция ландшафтов приспособленности из трех ортологичных стволов TIM возникает из-за ограничений последовательности и структуры» . Природные коммуникации . 8 : 14614. Бибкод : 2017NatCo...814614C . дои : 10.1038/ncomms14614 . ПМЦ 5343507 . ПМИД 28262665 .
- ^ Хитпас РТ, Дженсен Дж.Д., Болон Д.Н. (май 2011 г.). «Экспериментальное освещение фитнес-ландшафта» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (19): 7896–901. дои : 10.1073/pnas.1016024108 . ПМК 3093508 . ПМИД 21464309 .
- ^ Очоа-Лейва А, Соберон Х, Санчес Ф, Аргуэльо М, Монтеро-Моран Г, Сааб-Ринкон Г (апрель 2009 г.). «Дизайн белка посредством систематического обмена каталитической петли в (бета / альфа) 8-кратном положении». Журнал молекулярной биологии . 387 (4): 949–64. дои : 10.1016/j.jmb.2009.02.022 . ПМИД 19233201 .
- ^ Очоа-Лейва А, Барона-Гомес Ф, Сааб-Ринкон Г, Вердель-Аранда К, Санчес Ф, Соберон Х (август 2011 г.). «Изучение структурно-функциональной адаптивности петли (β / α) (8)-цилиндрического фермента посредством замены петель и шарнирной изменчивости». Журнал молекулярной биологии . 411 (1): 143–57. дои : 10.1016/j.jmb.2011.05.027 . ПМИД 21635898 .
- ^ Бренден К.И. (1991). «Бочка ТИМ — наиболее часто встречающийся мотив сворачивания в белках». Современное мнение в области структурной биологии . 1 (6): 978–983. дои : 10.1016/0959-440x(91)90094-a .
- ^ Копли Р.Р., Борк П. (ноябрь 2000 г.). «Гомология среди (βα)(8) стволов: значение для эволюции метаболических путей» . Журнал молекулярной биологии . 303 (4): 627–41. дои : 10.1006/jmbi.2000.4152 . ПМИД 11054297 .
- ^ Уаймер Н., Бьюкенен Л.В., Хендерсон Д., Мехта Н., Боттинг С.Х., Почивавсек Л. и др. (январь 2001 г.). «Направленная эволюция нового каталитического сайта 2-кето-3-дезокси-6-фосфоглюконатальдолазы из Escherichia coli» . Структура . 9 (1): 1–9. дои : 10.1016/S0969-2126(00)00555-4 . ПМИД 11342129 .
- ^ Jump up to: а б Борман С. (2015). «Белковые дизайнеры выкатывают бочку» . Новости химии и техники . Том. 93, нет. 47. с. 6.
- ^ Горай К., Ренард А., Марсьяль Дж.А. (март 1990 г.). «Синтез, очистка и первоначальная структурная характеристика октареллина, полипептида de novo, смоделированного на белках альфа / бета-бочонка». Белковая инженерия . 3 (4): 259–66. дои : 10.1093/белок/3.4.259 . ПМИД 2188263 .
- ^ Борегар М., Горай К., Гоффин В., Хереманс К., Гурмахтиг Э., Рюйшерт Дж.М., Марсьяль Дж.А. (октябрь 1991 г.). «Спектроскопическое исследование структуры октареллина (белка de novo, разработанного с учетом упаковки альфа / бета-цилиндра)». Белковая инженерия . 4 (7): 745–9. дои : 10.1093/протеин/4.7.745 . ПМИД 1798699 .
- ^ Убрехтс А., Моро Б., Абагян Р., Мэнфруа В., Прео Дж., Лампрой А. и др. (март 1995 г.). «Октареллины второго поколения: два новых полипептида de novo (бета/альфа)8, предназначенных для исследования влияния упаковки бета-остатков на стабильность структуры альфа/бета-цилиндра». Белковая инженерия . 8 (3): 249–59. дои : 10.1093/протеин/8.3.249 . ПМИД 7479687 .
- ^ Оффреди Ф., Дубал Ф., Кишель П., Сарински К., Стерн А.С., Ван де Вердт С. и др. (январь 2003 г.). «Основная цепь de novo и дизайн последовательности идеализированного белка альфа / бета-бочонка: свидетельства стабильной третичной структуры» (PDF) . Журнал молекулярной биологии . 325 (1): 163–74. дои : 10.1016/S0022-2836(02)01206-8 . ПМИД 12473459 .
- ^ Фигероа М., Оливейра Н., Лежен А., Кауфманн К.В., Дорр Б.М., Матань А. и др. (2013). «Октареллин VI: использование розетки для создания предполагаемого искусственного белка (β/α)8» . ПЛОС ОДИН . 8 (8): е71858. Бибкод : 2013PLoSO...871858F . дои : 10.1371/journal.pone.0071858 . ПМК 3747059 . ПМИД 23977165 .
- ^ Фигероа М., Слейтель М., Вандевенн М., Парвизи Г., Атту С., Жакин О. и др. (июль 2016 г.). «Неожиданная структура разработанного белка Октареллина V.1 представляет собой проблему для инструментов прогнозирования структуры белка» . Журнал структурной биологии . 195 (1): 19–30. дои : 10.1016/j.jsb.2016.05.004 . hdl : 2268/199167 . ПМИД 27181418 .
- ^ Нанда V (январь 2016 г.). «Протеиновый дизайн: докопавшись до дна бочки ТИМ». Химическая биология природы . 12 (1): 2–3. дои : 10.1038/nchembio.1987 . ПМИД 26678608 .
- ^ Кауфманн К.В., Леммон Г.Х., Делука С.Л., Шихан Дж.Х., Мейлер Дж. (апрель 2010 г.). «Практически полезно: что может сделать для вас пакет моделирования белков Rosetta» . Биохимия . 49 (14): 2987–98. дои : 10.1021/bi902153g . ПМК 2850155 . ПМИД 20235548 .
- ^ Кога Н., Тацуми-Кога Р., Лю Г., Сяо Р., Актон ТБ, Монтелионе Г.Т., Бейкер Д. (ноябрь 2012 г.). «Принципы конструирования идеальных белковых структур» . Природа . 491 (7423): 222–7. Бибкод : 2012Natur.491..222K . дои : 10.1038/nature11600 . ПМК 3705962 . ПМИД 23135467 .
Внешние ссылки
[ редактировать ]- Список белков SCOP, использующих бочкообразную складку TIM. Архивировано 8 июля 2007 г. в Wayback Machine.
- Бабу М.М. (1998). «Анализ ствола ТИМ» . Центр биотехнологии Университета Анны . Архивировано из оригинала 15 июня 2013 г. Проверено 28 ноября 2011 г.
- Статьи Википедии, опубликованные в рецензируемой литературе
- Статьи Википедии, опубликованные в WikiJournal of Science
- Статьи, рецензируемые внешними экспертами
- Статьи Википедии, опубликованные в рецензируемой литературе (J2W)
- Белковые тандемные повторы
- Белковые складки
- Белковые суперсемейства
- Белковые домены