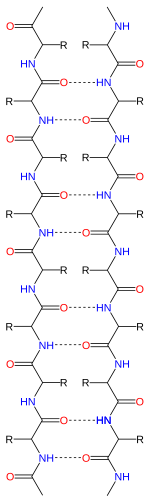
Бета-лист

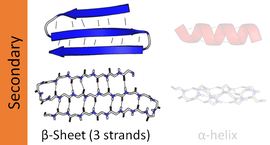

Бета -лист ( β-лист , также β-складчатый лист ) — распространенный мотив регулярной вторичной структуры белка . Бета-листы состоят из бета-нитей ( β-нитей ), соединенных латерально как минимум двумя или тремя основными водородными связями , образующими обычно скрученный, складчатый лист. β-цепь представляет собой участок полипептидной цепи длиной обычно от 3 до 10 аминокислот с основной цепью в вытянутой конформации . Супрамолекулярная ассоциация β-листов участвует в формировании фибрилл и белковых агрегатов, наблюдаемых при амилоидозе , болезни Альцгеймера и других протеинопатиях .
История
[ редактировать ]
Первая структура β-листа была предложена Уильямом Эстбери в 1930-х годах. Он предложил идею образования водородных связей между пептидными связями параллельных или антипараллельных вытянутых β-цепей. Однако Эстбери не располагал необходимыми данными о геометрии связей аминокислот для построения точных моделей, тем более что он тогда не знал, что пептидная связь плоская. Усовершенствованная версия была предложена Линусом Полингом и Робертом Кори в 1951 году. Их модель включала планарность пептидной связи, которую они ранее объясняли как результат кето-енольной таутомеризации .
Структура и ориентация
[ редактировать ]Геометрия
[ редактировать ]Большинство β-цепей расположены рядом с другими цепями и образуют обширную сеть водородных связей со своими соседями, в которой группы N-H в основной цепи одной цепи образуют водородные связи с группами C=O в основной цепи соседних. пряди. В полностью вытянутой β-цепи последовательные боковые цепи поочередно направлены вверх и вниз. Соседние β-цепи в β-листе выровнены так, что их C а атомы расположены рядом, и их боковые цепи направлены в одном направлении. «Складчатый» вид β-цепей возникает из-за тетраэдрической химической связи на уровне C. а атом; например, если боковая цепь направлена прямо вверх, то связи с C 'должны быть направлены немного вниз, поскольку ее валентный угол составляет примерно 109,5 °. Складки приводят к увеличению расстояния между C а
я и С а
i + 2 будет составлять примерно 6 Å (0,60 нм , а не 7,6 Å (0,76 нм), ожидаемых от двух полностью вытянутых транспептидов ) . «Боковое» расстояние между соседними C а атомов в β-нитях с водородными связями составляет примерно 5 Å (0,50 нм).
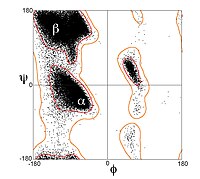
Однако β-цепи редко бывают идеально вытянутыми; скорее, они демонстрируют извращение. Энергетически предпочтительные двугранные углы вблизи ( φ , ψ ) = (–135°, 135°) (в широком смысле, верхняя левая область графика Рамачандрана ) значительно отличаются от полностью растянутой конформации ( φ , ψ ) = (–180°, 180°). [1] Скручивание часто связано с переменными колебаниями двугранных углов, предотвращающими расхождение отдельных β-нитей в более крупном листе. Хороший пример сильно скрученной β-шпильки можно увидеть в белке BPTI .
Боковые цепи направлены наружу из складок, примерно перпендикулярно плоскости листа; последовательные аминокислотные остатки направлены наружу на чередующихся сторонах листа.
Образцы водородных связей
[ редактировать ]Поскольку пептидные цепи обладают направленностью, определяемой их N-концом и С-концом , можно сказать, что β-цепи также являются направленными. На диаграммах топологии белков они обычно изображаются стрелкой, указывающей на С-конец. Соседние β-цепи могут образовывать водородные связи антипараллельно, параллельно или смешанно.
При антипараллельном расположении последовательные β-цепи чередуют направления так, что N-конец одной цепи примыкает к С-концу следующей. Это расположение обеспечивает наибольшую межцепочечную стабильность, поскольку оно позволяет межцепочечным водородным связям между карбонилами и аминами быть плоскими, что является их предпочтительной ориентацией. Двугранные углы пептидного остова ( φ , ψ ) составляют около (–140°, 135°) в антипараллельных листах. В этом случае, если два атома C а
я и С а
j соседствуют в двух β-цепях, связанных водородными связями друг друга , тогда они образуют две взаимные основные водородные связи с фланкирующими пептидными группами ; это известно как тесная пара водородных связей.
При параллельном расположении все N-концы последовательных цепей ориентированы в одном направлении; эта ориентация может быть немного менее стабильной, поскольку она вносит непланарность в структуру межнитевых водородных связей. Двугранные углы ( φ , ψ ) составляют около (–120°, 115°) в параллельных листах. Редко можно найти менее пяти взаимодействующих параллельных нитей в мотиве, что позволяет предположить, что меньшее количество нитей может быть нестабильным, однако образование параллельных β-листов принципиально труднее, поскольку нити с выровненными N- и C-концами обязательно должны быть очень далеким по порядку [ нужна ссылка ] . Есть также свидетельства того, что параллельные β-листы могут быть более стабильными, поскольку небольшие амилоидогенные последовательности, по-видимому, обычно агрегируются в фибриллы β-листа, состоящие преимущественно из параллельных нитей β-листа, где можно было бы ожидать антипараллельные фибриллы, если бы антипараллельные фибриллы были более стабильными. .
В параллельной структуре β-листа, если два атома C а
я и С а
j соседствуют в двух β-цепях, связанных водородными связями , то они не образуют водородных связей друг с другом; скорее, один остаток образует водородные связи с остатками, которые фланкируют другой (но не наоборот). Например, остаток i может образовывать водородные связи с остатками j - 1 и j + 1; это известно как широкая пара водородных связей. Напротив, остаток j может образовывать водородные связи с разными остатками вообще или вообще ни с чем.
Расположение водородных связей в параллельном бета-листе напоминает расположение амидного кольца с 11 атомами.
Наконец, отдельная цепь может демонстрировать смешанный рисунок связи: с параллельной цепью с одной стороны и антипараллельной цепью с другой. Такое расположение менее распространено, чем можно было бы предположить из случайного распределения ориентаций, что позволяет предположить, что этот паттерн менее стабильен, чем антипараллельное расположение, однако биоинформатический анализ всегда сталкивается с трудностями при извлечении структурной термодинамики, поскольку в целых белках всегда присутствует множество других структурных особенностей. Кроме того, белки по своей природе ограничены кинетикой сворачивания, а также термодинамикой сворачивания, поэтому всегда нужно быть осторожным, делая вывод о стабильности на основе биоинформационного анализа.
Водородная связь β-цепей не обязательно должна быть идеальной, но может иметь локальные нарушения, известные как β-выпуклости .
Водородные связи лежат примерно в плоскости листа, при этом группы пептида карбонильные направлены в чередующихся направлениях с последовательными остатками; для сравнения, последовательные карбонилы указывают в одном и том же направлении в альфа-спирали .
Склонность к аминокислотам
[ редактировать ]Крупные ароматические остатки ( тирозин , фенилаланин , триптофан ) и β-разветвленные аминокислоты ( треонин , валин , изолейцин ) предпочтительно обнаруживаются в β-нитях в середине β -листов. Различные типы остатков (такие как пролин ), вероятно, будут обнаружены в краевых цепях β-листов, предположительно, чтобы избежать ассоциации «край-к-краю» между белками, которая может привести к агрегации и образованию амилоида . [2]
Общие структурные мотивы
[ редактировать ]

мотив β-шпильки
[ редактировать ]Очень простым структурным мотивом, включающим β-листы, является β-шпилька , в которой две антипараллельные цепи соединены короткой петлей из двух-пяти остатков, один из которых часто представляет собой глицин или пролин , оба из которых могут принимать двугранную форму. -угловые конформации, необходимые для крутого поворота или петли β-выпуклости . Отдельные нити также могут быть связаны более сложными способами с помощью более длинных петель, которые могут содержать α-спирали .
Греческий ключевой мотив
[ редактировать ]Греческий ключевой мотив состоит из четырех соседних антипараллельных нитей и соединяющих их петель. Он состоит из трех антипараллельных прядей, соединенных шпильками, при этом четвертая примыкает к первой и связана с третьей более длинной петлей. Этот тип структуры легко формируется в процессе сворачивания белка . [3] [4] Он был назван в честь узора, общего для греческих орнаментов (см. меандр ).
мотив б-а-б
[ редактировать ]Из-за хиральности входящих в их состав аминокислот все цепи имеют правостороннюю закрутку, очевидную в большинстве структур β-листов более высокого порядка. В частности, соединительная петля между двумя параллельными нитями почти всегда имеет правостороннюю кроссоверную хиральность, чему в значительной степени способствует присущая листу скрутка. [5] Эта связывающая петля часто содержит спиральную область, и в этом случае ее называют мотивом β-α-β . Близкородственный мотив, называемый мотивом β-α-β-α, образует основной компонент наиболее часто наблюдаемой третичной структуры белка — ствола TIM .


β-меандр
[ редактировать ]Простая топология супервторичного белка, состоящая из двух или более последовательных антипараллельных β-цепей, соединенных между собой шпильками . [7] [8] Этот мотив распространен в β-листах и может быть найден в нескольких структурных архитектурах, включая β-бочки и β-пропеллеры .
Подавляющее большинство областей β-меандра в белках расположены напротив других мотивов или участков полипептидной цепи, образуя части гидрофобного ядра, которое канонически приводит к образованию складчатой структуры. [9] Однако несколько заметных исключений включают варианты белка A внешней поверхности (OspA). [6] и однослойные белки β-листа (SLBP) [10] которые содержат однослойные β-листы при отсутствии традиционного гидрофобного ядра. Эти β-богатые белки имеют удлиненные однослойные β-меандровые β-листы, которые в первую очередь стабилизируются посредством межβ-нитевых взаимодействий и гидрофобных взаимодействий, присутствующих в областях поворота, соединяющих отдельные нити.
Мотив пси-петли
[ редактировать ]Мотив пси-петли (Ψ-петли) состоит из двух антипараллельных нитей с одной нитью между ними, которая соединена с обеими водородными связями. [11] Существует четыре возможных топологии нитей для одиночных Ψ-петлей. [12] Этот мотив редок, поскольку маловероятно, что процесс, приводящий к его образованию, произойдет во время сворачивания белка. Ψ-петля была впервые идентифицирована в семействе аспарагиновых протеаз . [12]
Структурная архитектура белков с β-листами
[ редактировать ]β-листы присутствуют во всех доменах β , α+β и α/β , а также во многих пептидах или небольших белках с плохо определенной общей архитектурой. [13] [14] Все β-домены могут образовывать β-бочки , β-сэндвичи , β-призмы, β-пропеллеры и β-спирали .
Структурная топология
[ редактировать ]Топология β - β-листа описывает порядок цепей с водородными связями вдоль основной цепи. Например, складка флаводоксина имеет пятицепочечный параллельный β-лист с топологией 21345; таким образом, краевыми нитями являются β-цепь 2 и β-цепь 5 вдоль основной цепи. Явно говоря, β-цепь 2 связана H-связью с β-цепью 1, которая связана H-связью с β-цепью 3, которая H-связана с β-цепью 4, которая H-связана с β-цепью 5. , другая крайняя прядь. В той же системе описанный выше греческий ключевой мотив имеет топологию 4123. Вторичную структуру β-листа можно грубо описать, указав количество нитей, их топологию и то, являются ли их водородные связи параллельными или антипараллельными.
β-листы могут быть открытыми , что означает, что они имеют две краевые нити (как в складке флаводоксина или складке иммуноглобулина ), или они могут быть закрытыми β-цилиндрами (например, ствол TIM ). β-Бочки часто характеризуют по их смещению или сдвигу . Некоторые открытые β-листы сильно изогнуты и складываются сами по себе (как в домене SH3 ) или образуют подковообразную форму (как в ингибиторе рибонуклеазы ). Открытые β-листы могут собираться лицом к лицу (например, домен β-пропеллера или складка иммуноглобулина ) или от края к краю, образуя один большой β-лист.
Динамические функции
[ редактировать ]β-складчатые листовые структуры состоят из удлиненных полипептидных цепей β-цепей, нити которых связаны со своими соседями водородными связями . Благодаря такой удлиненной конформации основной цепи β-листы сопротивляются растяжению . β-листы в белках могут осуществлять низкочастотное движение, подобное аккордеону, как это наблюдают с помощью рамановской спектроскопии. [15] и проанализированы с помощью модели квазиконтинуума. [16]
Параллельные β-спирали
[ редактировать ]
β -спираль образуется из повторяющихся структурных единиц, состоящих из двух или трех коротких β-цепей, соединенных короткими петлями. Эти единицы «накладываются» друг на друга по спирали, так что последовательные повторения одной и той же цепи образуют водородную связь друг с другом в параллельной ориентации. см. в статье о β-спирали Дополнительную информацию .
В левосторонних β-спиралях сами нити достаточно прямые и раскрученные; в результате спиральные поверхности становятся почти плоскими, образуя правильную треугольную форму призмы , как показано для архейной карбоангидразы 1QRE справа. Другими примерами являются фермент синтеза липида А LpxA и белки-антифризы насекомых с регулярным набором боковых цепей Thr на одной стороне, которые имитируют структуру льда. [17]
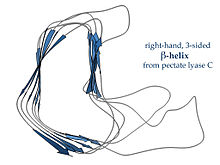
Правосторонние β-спирали, типичным примером которых является фермент пектатлиаза , показанный слева, или белок хвостового шипа фага P22 , имеют менее регулярное поперечное сечение, более длинное и с зазубринами на одной из сторон; из трех линкерных петель одна постоянно имеет длину всего два остатка, а остальные являются вариабельными, часто образующими связывающий или активный сайт. [18]
Двусторонняя β-спираль (правая) встречается у некоторых бактериальных металлопротеаз ; каждая из его двух петель имеет длину шесть остатков и связывает стабилизирующие ионы кальция, поддерживая целостность структуры, используя кислород основной цепи и боковой цепи Asp мотива последовательности GGXGXD. [19] В классификации SCOP эта складка называется β-роллом.
В патологии
[ редактировать ]Некоторые белки, которые являются неупорядоченными или спиральными мономерами, такие как β-амилоид (см. амилоидные бляшки ), могут образовывать богатые β-листами олигомерные структуры, связанные с патологическими состояниями. Олигомерная форма белка β-амилоида считается причиной болезни Альцгеймера . Его структура еще полностью не определена, но недавние данные позволяют предположить, что она может напоминать необычную двухцепочечную β-спираль. [20]
Боковые цепи аминокислотных остатков, обнаруженных в структуре β-листа, также могут быть расположены таким образом, что многие из соседних боковых цепей на одной стороне листа являются гидрофобными, в то время как многие из соседних боковых цепей на другой стороне листа являются гидрофобными. полярны или заряжены (гидрофильны), [21] что может быть полезно, если лист должен образовывать границу между полярной/водянистой и неполярной/жирной средой.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Фут D, Фут JG (2004). Биохимия (3-е изд.). Хобокен, Нью-Джерси: Уайли. стр. 227–231 . ISBN 0-471-19350-Х .
- ^ Ричардсон Дж. С., Ричардсон, округ Колумбия (март 2002 г.). «Природные бета-белки используют негативный дизайн, чтобы избежать агрегации от края до края» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (5): 2754–9. Бибкод : 2002PNAS...99.2754R . дои : 10.1073/pnas.052706099 . ПМК 122420 . ПМИД 11880627 .
- ^ Третичная структура и складки белка: раздел 4.3.2.1 . Из принципов структуры белка, сравнительного моделирования белков и визуализации
- ^ Хатчинсон Э.Г., Торнтон Дж.М. (апрель 1993 г.). «Греческий ключевой мотив: извлечение, классификация и анализ». Белковая инженерия . 6 (3): 233–45. дои : 10.1093/белок/6.3.233 . ПМИД 8506258 .
- ^ См. разделы II B и III C, D в Ричардсон Дж.С. (1981). «Анатомия и таксономия структуры белка». Анатомия и систематика белковых структур . Том. 34. стр. 167–339. дои : 10.1016/s0065-3233(08)60520-3 . ISBN 0-12-034234-0 . ПМИД 7020376 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Jump up to: а б Макабе К., МакЭлхени Д., Терешко В., Хильярд А., Гавлак Г., Ян С. и др. (ноябрь 2006 г.). «Атомные структуры имитаторов самосборки пептидов» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (47): 17753–8. Бибкод : 2006PNAS..10317753M . дои : 10.1073/pnas.0606690103 . ПМК 1693819 . ПМИД 17093048 .
- ^ «SCOP: Fold: WW-домен» . Архивировано из оригинала 4 февраля 2012 г. Проверено 1 июня 2007 г.
- ^ PPS '96 - Супервторичная структура
- ^ Бьянкалана М., Макабе К., Койде С. (февраль 2010 г.). «Минималистический дизайн водорастворимой кросс-бета-архитектуры» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (8): 3469–74. Бибкод : 2010PNAS..107.3469B . дои : 10.1073/pnas.0912654107 . ПМЦ 2840449 . ПМИД 20133689 .
- ^ Сюй, Цинпин; Бьянкалана, Мэтью; Грант, Джоанна С.; Чиу, Сю-Джу; Ярошевский, Лукаш; Кнут, Марк В.; Лесли, Скотт А.; Годзик, Адам; Элслигер, Марк-Андре; Дикон, Эшли М.; Уилсон, Ян А. (сентябрь 2019 г.). «Структуры однослойных белков β-листа произошли из повторов β-шпильки» . Белковая наука . 28 (9): 1676–1689. дои : 10.1002/pro.3683 . ISSN 1469-896X . ПМК 6699103 . ПМИД 31306512 .
- ^ Хатчинсон Э.Г., Торнтон Дж.М. (февраль 1996 г.). «ПРОМОТИФ — программа для идентификации и анализа структурных мотивов в белках» . Белковая наука . 5 (2): 212–20. дои : 10.1002/pro.5560050204 . ПМК 2143354 . ПМИД 8745398 .
- ^ Jump up to: а б Хатчинсон Э.Г., Торнтон Дж.М. (1990). «HERA — программа для рисования схематических диаграмм вторичных структур белков». Белки . 8 (3): 203–12. дои : 10.1002/прот.340080303 . ПМИД 2281084 . S2CID 28921557 .
- ^ Хаббард Т.Дж., Мурзин А.Г., Бреннер С.Е., Чотия С. (январь 1997 г.). «SCOP: база данных структурной классификации белков» . Исследования нуклеиновых кислот . 25 (1): 236–9. дои : 10.1093/нар/25.1.236 . ПМК 146380 . ПМИД 9016544 .
- ^ Фокс Н.К., Бреннер С.Е., Чандония Дж.М. (январь 2014 г.). «SCOPe: Структурная классификация белков - расширенная, объединяющая данные SCOP и ASTRAL и классификация новых структур» . Исследования нуклеиновых кислот . 42 (Проблема с базой данных): D304-9. дои : 10.1093/нар/gkt1240 . ПМЦ 3965108 . ПМИД 24304899 .
- ^ Художник ПК, Мошер Л.Е., Роудс С. (июль 1982 г.). «Низкочастотные моды в спектрах комбинационного рассеяния белков». Биополимеры . 21 (7): 1469–72. дои : 10.1002/bip.360210715 . ПМИД 7115900 .
- ^ Чжоу К.С. (август 1985 г.). «Низкочастотные движения в белковых молекулах. Бета-лист и бета-бочка» . Биофизический журнал . 48 (2): 289–97. Бибкод : 1985BpJ....48..289C . дои : 10.1016/S0006-3495(85)83782-6 . ПМЦ 1329320 . ПМИД 4052563 .
- ^ Лиу Ю.К., Точилж А., Дэвис П.Л., Цзя З. (июль 2000 г.). «Имикрия структуры льда поверхностными гидроксилами и водой бета-спирального белка-антифриза». Природа . 406 (6793): 322–4. Бибкод : 2000Natur.406..322L . дои : 10.1038/35018604 . ПМИД 10917536 . S2CID 4385352 .
- ^ Брэнден С., Туз Дж. (1999). Введение в структуру белка . Нью-Йорк: Гарленд. стр. 20–32. ISBN 0-8153-2305-0 .
- ^ Бауманн У., Ву С., Флаэрти К.М., Маккей Д.Б. (сентябрь 1993 г.). «Трехмерная структура щелочной протеазы Pseudomonas aeruginosa: двухдоменный белок с параллельным мотивом бета-ролла, связывающим кальций» . Журнал ЭМБО . 12 (9): 3357–64. дои : 10.1002/j.1460-2075.1993.tb06009.x . ПМК 413609 . ПМИД 8253063 .
- ^ Нельсон Р., Савая М.Р., Балбирни М., Мэдсен А.О., Рикель С., Гроте Р., Айзенберг Д. (июнь 2005 г.). «Строение перекрестной бета-сосны из амилоидных фибрилл» . Природа . 435 (7043): 773–8. Бибкод : 2005Natur.435..773N . дои : 10.1038/nature03680 . ПМЦ 1479801 . ПМИД 15944695 .
- ^ Чжан С., Холмс Т., Локшин С., Рич А. (апрель 1993 г.). «Спонтанная сборка самокомплементарного олигопептида с образованием стабильной макроскопической мембраны» . Труды Национальной академии наук Соединенных Штатов Америки . 90 (8): 3334–8. Бибкод : 1993PNAS...90.3334Z . дои : 10.1073/pnas.90.8.3334 . ПМК 46294 . ПМИД 7682699 .
Дальнейшее чтение
[ редактировать ]- Купер Дж (31 мая 1996 г.). «Супервторичная структура. Часть II» . Принципы структуры белка с помощью Интернета . Проверено 25 мая 2007 г.
- «Открытый бета-меандр» . Структурная классификация белков (SCOP) . 20 октября 2006 г. Архивировано из оригинала 4 февраля 2012 г. . Проверено 31 мая 2007 г.