Аспарагиновая протеаза
| Эукариотическая аспартилпротеаза | |||
|---|---|---|---|
 Структура димерной аспарагиновой протеазы ВИЧ-протеазы выделена белым и серым цветом, пептидный субстрат показан черным, а активного центра боковые цепи аспартата показаны красным. ( PDB : 1KJF ) | |||
| Идентификаторы | |||
| Символ | Асп | ||
| Пфам | PF00026 | ||
| ИнтерПро | ИПР001461 | ||
| PROSITE | PDOC00128 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1мпп / СКОПе / СУПФАМ | ||
| Суперсемейство OPM | 100 | ||
| белок OPM | 1лб | ||
| Мембраном | 315 | ||
| |||
Аспарагиновые протеазы (также «аспартилпротеазы», «аспарагиновые эндопептидазы») представляют собой каталитический тип протеазных ферментов , которые используют активированную молекулу воды, связанную с одним или несколькими остатками аспартата, для катализа своих пептидных субстратов. Как правило, они имеют два высококонсервативных аспартата в активном центре и оптимально активны при кислом pH . Почти все известные аспартилпротеазы ингибируются пепстатином . [ 1 ]
Аспарагиновые эндопептидазы КФ 3.4.23. позвоночного, грибкового и ретровирусного происхождения. [ 2 ] Совсем недавно аспарагиновые эндопептидазы ассоциировались с переработкой бактериального препилина 4 типа. [ 3 ] и архейский префлагеллин описаны. [ 4 ] [ 5 ]
Эукариотические аспарагиновые протеазы включают пепсины , катепсины и ренины . Они имеют двухдоменную структуру, возникающую в результате наследственной дупликации. Ретровирусные и ретротранспозонные протеазы ( ретровирусные аспартилпротеазы ) гораздо меньше по размеру и, по-видимому, быть гомологичны одному домену эукариотических аспартилпротеаз. Каждый домен вносит каталитический остаток Asp с расширенной щелью активного центра, локализованной между двумя долями молекулы. Одна доля, вероятно, развилась из другой в результате дупликации генов в далеком прошлом. В современных ферментах, хотя трехмерные структуры очень похожи, аминокислотные последовательности более различаются, за исключением мотива каталитического сайта, который очень консервативен. Наличие и положение дисульфидных мостиков являются другими консервативными особенностями аспарагиновых пептидаз.
Каталитический механизм
[ редактировать ]
Аспартилпротеазы представляют собой высокоспецифичное семейство протеаз – они склонны расщеплять дипептидные связи, имеющие гидрофобные остатки, а также бета-метиленовую группу. В отличие от сериновых или цистеиновых протеаз эти протеазы не образуют ковалентного промежуточного продукта во время расщепления. Таким образом, протеолиз происходит в одну стадию.
Хотя был предложен ряд различных механизмов действия аспартилпротеаз, наиболее широко распространенным является общий кислотно-основной механизм , включающий координацию молекулы воды между двумя высококонсервативными остатками аспартата . [ 6 ] [ 7 ] Один аспартат активирует воду, отрывая протон, позволяя воде осуществлять нуклеофильную атаку на карбонильный субстрата углерод разрезаемой связи , образуя тетраэдрический оксианион, промежуточный стабилизированный водородными связями со второй аспарагиновой кислотой. Перегруппировка этого промежуточного соединения приводит к протонированию разрезаемого амида , что приводит к расщеплению пептида-субстрата на два пептида-продукта.
Торможение
[ редактировать ]Пепстатин является ингибитором аспартатпротеаз. [ 1 ]
Классификация
[ редактировать ]пять суперсемейств Известны (кланов) аспарагиновых протеаз, каждое из которых представляет собой независимую эволюцию одного и того же активного центра и механизмов . Каждое надсемейство содержит несколько семейств со схожими последовательностями. Систематическая классификация MEROPS называет эти кланы в алфавитном порядке.
- Клан АА (например, семейство Пепсинов )
- Клан AC (например, семейство сигнальных пептидаз II )
- Клан AD (например, Пресенилинов ) семейство
- Клан AE (например, семейство эндопептидаз GPR )
- Клан AF (например, Омптин ) семья
Пропептид
[ редактировать ]| A1_Пропептид | |||
|---|---|---|---|
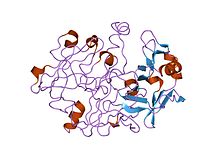 Кристаллические и молекулярные структуры прогастрицина человека с разрешением 1,62 ангстрема | |||
| Идентификаторы | |||
| Символ | A1_Пропептид | ||
| Пфам | PF07966 | ||
| ИнтерПро | ИПР012848 | ||
| |||
Многие эукариотические аспарагиновые эндопептидазы ( семейство пептидаз MEROPS A1) синтезируются с сигнальными и пропептидами . консервативный мотив Пропептиды пепсиноподобной эндопептидазы животных образуют отдельное семейство пропептидов, которые содержат длиной примерно 30 остатков . В пепсиногене А первые 11 остатков последовательности зрелого заменены пепсина остатками пропептида. Пропептид содержит две спирали , которые блокируют щель активного центра , в частности консервативный остаток Asp11, в пепсине, водородные связи с консервативным остатком Arg в пропептиде. Эта водородная связь пропептида стабилизирует конформацию и, вероятно, отвечает за запуск превращения пепсиногена в пепсин в кислых условиях. [ 8 ] [ 9 ]
Примеры
[ редактировать ]Человек
[ редактировать ]- БАСЕ1 , БАСЕ2
- Катепсин Д
- Катепсин Е
- Химозин (или «реннин»)
- Напсин-А
- Непентезин
- Пепсин
- Пресенилин
- Ренин
Белки человека, содержащие этот домен
[ редактировать ]БАСЕ1 ; БАСЕ2 ; CTSD ; КТСЕ ; НАПСА ; ПГА5 ; ПГК ; РЕН ;
Другие организмы
[ редактировать ]- Протеаза ВИЧ-1 – основная лекарственная мишень для лечения ВИЧ
- Плазмепсин - группа аспартилпротеаз, обнаруженных в малярию . вызывающем плазмодии,
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Фусек М., Марес М., Ветвицка В. (01.01.2013). «Глава 8 - Катепсин Д». В Роулингс Н.Д., Салвесен Г. (ред.). Справочник по протеолитическим ферментам (Третье изд.). Академическая пресса. стр. 54–63. дои : 10.1016/b978-0-12-382219-2.00008-9 . ISBN 978-0-12-382219-2 .
- ^ Сечи П.Б. (1992). «Аспарагиновые протеазы». Скандинавский журнал клинических и лабораторных исследований. Дополнение . 210 : 5–22. дои : 10.3109/00365519209104650 . ПМИД 1455179 .
- ^ ЛаПойнт CF, Тейлор Р.К. (январь 2000 г.). «Препилинпептидазы 4-го типа представляют собой новое семейство протеаз аспарагиновой кислоты» . Журнал биологической химии . 275 (2): 1502–10. дои : 10.1074/jbc.275.2.1502 . ПМИД 10625704 .
- ^ Нг С.Ю., Чабан Б., Джаррелл К.Ф. (2006). «Архейные жгутики, бактериальные жгутики и пили IV типа: сравнение генов и посттрансляционных модификаций». Журнал молекулярной микробиологии и биотехнологии . 11 (3–5): 167–91. дои : 10.1159/000094053 . ПМИД 16983194 . S2CID 30386932 .
- ^ Барди С.Л., Джаррелл К.Ф. (ноябрь 2003 г.). «Расщепление префлагеллинов сигнальной пептидазой аспарагиновой кислоты необходимо для жгутикования у археи Methanococcus voltae» . Молекулярная микробиология . 50 (4): 1339–47. дои : 10.1046/j.1365-2958.2003.03758.x . ПМИД 14622420 . S2CID 11913649 .
- ^ Jump up to: а б Сугуна К., Падлан Э.А., Смит К.В., Карлсон В.Д., Дэвис Д.Р. (октябрь 1987 г.). «Связывание восстановленного пептидного ингибитора с аспарагиновой протеиназой Rhizopus chinensis: значение для механизма действия» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (20): 7009–13. Бибкод : 1987PNAS...84.7009S . дои : 10.1073/pnas.84.20.7009 . ПМК 299218 . ПМИД 3313384 .
- ^ Брик А., Вонг CH (январь 2003 г.). «Протеаза ВИЧ-1: механизм и открытие лекарства». Органическая и биомолекулярная химия . 1 (1): 5–14. дои : 10.1039/b208248a . ПМИД 12929379 .
- ^ Харцук Дж. А., Кельш Г., Ремингтон С. Дж. (май 1992 г.). «Кристаллическая структура свиного пепсиногена высокого разрешения». Белки . 13 (1): 1–25. дои : 10.1002/прот.340130102 . ПМИД 1594574 . S2CID 43462673 .
- ^ Селецкий А.Р., Фудзинага М., Рид Р.Дж., Джеймс М.Н. (июнь 1991 г.). «Уточненная структура свиного пепсиногена при разрешении 1,8 А». Журнал молекулярной биологии . 219 (4): 671–92. дои : 10.1016/0022-2836(91)90664-R . ПМИД 2056534 .
Внешние ссылки
[ редактировать ]- Онлайн-база данных MEROPS . по пептидазам и их ингибиторам: Аспарагиновые пептидазы
- Аспарагин + эндопептидазы Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)
- Семейство МЕРОПС А1