Глутаминовая протеаза
| Сциталидопепсин B | |||
|---|---|---|---|
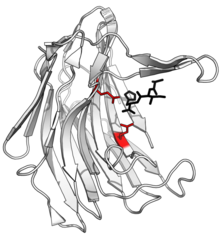 Структура сциталидокарбоксилпептидазы B : расщепленный пептидный продукт показан черным цветом, а боковые цепи диады глутамат-глутамин активного центра показаны красным. ( ПРБ : 1С2К ) | |||
| Идентификаторы | |||
| Организм | |||
| Символ | Н/Д | ||
| ПДБ | 1С2К | ||
| ЮниПрот | P15369 | ||
| Другие данные | |||
| Номер ЕС | 3.4.23.32 | ||
| |||
Глутаминовые протеазы представляют собой группу протеолитических ферментов, содержащих остаток глутаминовой кислоты в активном центре. Этот тип протеазы был впервые описан в 2004 году и стал шестым каталитическим типом протеаз. [ 1 ] Ранее предполагалось, что членами этой группы протеаз являются аспартат-протеазы , но структурное определение показало, что они принадлежат к новому семейству протеаз. Первой структурой этой группы протеаз была сциталидоглутаминовая пептидаза , активный центр которой содержит каталитическую диаду, глутаминовую кислоту (Е) и глутамин (Q), что и дало начало названию эколизин . Эта группа протеаз обнаружена преимущественно у патогенных грибов, поражающих растения и человека. [ 2 ]
Распространение и виды
[ редактировать ]
Существуют два независимых семейства глутаминовых протеаз (G1 и G2), которые имеют ограниченное распространение. Первоначально считалось, что они ограничиваются мицелиальными грибами, главным образом из типа Ascomycota . [ 3 ] Однако впоследствии глутаминовые протеазы были идентифицированы у бактерий и архей . [ 4 ] глутаминовая протеаза из растительного вируса ( вирус пятнистости земляники ). Также была идентифицирована [ 5 ]
Первое суперсемейство глутаминовых протеаз было идентифицировано у грибов Scytalidium lignicola и Aspergillus niger var. macrosporus , из которого сциталидоглутаминовая пептидаза (эколизин) и аспергиллоглутаминовая пептидаза происходят соответственно. Эти две протеазы содержат остатки Glu и Gln в активном центре и сгруппированы в семействе MEROPS G1. [ 6 ] [ 7 ]
Конвергентно возникшая глутаминовая пептидаза, белок придатка предшеи (бактериофаг phi-29), использует диаду Glu и Asp в активном центре и классифицируется как семейство MEROPS G2. [ 8 ]
Характеристики
[ редактировать ]Эти ферменты представляют собой кислые протеазы; Эколизин , например, наиболее активен при pH 2,0, когда в качестве субстрата используется казеин. [ 2 ] Эколозины предпочитают объемные аминокислотные остатки в сайте P1 и небольшие аминокислотные остатки в сайте P1'. Характерной чертой протеазы является ее нечувствительность к пепстатину и S-PI (ацетилпепстатину), и ранее она была классифицирована как «пепстатин-нечувствительные карбоксильные протеиназы». [ 9 ] Другая «нечувствительная к пепстатину карбоксильная протеиназа» принадлежит к подсемейству сериновых протеаз , серин-карбоксильных протеаз (седолизина), которые были открыты в 2001 году. [ 2 ] Эти протеазы также не ингибируются DAN (метиловый эфир диазоацетил-DL-норлейцина) (7), но могут ингибироваться EPNP (1,2-эпокси-3-( п -нитрофенокси)пропан). [ 10 ] [ 11 ]
Активный центр и механизм катализа
[ редактировать ]Активный центр экколозина содержит характерную каталитическую диаду глутаминовой кислоты и глутамина , которая участвует в связывании субстрата и катализе. Эти остатки действуют как нуклеофилы, при этом глутаминовая кислота служит основной кислотой на первой фазе реакции, отдавая протон карбонильному кислороду в пептидной связи субстрата. В реакции могут участвовать одна или две молекулы воды, доставляющие гидроксильную группу, а глутаминовая кислота дополнительно отдает протон амидному азоту, что приводит к разрыву пептидной связи. Затем глютамин возвращает глутаминовую кислоту в исходное состояние. [ 12 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Фудзинага М., Черный М.М., Ояма Х., Ода К., Джеймс М.Н. (март 2004 г.). «Молекулярная структура и каталитический механизм новой карбоксилпептидазы из Scytalidium lignicolum» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (10): 3364–9. Бибкод : 2004PNAS..101.3364F . дои : 10.1073/pnas.0400246101 . ПМЦ 373467 . ПМИД 14993599 .
- ^ Перейти обратно: а б с Ода К. (январь 2012 г.). «Новые семейства карбоксилпептидаз: серин-карбоксилпептидазы и глутаминовые пептидазы» . Журнал биохимии . 151 (1): 13–25. дои : 10.1093/jb/mvr129 . ПМИД 22016395 .
- ^ Симс А.Х., Данн-Коулман Н.С., Робсон Г.Д., Оливер С.Г. (октябрь 2004 г.). «Распространение глутаминовой протеазы ограничено нитчатыми грибами» . Письма FEMS по микробиологии . 239 (1): 95–101. дои : 10.1016/j.femsle.2004.08.023 . ПМИД 15451106 .
- ^ Йенсен К., Остергаард П.Р., Уилтинг Р., Лассен С.Ф. (2010). «Идентификация и характеристика бактериальной глутаминовой пептидазы» . БМК Биохимия . 11 (47): 47. дои : 10.1186/1471-2091-11-47 . ПМК 3009609 . ПМИД 21122090 .
- ^ Манн К.С., Чисхолм Дж. и Санфасон Х. (2019). «Вирус клубничной крапчатости (семейство Secoviridae, отряд Picornavirales) кодирует новую глутаминовую протеазу для процессинга полипротеина РНК2 в двух сайтах расщепления» . Дж Вирол . 93 (5): e01679-18. дои : 10.1128/JVI.01679-18 . ПМК 6384087 . ПМИД 30541838 .
- ^ Сасаки Х., Кубота К., Ли В.К., Оцука Дж., Кодзима М., Ивата С., Накагава А., Такахаши К., Танокура М. (июль 2012 г.). «Кристаллическая структура промежуточного димера аспергиллоглутаминовой пептидазы, которая имитирует комплекс фермент-продукт активации, образующийся при аутопротеолизе». Журнал биохимии . 152 (1): 45–52. дои : 10.1093/jb/mvs050 . ПМИД 22569035 .
- ^ Такахаши К. (2013). «Исследование структуры и функций ферментов с каталитической карбоксильной группой (группами): от рибонуклеазы Т1 до карбоксилпептидаз» . Труды Японской академии, серия B. 89 (6): 201–25. Бибкод : 2013PJAB...89..201T . дои : 10.2183/pjab.89.201 . ПМЦ 3749792 . ПМИД 23759941 .
- ^ «Семья G2» . МЕРОПС . [ постоянная мертвая ссылка ]
- ^ «Семья Г1» . МЕРОПС . [ постоянная мертвая ссылка ]
- ^ Мурао С., Ода К., Мацусита Ю. (1973). «Выделение и идентификация микроорганизма, который продуцирует неингибитор пепсина, не относящийся к Streptomyces, и кислые протеазы, чувствительные к N-диазоацетил-DL-норлейцин-метилэфиру» . Сельское хозяйство. Биол. Хим . 37 (6): 1417–1421. дои : 10.1271/bbb1961.37.1417 .
- ^ Морихара К., Цузуки Х., Мурао С., Ода К. (март 1979 г.). «Нечувствительные к пепстатину кислые протеазы из Scytalidium lignicolum. Кинетическое исследование с синтетическими пептидами» . Журнал биохимии . 85 (3): 661–8. ПМИД 34596 .
- ^ Моселио Шехтер, изд. (2009). Энциклопедия микробиологии (3-е изд.). Академическая пресса. п. 499. ИСБН 978-0123739391 .