МЕТАП2
| МЕТАП2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | METAP2 , MAP2, MNPEP, p67, p67eIF2, метиониламинопептидаза 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 601870 ; МГИ : 1929701 ; Гомологен : 4981 ; Генные карты : METAP2 ; OMA : METAP2 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
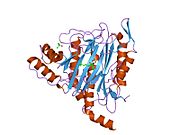
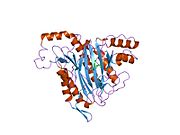
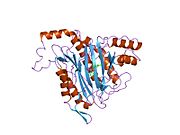
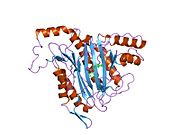
Метионинаминопептидаза 2 — это фермент , который у человека кодируется METAP2 геном . [ 5 ] [ 6 ]
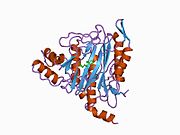
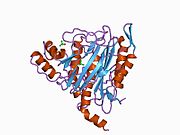
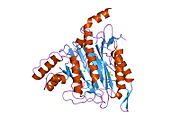
Метионинаминопептидаза 2, член семейства диметаллогидролаз, представляет собой цитозольный металлофермент, который катализирует гидролитическое удаление N-концевых остатков метионина из образующихся белков . [ 7 ] [ 8 ] [ 9 ]
- пептид-метионин пептид + метионин
MetAP2 обнаружен во всех организмах и особенно важен из-за его решающей роли в восстановлении тканей и деградации белков. [ 7 ] Кроме того, MetAP2 представляет особый интерес, поскольку фермент играет ключевую роль в ангиогенезе , росте новых кровеносных сосудов, который необходим для прогрессирования заболеваний, включая рак солидных опухолей и ревматоидный артрит . [ 10 ] MetAP2 также является мишенью двух групп антиангиогенных натуральных продуктов: овалицина и фумагиллина , а также их аналогов, таких как белораниб . [ 11 ] [ 12 ] [ 13 ] [ 14 ]
Структура
[ редактировать ]В живых организмах стартовый кодон белка, , инициирующий синтез кодирует либо метионин ( эукариоты ), либо формилметионин ( прокариоты ). В E. coli прокариотах) фермент формилметиониндеформилаза ( может расщеплять формильную группу, оставляя только N-концевой остаток метионина. Для белков с небольшими незаряженными предпоследними N-концевыми остатками метионинаминопептидаза может расщеплять остаток метионина. [ 7 ] Количество генов , кодирующих метионинаминопептидазу, варьируется у разных организмов. В E. coli известен только один MetAP — мономерный фермент массой 29 333 Да, кодируемый геном, состоящим из 264 кодонов . [ 7 ] Нокаут этого гена у E. coli приводит к нежизнеспособности клеток. [ 15 ] У человека есть два гена, кодирующие MetAP: MetAP1 и MetAP2. MetAP1 кодирует фермент массой 42 кДа, а MetAP2 кодирует фермент массой 67 кДа. Дрожжевой MetAP1 на 40 процентов гомологичен MetAP E. coli; у S. cerevisiae MetAP2 на 22 процента гомологичен последовательности MetAP1; MetAP2 высоко консервативен у S. cerevisiae и человека. [ 16 ] В отличие от прокариот, эукариотические штаммы S. cerevisiae, лишенные гена MetAP1 или MetAP2, жизнеспособны, но демонстрируют более медленную скорость роста, чем контрольный штамм, экспрессирующий оба гена.
Активный сайт
[ редактировать ]Активный центр MetAP2 имеет структурный мотив, характерный для многих металлоферментов, включая белок-переносчик дикислорода, гемеритрин ; двуядерный негемовый белок железа, рибонуклеотидредуктаза ; лейцинаминопептидаза ; уреаза ; аргиназа ; несколько фосфатаз и фосфоэстераз , включая два мостиковых карбоксилатных лиганда и мостиковый водный или гидроксидный лиганд . [ 7 ] [ 8 ] [ 17 ] [ 18 ] [ 19 ] [ 20 ] [ 21 ] В частности, в человеческом MetAP2 (PDB: 1BOA) один из каталитических ионов металлов связан с His331, Glu364, Glu459, Asp263 и мостиковой водой или гидроксидом, тогда как другой ион металла связан с Asp251 ( бидентат ), App262 (бидентат). ), Glu459 и та же мостиковая вода или гидроксид. Здесь двумя мостиковыми карбоксилатами являются Asp262 и Glu459.
Металлический центр
[ редактировать ]Идентичность активного центра металлов ионов в физиологических условиях не установлена и остается спорным вопросом. MetAP2 проявляет активность в присутствии ионов Zn(II), Co(II), Mn(II) и Fe(II), и различные авторы утверждают, что любой ион металла является физиологическим: некоторые в присутствии железа , [ 22 ] другие в кобальте , [ 23 ] [ 24 ] другие в марганце , [ 25 ] и третьи в присутствии цинка . [ 26 ] Тем не менее, большинство кристаллографов кристаллизовали MetAP2 либо в присутствии Zn(II), либо Co(II) (см. базу данных PDB).
Механизм
[ редактировать ]
Мостиковая вода или гидроксидный лиганд действует как нуклеофил во время реакции гидролиза, но точный механизм катализа еще не известен. [ 10 ] [ 19 ] [ 28 ] Каталитические механизмы ферментов гидролаз во многом зависят от личности мостикового лиганда. [ 29 ] что может быть сложно определить из-за сложности изучения атомов водорода с помощью рентгеновской кристаллографии .
Остатки гистидина, показанные в механизме справа, H178 и H79, консервативны во всех MetAP (MetAP1 и MetAP2), секвенированных на сегодняшний день, что позволяет предположить, что их присутствие важно для каталитической активности. [ 30 ] На основании данных рентгеновской кристаллографии было высказано предположение, что гистидин 79 (H79) помогает позиционировать остаток метионина в активном центре и переносить протон к вновь экспонированному N-концевому амину. [ 12 ] Лоутер и его коллеги предложили два возможных механизма действия MetAP2 в E. coli, показанных справа. [ 14 ]
Функция
[ редактировать ]Хотя предыдущие исследования показали, что MetAP2 катализирует удаление N-концевых остатков метионина in vitro, функция этого фермента in vivo может быть более сложной. Например, существует значительная корреляция между ингибированием ферментативной активности MetAP2 и ингибированием роста клеток, что указывает на участие фермента в эндотелиальных клеток пролиферации . [ 13 ] По этой причине исследователи рака выделили MetAP2 в качестве потенциальной мишени для ингибирования ангиогенеза. Более того, исследования показали, что MetAP2 соочищается и взаимодействует с α-субъединицей эукариотического фактора инициации 2 ( eIF2 ), белка, который необходим для синтеза белка in vivo. [ 31 ] В частности, MetAP2 защищает eIF-2α от ингибирующего фосфорилирования с помощью фермента киназы eIF-2α , ингибирует фосфорилирование R-субъединицы eIF-2, катализируемое РНК-зависимой протеинкиназой (PKR), а также обращает вспять PKR-опосредованное ингибирование синтеза белка в интактных клетках. .
Клиническое значение
[ редактировать ]
Многочисленные исследования подтверждают участие MetAP2 в ангиогенезе. [ 13 ] [ 20 ] [ 32 ] [ 33 ] [ 34 ] В частности, ковалентное фрагмента овалицина или фумагилина связывание эпоксидного было показано, что с остатком гистидина в активном центре MetAP2 инактивирует фермент, тем самым ингибируя ангиогенез. Однако способ, которым MetAP2 регулирует ангиогенез, еще не установлен, поэтому необходимы дальнейшие исследования для подтверждения того, что антиангиогенная активность является результатом непосредственного ингибирования MetAP2. Тем не менее, поскольку рост и метастазирование солидных опухолей в значительной степени зависят от ангиогенеза, фумагиллин и его аналоги, включая эвексомостат , TNP-470 , капластатин и белораниб , а также овалицин представляют собой потенциальные противораковые агенты. [ 33 ] [ 34 ] Более того, способность MetAP2 снижать жизнеспособность клеток прокариотических и мелких эукариотических организмов сделала его мишенью для антибактериальных средств. [ 13 ] На данный момент было показано, что и фумагиллин, и TNP-470 обладают противомалярийной активностью как in vitro, так и in vivo, а фумаранол , еще один аналог фумагиллина, представляет собой многообещающее лидерство. [ 34 ]
Ингибитор METAP2, производный фумагиллина, белораниб (ZGN-433, CDK-732) показал эффективность в снижении веса у пациентов с тяжелым ожирением. [ 35 ] Ингибиторы MetAP2 восстанавливают чувствительность к инсулину и баланс способов метаболизма жира в организме, что приводит к существенной потере массы тела. Разработка белораниба была остановлена в 2016 году после двух смертей во время клинических исследований пациентов с синдромом Предера-Вилли. [ 36 ] Конъюгат полимера и лекарственного средства нового ингибитора MetAP2 под названием эвексомостат, разрабатываемый SynDevRx, Inc., вступил в клиническую разработку для пациентов с раком на поздних стадиях в 2016 году. Исследования по увеличению дозы фазы 1 были завершены в 2020 году. В 2022 году SynDevRx инициировала клиническую фазу 2. исследование эвексомостата в сотрудничестве с Онкологическим центром Мемориала Слоана-Кеттеринга в Нью-Йорке для оценки безопасности и эффективности при рецидивирующем метастатическом тройном негативном раке молочной железы в сочетании с препаратом эрибулином (Халавен (R)). В 2023 году SynDevRx инициировала еще одно клиническое исследование фазы 2 эвексомостата в сочетании с алпелисибом (Пикрей (справа)) и фулвестрантом (Фаслодекс (справа)) у пациентов с метастатическим раком молочной железы HR+/Her2-.
Взаимодействия
[ редактировать ]Было показано, что METAP2 взаимодействует с протеинкиназой R. [ 37 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000111142 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000036112 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Арфин С.М., Кендалл Р.Л., Холл Л., Уивер Л.Х., Стюарт А.Е., Мэтьюз Б.В. и др. (сентябрь 1995 г.). «Эукариотические метиониламинопептидазы: два класса кобальт-зависимых ферментов» . Proc Natl Acad Sci США . 92 (17): 7714–8. Бибкод : 1995PNAS...92.7714A . дои : 10.1073/pnas.92.17.7714 . ПМК 41216 . ПМИД 7644482 .
- ^ Ли X, Чанг Ю. Х. (ноябрь 1996 г.). «Доказательства того, что человеческий гомолог белка, связанного с крысиным фактором инициации-2 (p67), представляет собой метионинаминопептидазу». Биохимия Биофиз Рес Коммьюнити . 227 (1): 152–9. дои : 10.1006/bbrc.1996.1482 . ПМИД 8858118 .
- ^ Перейти обратно: а б с д и Беннетт Б., Хольц Р.К. (1997). «ЭПР-исследования моно- и дикобальт(II)-замещенных форм аминопептидазы Aeromonas proteolytica. Понимание каталитического механизма биядерных гидролаз» . Дж. Ам. хим. Соц . 119 (8): 1923–1933. дои : 10.1021/ja963021v .
- ^ Перейти обратно: а б Йоханссон Ф.Б., Бонд А.Д., Нильсен Ю.Г., Мубараки Б., Мюррей К.С., Берри К.Дж. и др. (июнь 2008 г.). «Комплексы дикобальта II-II, II-III и III-III как спектроскопические модели активных центров фермента дикобальта». Неорг хим . 47 (12): 5079–92. дои : 10.1021/ic7020534 . ПМИД 18494467 .
- ^ Ларраби Дж.А., Люнг Ч.Х., Мур Р.Л., Тамронг-приемник Т., Весслер Б.С. (октябрь 2004 г.). «Исследование магнитного кругового дихроизма и равновесия связывания кобальта (II) метиониламинопептидазы Escherichia coli». Дж. Ам. хим. Соц . 126 (39): 12316–24. дои : 10.1021/ja0485006 . ПМИД 15453765 .
- ^ Перейти обратно: а б Фолкман Дж. (январь 1995 г.). «Ангиогенез при раковых, сосудистых, ревматоидных и других заболеваниях». Нат. Мед . 1 (1): 27–31. дои : 10.1038/nm0195-27 . ПМИД 7584949 . S2CID 5924813 .
- ^ Тонтон Дж. (июль 1997 г.). «Как морить опухоль голодом» . хим. Биол . 4 (7): 493–6. дои : 10.1016/S1074-5521(97)90320-3 . ПМИД 9263636 .
- ^ Перейти обратно: а б Син Н., Мэн Л., Ван М.К., Вэнь Дж.Дж., Борнманн В.Г., Крюс К.М. (июнь 1997 г.). «Антиангиогенный агент фумагиллин ковалентно связывает и ингибирует метионинаминопептидазу MetAP-2» . Учеб. Натл. акад. наук. США . 94 (12): 6099–103. Бибкод : 1997PNAS...94.6099S . дои : 10.1073/pnas.94.12.6099 . ПМК 21008 . ПМИД 9177176 .
- ^ Перейти обратно: а б с д Гриффит Э.К., Су З., Терк Б.Е., Чен С., Чанг Ю.Х., Ву З. и др. (июнь 1997 г.). «Метионинаминопептидаза (тип 2) является общей мишенью для ингибиторов ангиогенеза AGM-1470 и овалицина» . хим. Биол . 4 (6): 461–71. дои : 10.1016/S1074-5521(97)90198-8 . ПМИД 9224570 .
- ^ Перейти обратно: а б Лоутер В.Т., Макмиллен Д.А., Орвилл А.М., Мэтьюз Б.В. (октябрь 1998 г.). «Антиангиогенный агент фумагиллин ковалентно модифицирует консервативный гистидин активного центра метионинаминопептидазы Escherichia coli» . Учеб. Натл. акад. наук. США . 95 (21): 12153–7. Бибкод : 1998PNAS...9512153L . дои : 10.1073/pnas.95.21.12153 . ПМК 22800 . ПМИД 9770455 .
- ^ Чанг С.Ю., МакГэри Э.К., Чанг С. (июль 1989 г.). «Ген метионинаминопептидазы Escherichia coli необходим для роста клеток» . Дж. Бактериол . 171 (7): 4071–2. дои : 10.1128/jb.171.7.4071-4072.1989 . ПМК 210164 . ПМИД 2544569 .
- ^ Ли X, Чанг Ю. Х. (декабрь 1995 г.). «Аминоконцевой процессинг белка у Saccharomyces cerevisiae является важной функцией, которая требует двух различных метионинаминопептидаз» . Учеб. Натл. акад. наук. США . 92 (26): 12357–61. Бибкод : 1995PNAS...9212357L . дои : 10.1073/pnas.92.26.12357 . ПМК 40356 . ПМИД 8618900 .
- ^ Мидзогучи Т.Дж., Кузелка Дж., Спинглер Б., Дюбуа Дж.Л., Давыдов Р.М., Хедман Б. и др. (август 2001 г.). «Синтез и спектроскопические исследования негемовых форм дижелеза (III) с концевым гидропероксидным лигандом: модели гемеритрина». Неорг хим . 40 (18): 4662–73. дои : 10.1021/ic010076b . ПМИД 11511213 .
- ^ Хаген К.С., Лашикотт Р., Китайгородский А. (1993). «Супрамолекулярный контроль ступенчатого и селективного замещения карбоксилатных лигандов в аква-карбоксилато-мостиковых комплексах диметалла (II)». Дж. Ам. хим. Соц . 115 (26): 12617–12618. дои : 10.1021/ja00079a064 .
- ^ Перейти обратно: а б Браун Д.А., Эррингтон В., Гласс В.К., Хаазе В., Кемп Т.Дж., Нимир Х. и др. (ноябрь 2001 г.). «Магнитные, спектроскопические и структурные исследования гидроксаматов дикобальта и модельных гидролаз». Неорг хим . 40 (23): 5962–71. дои : 10.1021/ic0103345 . ПМИД 11681912 .
- ^ Перейти обратно: а б Ларраби Дж.А., Чюн С.А., Волвилер А.С. (ноябрь 2008 г.). «Исследование магнитного кругового дихроизма комплекса дикобальт (II) метионинаминопептидаза/фумагиллин и модельных комплексов дикобальта II-II и II-III». Неорг хим . 47 (22): 10499–508. дои : 10.1021/ic8011553 . ПМИД 18921993 .
- ^ Уилкокс Д.Э. (ноябрь 1996 г.). «Биядерные металлогидролазы». хим. Преподобный . 96 (7): 2435–2458. дои : 10.1021/cr950043b . ПМИД 11848832 .
- ^ Д'Суза В.М., Хольц Р.С. (август 1999 г.). «Метиониламинопептидаза из Escherichia coli может функционировать как фермент железа (II)» . Биохимия . 38 (34): 11079–85. дои : 10.1021/bi990872h . ПМИД 10460163 .
- ^ Чанг Ю.Х., Тейчерт Ю., Смит Дж.А. (апрель 1992 г.). «Молекулярное клонирование, секвенирование, делеция и сверхэкспрессия гена метионинаминопептидазы из Saccharomyces cerevisiae» . Ж. Биол. Хим . 267 (12): 8007–11. дои : 10.1016/S0021-9258(18)42400-3 . ПМИД 1569059 .
- ^ Гош М., Грюнден А.М., Данн Д.М., Вайс Р., Адамс М.В. (сентябрь 1998 г.). «Характеристика нативных и рекомбинантных форм необычной кобальт-зависимой пролиндипептидазы (пролидазы) гипертермофильной археи Pyrococcus Furiosus» . Дж. Бактериол . 180 (18): 4781–9. дои : 10.1128/JB.180.18.4781-4789.1998 . ПМК 107500 . ПМИД 9733678 .
- ^ Ван Дж., Шеппард Г.С., Лу П., Каваи М., Парк С., Иган Д.А. и др. (май 2003 г.). «Физиологически значимым металлическим кофактором метионинаминопептидазы-2 является марганец». Биохимия . 42 (17): 5035–42. дои : 10.1021/bi020670c . ПМИД 12718546 .
- ^ Леопольдини М., Руссо Н., Тоскано М. (июнь 2007 г.). «Какой из Zn (II), Co (II), Mn (II) и Fe (II) является наиболее эффективным ионом для реакции, катализируемой метионинаминопептидазой?». Дж. Ам. хим. Соц . 129 (25): 7776–84. дои : 10.1021/ja068168t . ПМИД 17523636 .
- ^ Лоутер В.Т., Чжан Ю., Сэмпсон П.Б., Хонек Дж.Ф., Мэтьюз Б.В. (ноябрь 1999 г.). «Понимание механизма действия метионинаминопептидазы Escherichia coli на основе структурного анализа продуктов реакции и аналогов переходного состояния на основе фосфора». Биохимия . 38 (45): 14810–9. дои : 10.1021/bi991711g . ПМИД 10555963 .
- ^ Шульц Б.Е., Е Б., Ли Х, Чан С.И. (1997). «Электронный парамагнитный резонанс и магнитные свойства модельных комплексов биядерных активных центров ферментов гидролазы». Неорг. Хим . 36 (12): 2617–2622. дои : 10.1021/ic960988r .
- ^ Корендович И.В., Крятов С.В., Райф В.М., Рыбак-Акимова Е.В. (ноябрь 2005 г.). «Модель ди-железа (II) мю-аква-мю-гидрокси для негемовых участков железа в белках». Неорг хим . 44 (24): 8656–8. дои : 10.1021/ic051739i . ПМИД 16296818 .
- ^ Ли Дж., Цуй Ю. М., Чен Л. Л., Гу М., Ли Дж., Нан Ф. Дж. и др. (май 2004 г.). «Мутации в сайтах S1 метионинаминопептидаз Escherichia coli и Homo sapiens выявляют остатки, критические для субстратной специфичности» . Ж. Биол. Хим . 279 (20): 21128–34. дои : 10.1074/jbc.M401679200 . ПМИД 14976199 .
- ^ Ву С., Рехемтулла А., Гупта Н.К., Кауфман Р.Дж. (июнь 1996 г.). «Гликопротеин массой 67 кДа, связанный с эукариотическим фактором инициации трансляции 2, частично обращает вспять ингибирование синтеза белка активированной двухцепочечной РНК-зависимой протеинкиназой в интактных клетках». Биохимия . 35 (25): 8275–80. дои : 10.1021/bi953028+ . ПМИД 8679583 .
- ^ Бенни О., Фаинару О., Адини А., Кассиола Ф., Базине Л., Адини И. и др. (июль 2008 г.). «Низкомолекулярный состав для перорального введения с антиангиогенной и противораковой активностью» . Нат. Биотехнология . 26 (7): 799–807. дои : 10.1038/nbt1415 . ПМК 2803109 . ПМИД 18587385 .
- ^ Перейти обратно: а б Сато Ю. (2004). «Аминопептидазы в здоровье и болезнях: роль аминопептидаз в ангиогенезе» . Биол. Фарм. Бык . 27 (6): 772–776. дои : 10.1248/bpb.27.772 . ПМИД 15187415 .
- ^ Перейти обратно: а б с Чен X, Се С, Бхат С, Кумар Н, Шапиро Т.А., Лю Джо (февраль 2009 г.). «Фумагиллин и фумарранол взаимодействуют с метионинаминопептидазой 2 P. falciparum и ингибируют рост малярийных паразитов in vitro и in vivo». хим. Биол . 16 (2): 193–202. doi : 10.1016/j.chembiol.2009.01.006 . ПМИД 19246010 .
- ^ «Zafgen объявляет о положительных результатах фазы 1b по ZGN-433 при ожирении» . МедНьюс . Наркотики.com. 01.01.2011 . Проверено 13 апреля 2011 г.
- ^ «Зафген останавливает разработку Белораниба, сокращая рабочие места примерно на 34%» . nasdaq.com. 20 июля 2016 г.
- ^ Гил Дж., Эстебан М., Рот Д. (декабрь 2000 г.). «Регуляция in vivo дцРНК-зависимой протеинкиназы PKR клеточным гликопротеином p67». Биохимия . 39 (51): 16016–25. дои : 10.1021/bi001754t . ПМИД 11123929 .
Дальнейшее чтение
[ редактировать ]- Пригмор Э., Ахмед С., Бест А., Козма Р., Мансер Э., Сигал А.В. и др. (май 1995 г.). «Киназа 68-кДа и НАДФН-оксидазный компонент p67phox являются мишенями для Cdc42Hs и Rac1 в нейтрофилах» . Ж. Биол. Хим . 270 (18): 10717–22. дои : 10.1074/jbc.270.18.10717 . ПМИД 7738010 .
- Ли X, Чанг Ю. Х. (февраль 1995 г.). «Молекулярное клонирование комплементарной ДНК человека, кодирующей белок, связанный с фактором инициации 2 (p67)». Биохим. Биофиз. Акта . 1260 (3): 333–6. дои : 10.1016/0167-4781(94)00227-т . ПМИД 7873610 .
- Рэй М.К., Чакраборти А., Датта Б., Чаттопадхьяй А., Саха Д., Бозе А. и др. (май 1993 г.). «Характеристики эукариотического фактора инициации 2, связанного с полипептидом массой 67 кДа». Биохимия . 32 (19): 5151–9. дои : 10.1021/bi00070a026 . ПМИД 8098621 .
- Лю С., Видом Дж., Кемп К.В., Крюс К.М., Кларди Дж. (ноябрь 1998 г.). «Структура метионинаминопептидазы-2 человека в комплексе с фумагиллином». Наука . 282 (5392): 1324–7. Бибкод : 1998Sci...282.1324L . дои : 10.1126/science.282.5392.1324 . ПМИД 9812898 .
- Гриффит Э.К., Су З., Ниваяма С., Рамзи К.А., Чанг Ю.Х., Лю Дж.О. (декабрь 1998 г.). «Молекулярное распознавание ингибиторов ангиогенеза фумагиллина и овалицина метионинаминопептидазой 2» . Учеб. Натл. акад. наук. США . 95 (26): 15183–8. Бибкод : 1998PNAS...9515183G . дои : 10.1073/pnas.95.26.15183 . ПМК 28017 . ПМИД 9860943 .
- Датта Б., Датта Р., Мукерджи С., Чжан З. (1999). «Увеличенное фосфорилирование эукариотического фактора инициации 2альфа на границе G2/M в клетках остеосаркомы человека коррелирует с дегликозилированием p67 и снижением скорости синтеза белка». Эксп. Сотовый Res . 250 (1): 223–30. doi : 10.1006/excr.1999.4508 . ПМИД 10388536 .
- Гил Дж., Эстебан М., Рот Д. (2001). «Регуляция in vivo дцРНК-зависимой протеинкиназы PKR клеточным гликопротеином p67». Биохимия . 39 (51): 16016–25. дои : 10.1021/bi001754t . ПМИД 11123929 .
- Каталано А, Романо М, Робуффо И, Стрицци Л, Прокопио А (август 2001 г.). «Метионинаминопептидаза-2 регулирует выживаемость клеток мезотелиомы человека: роль экспрессии Bcl-2 и активности теломеразы» . Являюсь. Дж. Патол . 159 (2): 721–31. дои : 10.1016/S0002-9440(10)61743-9 . ПМК 1850571 . ПМИД 11485930 .
- Эндо Х., Такенага К., Канно Т., Сато Х., Мори С. (2002). «Метионинаминопептидаза 2 является новой мишенью для белка, связанного с метастазами, S100A4» . Ж. Биол. Хим . 277 (29): 26396–402. дои : 10.1074/jbc.M202244200 . ПМИД 11994292 .
- Канно Т., Эндо Х., Такеучи К., Моришита Ю., Фукаяма М., Мори С. (2002). «Высокая экспрессия метионинаминопептидазы типа 2 в В-клетках зародышевого центра и их неопластических аналогах» . Лаб. Инвестируйте . 82 (7): 893–901. дои : 10.1097/01.LAB.0000020419.25365.C4 . ПМИД 12118091 .
- Датта Р., Таммали Р., Датта Б. (2003). «Негативная регуляция защиты активности фосфорилирования eIF2альфа с помощью уникального кислотного домена, присутствующего на N-конце p67». Эксп. Сотовый Res . 283 (2): 237–46. дои : 10.1016/S0014-4827(02)00042-3 . ПМИД 12581743 .
- Сереро А, Джильоне С, Сардини А, Мартинес-Санс Дж, Мейннель Т (декабрь 2003 г.). «Необычные особенности пептидной деформилазы в пути удаления N-концевого метионина митохондрий человека» . Ж. Биол. Хим . 278 (52): 52953–63. дои : 10.1074/jbc.M309770200 . ПМИД 14532271 .
- Сельвакумар П., Лакшмикуттьямма А., Кантан Р., Кантан С.К., Диммок Дж.Р., Шарма Р.К. (апрель 2004 г.). «Высокая экспрессия метионинаминопептидазы 2 в колоректальных аденокарциномах человека». Клин. Рак Рез . 10 (8): 2771–5. дои : 10.1158/1078-0432.CCR-03-0218 . ПМИД 15102683 . S2CID 577037 .
- Ким С., Ламонтань К., Сабио М., Шарма С., Версаче Р.В., Юсуфф Н. и др. (май 2004 г.). «Истощение метионинаминопептидазы 2 не меняет реакцию клеток на фумагиллин или бенгамиды» . Рак Рез . 64 (9): 2984–7. дои : 10.1158/0008-5472.CAN-04-0019 . ПМИД 15126329 .