Карбоксипептидаза А
| Карбоксипептидаза А | |||
|---|---|---|---|
 Карбоксипептидаза А из поджелудочной железы крупного рогатого скота. | |||
| Идентификаторы | |||
| Номер ЕС. | 3.4.17.1 | ||
| Номер CAS. | 9031-98-5 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| ЭксПАСи | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Карбоксипептидаза А обычно относится к поджелудочной железы экзопептидазе , которая гидролизует пептидные связи С-концевых остатков с ароматическими или алифатическими боковыми цепями . Большинство ученых в этой области теперь называют этот фермент CPA1 , а родственную карбоксипептидазу поджелудочной железы - CPA2 .
Типы
[ редактировать ]Кроме того, существует еще 4 фермента млекопитающих, названных от CPA-3 до CPA-6, и ни один из них не экспрессируется в поджелудочной железе. Вместо этого эти другие CPA-подобные ферменты имеют разнообразные функции.
- CPA3 (также известный как CPA тучных клеток) участвует в переваривании белков тучными клетками .
- CPA4 (ранее известный как CPA-3, но нумерация была изменена, когда CPA тучных клеток был обозначен как CPA-3) может участвовать в прогрессировании опухоли , но этот фермент недостаточно изучен.
- CPA5 недостаточно изучен.
- CPA6 экспрессируется во многих тканях во время развития мышей, а у взрослых обнаруживает более ограниченное распространение в мозге и некоторых других тканях. CPA6 присутствует во внеклеточном матриксе, где он ферментативно активен. Мутация CPA-6 у человека связана с синдромом Дуэйна (аномальным движением глаз). Недавно было обнаружено, что мутации в CPA6 связаны с эпилепсией. CPA6 также является одним из нескольких ферментов, расщепляющих энкефалины .
Функция
[ редактировать ]CPA-1 и CPA-2 (и, предположительно, все остальные CPA) используют ион цинка внутри белка для гидролиза пептидной связи на С-конце аминокислотного остатка. Потеря цинка приводит к потере активности, которую легко заменить цинком, а также некоторыми другими двухвалентными металлами ( кобальтом , никелем ). Карбоксипептидаза А вырабатывается в поджелудочной железе и имеет решающее значение для многих процессов в организме человека, включая пищеварение, посттрансляционную модификацию белков, свертывание крови и размножение.
Приложения
[ редактировать ]Такой обширный объем функциональности одного белка делает его идеальной моделью для исследований других протеаз цинка неизвестной структуры. Недавние биомедицинские исследования коллагеназы, энкефалиназы и ангиотензинпревращающего фермента использовали карбоксипептидазу А для синтеза ингибиторов и кинетических испытаний. Например, препарат от повышенного артериального давления Каптоприл был разработан на основе ингибитора карбоксипептидазы А. Карбоксипептидаза А и целевой фермент каптоприла, ангиотензинпревращающий фермент, имеют очень схожую структуру, поскольку оба они содержат ион цинка в активном центре. Это позволило использовать мощный ингибитор карбоксипептидазы А для ингибирования фермента и, таким образом, снижения кровяного давления через систему ренин-ангиотензин-альдостерон. [1]
Структура
[ редактировать ]Карбоксипептидаза А (CPA) содержит цинк (Zn 2+ ) металлический центр тетраэдрической геометрии с аминокислотными остатками, расположенными в непосредственной близости от цинка для облегчения катализа и связывания. Из 307 аминокислот, связанных в пептидную цепь, следующие аминокислотные остатки важны для катализа и связывания; Glu-270, Arg-71, Arg-127, Asn-144, Arg-145 и Tyr-248. На рисунке 1 показан активный центр тетраэдрического комплекса цинка с важными аминокислотными остатками, окружающими комплекс. [2]
Металлический цинк является сильным электрофильным катализатором на основе кислоты Льюиса, который стабилизирует координированную молекулу воды, а также стабилизирует отрицательные промежуточные продукты, которые возникают в ходе гидролитической реакции. Стабилизации как координированной молекулы воды, так и отрицательных промежуточных продуктов способствуют полярные остатки в активном центре, которые находятся в непосредственной близости, что облегчает образование водородных связей. [2]

Активный сайт можно охарактеризовать как два подсайта, обозначенных как S 1 ' и S 1 . Субсайт S1 ' представляет собой гидрофобный карман фермента, а Tyr-248 действует как «закрывающий» гидрофобный карман после связывания субстрата или ингибитора (SITE). [2] Водородная связь гидроксильной группы в Tyr-248 облегчает эту конформацию за счет взаимодействия с концевыми карбоксилатами связывающихся субстратов. Для этого фермента требуется существенное движение, и модель индуцированного соответствия объясняет, как происходит это взаимодействие.
Триада остатков взаимодействует с С-концевым карбоксилатом посредством водородных связей:
- Связь соли с положительно заряженным Arg-145.
- Водородная связь из Tyr-248
- Водородная связь азота амида Asn-144.
Механизм
[ редактировать ]Карбоксипептидаза А, классифицируемая как металлоэкзопептидаза, состоит из одной полипептидной цепи, связанной с ионом цинка. Этот характерный ион металла расположен в активном центре фермента вместе с пятью аминокислотными остатками, которые участвуют в связывании субстрата: Arg-71, Arg-127, Asn-144, Arg-145, Tyr-248 и Glu-. 270. Рентгеновские кристаллографические исследования выявили пять субсайтов в белке. Эти аллостерические сайты участвуют в создании лиганд-ферментной специфичности, наблюдаемой у большинства биоактивных ферментов. Один из этих субсайтов вызывает конформационные изменения Tyr-248 при связывании молекулы субстрата в первичном активном сайте. Фенольный гидроксил тирозина образует водородную связь с концевым карбоксилатом лиганда. Кроме того, между тирозином и пептидной связью более длинных пептидных субстратов образуется вторая водородная связь. Эти изменения делают связь между ферментом и лигандом, будь то субстрат или ингибитор, намного прочнее. Это свойство карбоксипептидазы А привело к первому пункту Дэниела Э. Кошланда-младшего Гипотеза «индуцированного соответствия» .
Субсайт S1 — это место , где в CPA происходит катализ, а ион цинка координируется остатками ферментов Glu-72, His-69 и His-196. Существует плоскость, которая делит пополам бороздку активного центра, где остатки Glu-270 и Arg-127 находятся на противоположных сторонах комплекса цинк-вода. Цинк богат электронами из-за глутаминовых лигандов, координирующих цинк, поскольку до связывания субстрата Glu-72 координирует бидентатную связь, но после связывания субстрата переходит в монодентатную. В результате металлический цинк не способен депротонировать координированную молекулу воды с образованием гидроксильного нуклеофила. [2]
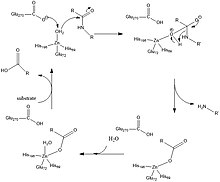
Glu-270 и Arg-127 играют важную роль в катализе, показанном на рисунке 2. Arg-127 стабилизирует карбонил субстрата, который связан с аминогруппой фенилаланина. Одновременно координированная с цинком молекула воды депротонируется Glu-270 и взаимодействует с карбонилом, стабилизированным Arg-127. Это создает промежуточный продукт, показанный на рисунке 2, где отрицательно заряженный кислород координируется с цинком и за счет неблагоприятных электростатических взаимодействий между Glu-270 и ионизированным продуктом способствует высвобождению продукта в конце катализа. [2]
В недавних компьютерных исследованиях механизм катализа аналогичен, но разница в механизме заключается в том, что депротонированная молекула воды связывается с углеродом карбонила, тогда как на рисунке 2 показано, что гидроксильная группа остается координированной с цинком. Затем происходит протеолиз, и молекула воды возвращается в активный центр для координации с цинком. [3]
Было проведено несколько исследований, изучающих детали связи между карбоксипептидазой А и субстратом и то, как это влияет на скорость гидролиза. В 1934 году в ходе кинетических экспериментов впервые было обнаружено, что для связывания субстрата пептид, подлежащий гидролизу, должен находиться рядом с концевой свободной гидроксильной группой. Кроме того, скорость гидролиза можно повысить, если С-концевой остаток является разветвленным алифатическим или ароматическим. Однако если субстратом является дипептид со свободной аминогруппой, он гидролизуется медленно; этого, однако, можно избежать, если аминогруппа блокируется N-ацилированием. [4]
Совершенно очевидно, что структура фермента, а именно активного центра, очень важна для понимания механизма реакции. По этой причине Рис и его коллеги изучили комплекс фермент-лиганд, чтобы получить четкий ответ о роли иона цинка. Эти исследования показали, что в свободном ферменте координационное число цинка равно пяти; Металлический центр координируется с двумя атомами азота имидазола Nδ1, двумя атомами кислорода карбоксилата глутамата-72 и молекулой воды, образуя искаженный тетраэдр. Однако как только лиганд связывается с активным центром карбоксипептидазы А, это координационное число может варьироваться от пяти до шести. При связывании с дипептидом глицил-L-тирозином аминный азот дипептида и карбонильный кислород заменяли водный лиганд. Это дало бы координационное число цинка в комплексе карбоксипептидаза А-дипептид-глицил-L-тирозин, равное шести. Карты электронной плотности показали, что аминный азот занимает второе положение рядом с глутаматом-270. Близость этих двух остатков приведет к стерическому затруднению, препятствующему координации водного лиганда с цинком. В результате координационное число будет равно пяти. Данные по обоим случаям значительны и указывают на то, что обе ситуации возникают естественным образом. [5]
Существует два предполагаемых механизма каталитической функции карбоксипептидазы А. Первый - это нуклеофильный путь, включающий ковалентное ацильное промежуточное соединение фермента, содержащее основание активного центра Glu-270. Доказательства существования этого промежуточного ангидрида неоднозначны; Су и его коллеги выделили то, что, как предполагается, является ацильным промежуточным соединением. Однако подтверждение существования ацилового фермента было сделано без экспериментов по улавливанию, что сделало выводы слабыми. [1]
Второй предложенный механизм – это усиленный водный путь. Этот механизм включает атаку молекулы воды на разрезаемую пептидную связь субстрата. Этому процессу способствует ион цинка, а также остаток Glu-270. [1]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Кристиансон Д.В. , Липскомб В.Н. (февраль 1989 г.). «Карбоксипептидаза А». Отчеты о химических исследованиях . 22 (2): 62–9. дои : 10.1021/ar00158a003 .
- ^ Jump up to: а б с д и Кристиансон Д. В. и Липскомб В. Н. (1989) Карбоксипептидаза А. Американское химическое общество , Том (22): 62-69.
- ^ Вальдес С.Э., Моргенштерн А., Эберхарт М.Е., Александрова А.Н. (ноябрь 2016 г.). «Прогностические методы вычислительного редизайна металлоферментов - тестовый пример с карбоксипептидазой А» (PDF) . Физическая химия Химическая физика . 18 (46): 31744–31756. Бибкод : 2016PCCP...1831744V . дои : 10.1039/c6cp02247b . ПМИД 27841396 . S2CID 3545851 .
- ^ Липскомб, WN (март 1970 г.). «Структура и механизм ферментативной активности карбоксипептидазы А и связь с химической последовательностью». Отчеты о химических исследованиях . 3 (3): 81–9. дои : 10.1021/ar50027a001 .
- ^ Рис Д.К., Льюис М., Хонзатко Р.Б., Липскомб В.Н., Хардман К.Д. (июнь 1981 г.). «Цинковое окружение и цис-пептидные связи в карбоксипептидазе А при разрешении 1,75 А» . Труды Национальной академии наук Соединенных Штатов Америки . 78 (6): 3408–12. Бибкод : 1981PNAS...78.3408R . дои : 10.1073/pnas.78.6.3408 . ПМК 319577 . ПМИД 6943549 .
Внешние ссылки
[ редактировать ]- Онлайн-база данных MEROPS . по пептидазам и их ингибиторам: M14.001
- Карбоксипептидазы + A Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)