Бета-выпуклая петля
Бета-выпуклые петли представляют собой часто встречающиеся мотивы в белках и полипептидах, состоящих из пяти-шести аминокислот . [ 1 ] [ 2 ] [ 3 ] Существует два типа: тип 1, представляющий собой пентапептид; и тип 2 с шестью аминокислотами . Они считаются разновидностью бета-выпуклости и имеют альтернативное название бета-выпуклости типа G1. По сравнению с другими бета-выпуклыми петлями , петли бета-выпуклости приводят к перевороту цепи, так что они часто возникают на концах петель бета-шпильок ; Шпильки такого типа можно охарактеризовать как 3:5 (для петли β-выпуклости типа 1) или 4:6 (для типа 2). [ 4 ] Для поиска и изучения β-выпуклых петель в белках доступны два веб-сайта: Motivated Proteins: [1] [ 5 ] и PDBeMotif: [2] . [ 6 ]
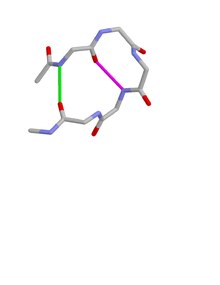
между основными цепями Бета-выпуклые петли типа I имеют две характерные водородные связи . Один находится между CO остатка i и NH остатка i+3 (β-поворот); другой находится между CO остатка i+4 и NH остатка i.
Петли бета-выпуклости типа 2 имеют две характерные водородные связи между основными цепями. Один находится между CO остатка i и NH остатка i+4 (α-поворот); другой находится между CO остатка i+5 и NH остатка i.
Петли бета-выпуклости часто содержат аспартат , аспарагин , серин или треонин в остатке i вместе с гнездом (структурный мотив белка) в остатках от i+2 до i+4 (тип 1) или остатках от i+3 до i+5 (тип 2), при этом кислород боковой цепи связывается с NH-группами основной цепи гнезда. [ 7 ] Был описан сайт-направленный мутагенез остатков asx в β-выпуклых петлях белка, показывающий, что боковая цепь остатка asx в различных альтернативных положениях внутри β-выпуклой петли связывается с гнездом и тем самым помогает стабилизировать петлю. [ 8 ]
Ссылки
[ редактировать ]- ^ Милнер-Уайт, Э.Дж. (1987). «Бета-выпуклости внутри петель являются повторяющимися особенностями структуры белка». Биохим Биофиз Акта . 911 (2): 261–265. дои : 10.1016/0167-4838(87)90017-3 . ПМИД 3801498 .
- ^ Чан, EAW; Хатчинсон Э.Г. (1993). «Идентификация, классификация и анализ β-выпуклостей в белках» . Белковая наука . 2 (10): 1574–1590. дои : 10.1002/pro.5560021004 . ПМК 2142268 . ПМИД 8251933 .
- ^ Бландл, Т; Кокран АГ (2003). «Стабильность поворотов в пептидах-шпильках. Исследование пептидов, содержащих выпуклые повороты G1 типа 1 3:5» . Белковая наука . 12 (2): 237–247. дои : 10.1110/ps.0228603 . ПМК 2312432 . ПМИД 12538887 .
- ^ Сибанда, БЛ; Бланделл ТЛ; Торнтон Дж. М. (1989). «Конформация β-шпильок в белковых структурах. Систематическая классификация с приложениями к моделированию». Журнал молекулярной биологии . 206 (4): 759–777. дои : 10.1016/0022-2836(89)90583-4 . ПМИД 2500530 .
- ^ Руководитель, ДП; Милнер-Уайт, Э.Дж. (2009). «Мотивированные белки: веб-приложение для изучения небольших трехмерных белковых мотивов» . БМК Биоинформатика . 10 (1): 60. дои : 10.1186/1471-2105-10-60 . ПМЦ 2651126 . ПМИД 19210785 .
- ^ Головин А; Хенрик К. (2008). «MSDmotif: изучение белковых сайтов и мотивов» . БМК Биоинформатика . 9 (1): 312. дои : 10.1186/1471-2105-9-312 . ПМК 2491636 . ПМИД 18637174 .
- ^ Афзал, AM; Аль-Шубайли Ф (2014). «Соединение анионов водородными связями в мотивах гнезда и его значение для мотивов Шеллмана и других более крупных мотивов внутри белков». Белки . 82 (11): 3023–3031. дои : 10.1002/прот.24663 . ПМИД 25132631 . S2CID 12131403 .
- ^ Ли, Дж; Дубей В.К.; Лонго Л.М.; Блабер М (2008). «Логическая избыточность ИЛИ в мотиве β-поворота Asx-Pro-Asx-Gly». Журнал молекулярной биологии . 377 (4): 1251–1264. дои : 10.1016/j.jmb.2008.01.055 . ПМИД 18308335 .