Гнездо (белковый структурный мотив)
Гнездо — это тип белкового структурного мотива . Это небольшая повторяющаяся особенность связывания анионов как белков , так и пептидов . [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ] [ 9 ] Каждый состоит из атомов основной цепи из трех последовательных аминокислотных остатков. Группы NH основной цепи связывают анионы, тогда как атомы боковой цепи часто не участвуют. В остатках пролина отсутствуют группы NH, поэтому они редко встречаются в гнездах. В среднем примерно один из 12 аминокислотных остатков в белках принадлежит гнезду.
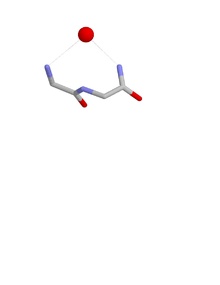
Конформации гнезда
[ редактировать ]Конформация гнезда такова, что группы NH первого и третьего аминокислотных остатков могут образовывать водородные связи с отрицательно заряженным или частично отрицательно заряженным атомом, часто с атомом кислорода. NH второго остатка также может быть связан водородной связью с тем же атомом, но обычно направлен несколько в сторону. Эти атомы основной цепи образуют вогнутость, называемую гнездом, в которую помещается анионный атом. Такие анионные атомы иногда называют яйцами, и в гнезде может оказаться более одного яйца. Оксианионное сериновых отверстие кишечных протеаз является функциональным примером гнезда. Другой находится на дне глубокой полости в антибиотике пептиде ванкомицине , который связывает ключевую карбоксилатную группу, используемую на заключительных стадиях синтеза клеточной стенки бактерий , тем самым предотвращая размножение бактериальных клеток.
Гнезда определяются конформацией атомов основной цепи, а именно двугранными углами фи, пси первых двух аминокислот в гнезде. Для типового (RL) гнезда phi i =-90°; фунт на квадратный дюйм = 0°; фи i+1 =80°; фунт на квадратный дюйм i+1 = 20°.
Гнезда различаются по степени вогнутости. У некоторых их так мало, что вогнутость теряется; эти пептиды часто связывают катионы через группы CO основной цепи, а не анионы через группы NH. Фильтр специфичности калиевого канала [ 10 ] и водный канал аквапорина демонстрирует эту более линейную конформацию, в которой карбонильные группы используются белками для транспортировки молекул через мембраны. Эта почти линейная конформация также встречается в нити альфа-листа. [ 11 ] [ 12 ] [ 13 ]
Сложные гнезда
[ редактировать ]Если два гнезда перекрываются так, что остаток i+1 первого гнезда является остатком i второго гнезда, формируется составное гнездо. Здесь четыре группы NH вместо трех. Если три гнезда перекрываются так, что остатки i+1 и i+2 первого гнезда являются остатками i второго и третьего гнезда, образуется более широкое составное гнездо с пятью группами NH и так далее. Атомы основной цепи образуют часть неполного кольца, причем все группы NH направлены примерно к центру кольца. Поскольку их вогнутости часто шире, чем простые гнезда, сложные гнезда обычно используются белками для связывания многоатомных анионов, таких как фосфаты , как в P-петле или мотивах Уокера , а также в кластерах железо-сера . Было показано , что синтезированный пептид Ser-Gly-Ala-Gly-Lys-Thr, спроектированный как минимальная пептидная P-петля , прочно связывает неорганический фосфат при нейтральном pH. [ 14 ]
Виды гнезд
[ редактировать ]Простые гнезда бывают двух видов, называемых RL и LR, в зависимости от знака углов фи первых двух остатков гнезда. Остатки R имеют отрицательные значения фи (как в правосторонней альфа-спирали), а остатки L имеют положительные значения фи (как в левой альфа-спирали ). Восемьдесят процентов гнезд относятся к RL, а 20% — к LR. Когда два гнезда перекрываются, это могут быть RLR или LRL. Когда три гнезда перекрываются, это могут быть RLRL или LRLR и так далее.
Каждая петля Шеллмана включает гнездо RL в последних трех из шести ее остатков. Гнездо карбонильные последовательно связывает предшествующие ему атомы кислорода.
Ряд белков антител имеют гнезда RLR внутри шпилек их CDR H-цепи ( областей, определяющих комплементарность ), связанных с карбоксилатной боковой цепью. Они были созданы для получения моноклональных антител, содержащих гнезда, специфичных к белкам с фосфорилированными серинами и треонинами . [ 15 ]
Большинство доменов PDZ имеют гнездо RL в начале первой бета-цепи с функцией распознавания карбоксилатной группы на С-конце пептида или белкового лиганда домена. [ 16 ]
Ссылки
[ редактировать ]- ^ Уотсон, доктор медицинских наук; Милнер-Уайт (2002). «Новый сайт связывания анионов в белках: гнездо. Особая комбинация значений phi,psi в последовательных остатках приводит к появлению сайтов связывания анионов, которые встречаются обычно и часто встречаются в функционально важных областях». Журнал молекулярной биологии . 315 (2): 171–182. дои : 10.1006/jmbi.2001.5227 . ПМИД 11779237 .
- ^ Пал, Д; Сухель (2002). «Новые принципы строения белка: гнезда, яйца и что дальше?». Angew Chem Int Ed . 41 (24): 4663–4665. дои : 10.1002/anie.200290009 . ПМИД 12481319 .
- ^ Милнер-Уайт, Э.Дж.; Ниссинк (2004). «Повторяющиеся анион-связывающие мотивы основной цепи в коротких полипептидах: гнезда» . Acta Crystallographica Раздел D. Д60 (11): 1935–1942. дои : 10.1107/s0907444904021390 . ПМИД 15502299 .
- ^ Паевский, Р; Фердани (2005). «Катионная зависимость комплексообразования хлорид-ионов молекулами рецептора с открытой цепью в растворе хлороформа». Журнал Американского химического общества . 127 (51): 18281–18295. дои : 10.1021/ja0558894 . ПМИД 16366583 .
- ^ Беркессель, А; Кох (2006). «Асимметричное эпоксидирование енона твердофазными пептидами: дополнительные доказательства спиральности катализатора и каталитической активности отдельных цепей». Биополимеры . 84 (1): 90–96. дои : 10.1002/bip.20413 . ПМИД 16283656 .
- ^ Милнер-Уайт, Э.Дж.; Рассел (2006). «Предсказание конформаций белков и пептидов на ранней стадии эволюции» . Биология Директ . 3 :3. дои : 10.1186/1745-6150-3-3 . ПМК 2241844 . ПМИД 18226248 .
- ^ Уотсон, доктор медицинских наук; Ласковский (2005). «ProFunc: сервер для прогнозирования функций белков по трехмерной структуре» . Исследования нуклеиновых кислот . 33 (Веб-сервер): W89–W93. дои : 10.1093/nar/gki414 . ПМК 1160175 . ПМИД 15980588 .
- ^ Лэнгтон, MJ; Серпелл CJ; Пивной ПД (2016). «Распознавание анионов в воде: последние достижения с супрамолекулярной и макромолекулярной точки зрения» . Angewandte Chemie, международное издание . 55 (6): 1974–1987. дои : 10.1002/anie.201506589 . ПМЦ 4755225 . ПМИД 26612067 .
- ^ Кремер, П; Флуд АС; Гибб, Британская Колумбия; Мобли Д.Л. (2018). «Совместные пути к прояснению мутных вод водной супрамолекулярной химии» . Природная химия . 10 (1): 8–16. дои : 10.1038/nchem.2894 . ПМИД 29256514 . S2CID 205298633 .
- ^ Уотсон, доктор медицинских наук; Милнер-Уайт (2002). «Конформации полипептидных цепей, в которых части основной цепи последовательных остатков являются энантиомерными. Их возникновение в катион- и анион-связывающих областях белков». Журнал молекулярной биологии . 315 (15): 183–191. дои : 10.1006/jmbi.2001.5228 . ПМИД 11779238 .
- ^ Милнер-Уайт, Э.Дж.; Уотсон (2006). «Образование амилоида может включать взаимное превращение альфа-в бета-листов посредством переворота плоскости пептида» . Структура . 14 (9): 1369–1376. дои : 10.1016/j.str.2006.06.016 . ПМИД 16962968 .
- ^ Хейворд, С; Милнер-Уайт (2008). «Геометрия α-листа: значение его возможной функции в качестве предшественника амилоида в белках». Белки . 71 (1): 415–425. дои : 10.1002/прот.21717 . ПМИД 17957773 . S2CID 43848293 .
- ^ Хейворд, С; Милнер-Уайт (2011). «Моделирование перехода от β- к α-листу приводит к образованию скрученного листа для антипараллельных и α-нанотрубки для параллельных нитей: последствия для образования амилоида». Белки . 79 (11): 3193–3207. дои : 10.1002/прот.23154 . ПМИД 21989939 . S2CID 8761012 .
- ^ Бьянки, А; Георгий А; Руза П; Тониоло С (2013). «Показано, что синтетический гексапептид, напоминающий белковое гнездо P-петли, связывает неорганический фосфат». Белки . 80 (5): 1418–1424. дои : 10.1002/прот.24038 . ПМИД 22275093 . S2CID 5401588 .
- ^ Кербер, Дж. Т.; Томсен Н.Д.; Ханниган Б.Т.; ДеГрадо ВФ; Уэллс Дж. А. (2013). «Вдохновленный природой дизайн каркасов антител, специфичных для мотивов» . Природная биотехнология . 31 (10): 916–921. дои : 10.1038/nbt.2672 . ПМЦ 3795957 . ПМИД 23955275 .
- ^ Ли, HJ; Чжэн Джей-Джей (2010). «Домены PDZ и их партнеры по связыванию: специфика структуры и модификация» . Сотовая связь и сигнализация . 8 :8. дои : 10.1186/1478-811x-8-8 . ПМК 2891790 . ПМИД 20509869 .
Внешние ссылки
[ редактировать ]- ^ Руководитель, ДП; Милнер-Уайт (2009). «Мотивированные белки: веб-приложение для изучения небольших трехмерных белковых мотивов» . БМК Биоинформатика . 10 (1): 60. дои : 10.1186/1471-2105-10-60 . ПМЦ 2651126 . ПМИД 19210785 .
- ^ Головин А; Хенрик (2008). «MSDmotif: изучение белковых сайтов и мотивов» . БМК Биоинформатика . 9 (1): 312. дои : 10.1186/1471-2105-9-312 . ПМК 2491636 . ПМИД 18637174 .