Бета-поворот
β-изгибы (также β-изгибы , тугие повороты , обратные повороты , повороты Венкатачалама ) — наиболее распространенная форма поворотов — тип нерегулярной вторичной структуры в белках , вызывающий изменение направления полипептидной цепи . Это очень распространенные мотивы в белках и полипептидах . [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ] [ 8 ] [ 9 ] Каждый состоит из четырех аминокислотных остатков (обозначенных i , i+1 , i+2 и i+3 ). Их можно определить двумя способами:
- Благодаря наличию водородной связи внутри основной цепи между CO остатка i и NH остатка i+3 ;
- Имея расстояние менее 7 Å между атомами Cα остатков i и i+3 .
Критерий водородной связи является наиболее подходящим для повседневного использования, отчасти потому, что он дает начало четырем различным категориям; критерий расстояния приводит к тем же четырем категориям, но дает дополнительные типы поворотов.
Определение
[ редактировать ]Критерий водородной связи
[ редактировать ]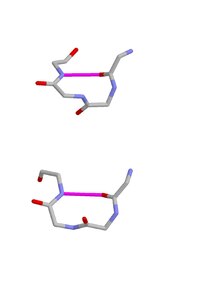
Критерий водородной связи для бета-поворотов, примененный к полипептидам, аминокислоты которых связаны транспептидными связями, дает начало всего четырем категориям, как показал Венкатачалам в 1968 году. Их называют типами I, II, I' и II'. Все они регулярно встречаются в белках и полипептидах, но наиболее распространен тип I, поскольку он больше всего напоминает альфа-спираль , встречающуюся внутри 3–10 спиралей и на концах некоторых классических альфа-спиралей. С другой стороны, бета-повороты типа II часто происходят в сочетании с бета-листом как часть бета-ссылок .
Четыре типа бета-поворота различаются углами φ, ψ остатков i+1 и i+2 , как показано в таблице ниже, дающей типичные средние значения. Глицины особенно распространены как аминокислоты с положительными углами φ; для пролинов такая конформация стерически невозможна, но они часто встречаются в аминокислотных положениях, где φ отрицательна.
| φ я+1 | ψ я+1 | φ я+2 | ψ я+2 | |
|---|---|---|---|---|
| тип I | -60 | -30 | -90 | 0 |
| тип II | -60 | 120 | 80 | 0 |
| набери я' | 60 | 30 | 90 | 0 |
| тип II' | 60 | -120 | -80 | 0 |
β-повороты типов I и II демонстрируют взаимосвязь друг с другом, поскольку они потенциально взаимопревращаются в процессе переворота плоскости пептида (поворот плоскости пептида CONH на 180 ° с небольшим изменением положения боковых цепей и окружающих пептидов). Такая же связь существует между β-поворотами I' и II' типов. Некоторые данные указывают на то, что эти взаимные превращения происходят в бета-поворотах белков, так что кристаллические или ЯМР-структуры просто обеспечивают снимок β-поворотов, которые на самом деле обмениваются местами. [ 10 ] В белках в целом все четыре типа бета-поворотов встречаются часто, но наиболее распространенным является I, за которым следуют II, I' и II' в этом порядке. Бета-витки особенно распространены на концах петель бета-шпильок ; у них иное распределение типов, чем у остальных; тип I' является наиболее распространенным, за ним следуют типы II', I и II. Дополнительные типы поворотов были определены путем кластеризации конформаций поворотов в белковых структурах с очень высоким разрешением. [ 11 ]
Повороты Asx и повороты ST напоминают бета-повороты, за исключением того, что остаток i заменен боковой цепью аспартата , аспарагина , серина или треонина . Водородная связь главная цепь-основная цепь заменяется водородной связью боковая цепь-основная цепь. Компьютерное 3D-наложение показывает, что в белках они встречаются [ 12 ] как один из тех же четырех типов, что и бета-повороты, за исключением того, что их относительная частота встречаемости различается: тип II' является наиболее распространенным, за ним следуют типы I, II и I'.
Критерий расстояния
[ редактировать ]Помимо бета-витков типа I, I', II и II', определенных по критерию водородной связи, часто встречаются бета-витки без водородных связей, называемые типом VIII. Были идентифицированы три других, довольно редких типа бета-поворота, в которых пептидная связь между остатками i+1 и i+2 является цис- , а не транс- ; они называются типами VIa1, VIa2 и VIb. Другая категория, тип IV, использовалась для поворотов, не относящихся ни к одному из вышеперечисленных. Дальнейшие подробности этих оборотов приводятся в свою очередь (биохимия) .
Внешние ссылки
[ редактировать ]Доступны два веб-сайта для поиска и изучения бета-поворотов с водородными связями в белках:
Ссылки
[ редактировать ]- ^ Венкатачалам, CM (1968). «Стереохимические критерии полипептидов и белков. V. Конформация системы трех связанных пептидных единиц» (PDF) . Биополимеры . 6 (10): 1425–1436. дои : 10.1002/bip.1968.360061006 . hdl : 2027.42/37819 . ПМИД 5685102 . S2CID 5873535 .
- ^ Льюис, Пенсильвания; Момани Ф.А. (1973). «Реверс цепи в белках». Биохим Биофиз Акта . 303 (2): 211–29. дои : 10.1016/0005-2795(73)90350-4 . ПМИД 4351002 .
- ^ Тониоло, К; Бенедетти Э (1980). «Конформации пептидов с внутримолекулярными водородными связями». CRC Crit Rev Biochem . 9 (1): 1–44. дои : 10.3109/10409238009105471 . ПМИД 6254725 .
- ^ Ричардсон, Дж. С. (1981). «Анатомия и систематика структуры белка». Adv Prot Chem . Достижения в химии белков. 34 : 167–339. дои : 10.1016/S0065-3233(08)60520-3 . ISBN 9780120342341 . ПМИД 7020376 .
- ^ Роуз, Грузия; Гираш Л.М. (1985). «Превращает пептиды и белки». Adv Prot Chem . Достижения в химии белков. 37 : 1–109. дои : 10.1016/S0065-3233(08)60063-7 . ISBN 9780120342372 . ПМИД 2865874 .
- ^ Милнер-Уайт, Э.Дж.; Поэт Р. (1987). «Петли, выпуклости, повороты и шпильки в белках». Тенденции биохимической науки . 12 : 189–192. дои : 10.1016/0968-0004(87)90091-0 .
- ^ Уилмот, CM; Торнтон Дж. М. (1988). «Анализ и прогнозирование различных типов бета-поворотов в белках». Дж Мол Биол . 203 (1): 221–232. дои : 10.1016/0022-2836(88)90103-9 . ПМИД 3184187 .
- ^ Сибанда, БЛ; Бланделл Т.Л. (1989). «Конформация β-шпильок в белковых структурах: систематическая классификация с применением к моделированию по гомологии, подбору электронной плотности и белковой инженерии». Дж Мол Биол . 206 (4): 759–777. дои : 10.1016/0022-2836(89)90583-4 . ПМИД 2500530 .
- ^ Хатчинсон, Э.Г.; Торнтон Дж. М. (1994). «Пересмотренный набор потенциалов образования β-поворота в белках» . Дж Мол Биол . 3 (12): 2207–2216. дои : 10.1002/pro.5560031206 . ПМК 2142776 . ПМИД 7756980 .
- ^ Хейворд, С. (2001). «Переворот пептидной плоскости в белках» . Белковая наука . 10 (11): 2219–2227. дои : 10.1110/ps.23101 . ПМК 2374056 . ПМИД 11604529 .
- ^ Шаповалов М; Вучетич, С; Данбрек Р.Л.-младший (март 2019 г.). «Новая кластеризация и номенклатура бета-поворотов, полученная из белковых структур высокого разрешения» . PLOS Вычислительная биология . 15 (3): e1006844. Бибкод : 2019PLSCB..15E6844S . дои : 10.1371/journal.pcbi.1006844 . ПМК 6424458 . ПМИД 30845191 .
- ^ Дадди, ВМ; Ниссинк JWM (2004). «Мимикрия asx- и ST-поворотами четырех основных типов β-поворотов в белках» . Белковая наука . 13 (11): 3051–3055. дои : 10.1110/ps.04920904 . ПМК 2286581 . ПМИД 15459339 .
- ^ Руководитель, ДП; Милнер-Уайт, Э.Дж. (2009). «Мотивированные белки: веб-приложение для изучения небольших трехмерных белковых мотивов» . БМК Биоинформатика . 10 (1): 60. дои : 10.1186/1471-2105-10-60 . ПМЦ 2651126 . ПМИД 19210785 .
- ^ Головин А; Хенрик К. (2008). «MSDmotif: изучение белковых сайтов и мотивов» . БМК Биоинформатика . 9 (1): 312. дои : 10.1186/1471-2105-9-312 . ПМК 2491636 . ПМИД 18637174 .