Круговой дихроизм
Круговой дихроизм ( КД ) — это дихроизм, включающий циркулярно поляризованный свет, т. е. дифференциальное поглощение левого и правого света . [1] [2] Свет с левой круговой (LHC) и правой круговой (RHC) поляризацией представляет два возможных состояния спинового углового момента для фотона, поэтому круговой дихроизм также называют дихроизмом для спинового углового момента. [3] Это явление было открыто Жаном-Батистом Био , Огюстеном Френелем и Эме Коттоном в первой половине XIX века. [4] Круговой дихроизм и круговое двойное лучепреломление — проявления оптической активности . Он проявляется в полосах поглощения оптически активных хиральных молекул. КД- спектроскопия имеет широкий спектр применений во многих различных областях. В частности, УФ- КД используется для исследования вторичной структуры белков. [5] UV/Vis CD используется для исследования переходов с переносом заряда . [6] КД ближнего инфракрасного диапазона используется для исследования геометрической и электронной структуры путем исследования -переходов металла d → d . [2] Колебательный круговой дихроизм , в котором используется свет инфракрасной области энергии, используется для структурных исследований небольших органических молекул, а в последнее время белков и ДНК. [5]
Физические принципы
[ редактировать ]Круговая поляризация света
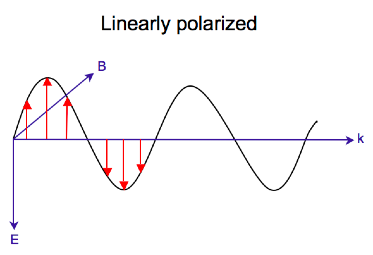
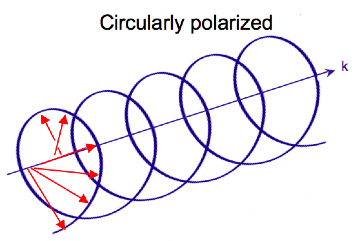
[ редактировать ]Электромагнитное излучение состоит из электрического и магнитный поле, которое колеблется перпендикулярно друг другу и направлению распространения, [7] волна поперечная . В то время как линейно поляризованный свет возникает, когда вектор электрического поля колеблется только в одной плоскости, свет с круговой поляризацией возникает, когда направление вектора электрического поля вращается вокруг направления его распространения, в то время как вектор сохраняет постоянную величину. В одной точке пространства вектор круговой поляризации очерчивает круг за один период частоты волны, отсюда и название. На двух диаграммах ниже показаны векторы электрического поля линейно и циркулярно поляризованного света в один момент времени для ряда положений; график электрического вектора с круговой поляризацией образует спираль вдоль направления распространения . Для левоциркулярно поляризованного света (ЛЦП) при распространении к наблюдателю электрический вектор вращается против часовой стрелки . [2] Для света с правой круговой поляризацией (RCP) электрический вектор вращается по часовой стрелке.
Взаимодействие циркулярно поляризованного света с веществом.
[ редактировать ]Когда свет с круговой поляризацией проходит через поглощающую оптически активную среду, скорости между правой и левой поляризациями различаются ( ), а также их длину волны ( ) и степень их поглощения ( ). Круговой дихроизм – отличие . [5] Электрическое поле светового луча вызывает линейное смещение заряда при взаимодействии с молекулой ( электрический диполь ), тогда как его магнитное поле вызывает циркуляцию заряда ( магнитный диполь ). Эти два движения в сочетании вызывают возбуждение электрона по спирали, которое включает в себя перемещение и вращение и связанные с ними операторы . Экспериментально установленная зависимость между вращательной силой образца и дается
Вращательная сила также была определена теоретически.
Из этих двух уравнений мы видим, что для того, чтобы иметь ненулевое значение , операторы электрического и магнитного дипольного момента ( и ) должно трансформироваться как то же неприводимое представление . и являются единственными точечными группами , где это может произойти, делая активными только хиральные молекулы CD.
Проще говоря, поскольку свет с круговой поляризацией сам по себе является «хиральным», он по-разному взаимодействует с хиральными молекулами . То есть два типа света с круговой поляризацией поглощаются в разной степени. В эксперименте CD равное количество левого и правого света с круговой поляризацией выбранной длины волны поочередно излучается в (хиральный) образец. Одна из двух поляризаций поглощается больше, чем другая, и измеряется эта зависящая от длины волны разница поглощения, что дает спектр КД образца. Благодаря взаимодействию с молекулой вектор электрического поля света после прохождения через образец прослеживает эллиптическую траекторию.
Важно, что хиральность молекулы может быть конформационной, а не структурной. То есть, например, белковая молекула со спиральной вторичной структурой может иметь КД, меняющийся при изменении конформации.
Дельта поглощения
[ редактировать ]По определению,
где (Дельта-поглощение) — это разница между поглощением света с левой круговой поляризацией (LCP) и правой круговой поляризацией (RCP) (это то, что обычно измеряется). является функцией длины волны , поэтому для того, чтобы измерение имело смысл, должна быть известна длина волны, на которой оно было выполнено.
Молярный круговой дихроизм
[ редактировать ]Это также можно выразить, применив закон Бера , как:
где
- и – молярные коэффициенты экстинкции света LCP и RCP,
- молярная концентрация ,
- — длина пути в сантиметрах (см).
Затем
– молярный круговой дихроизм. Это внутреннее свойство обычно подразумевается под круговым дихроизмом вещества. С является функцией длины волны, значением молярного кругового дихроизма ( ) должен указывать длину волны, на которой он действителен.
Внешние воздействия на круговой дихроизм
[ редактировать ]Во многих практических применениях кругового дихроизма (КД), как обсуждается ниже, измеренная КД является не просто внутренним свойством молекулы, а, скорее, зависит от молекулярной конформации. В таком случае CD также может быть функцией температуры, концентрации и химической среды, включая растворители. В этом случае сообщаемое значение CD должно также указывать эти другие важные факторы, чтобы быть значимым.
В упорядоченных структурах, лишенных двойной вращательной симметрии, оптическая активность [8] [9] включая дифференциальную передачу [10] (и отражение [11] ) волн круговой поляризации зависит также от направления распространения через материал. В этом случае так называемая внешняя 3d-хиральность связана с взаимной ориентацией светового луча и структуры.
Молярная эллиптичность
[ редактировать ]Хотя обычно измеряется, по историческим причинам большинство измерений приводятся в градусах эллиптичности.Молярная эллиптичность представляет собой круговой дихроизм с поправкой на концентрацию. Молярный круговой дихроизм и молярная эллиптичность, , легко преобразуются уравнением:
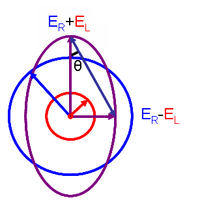
Это соотношение получается путем определения эллиптичности поляризации как:
где
- и – величины электрического поля векторов правоциркулярного и левоциркулярно поляризованного света соответственно.
Когда равно (когда нет разницы в поглощении света право- и левополяризованного света), равен 0° и свет линейно поляризован . Когда либо или равен нулю (при полном поглощении света круговой поляризации в одном направлении), Угол равен 45°, а свет имеет круговую поляризацию .
Обычно эффект кругового дихроизма невелик, поэтому мала и может быть аппроксимирована как в радианах . Поскольку интенсивность или освещенность , , света пропорциональна квадрату вектора электрического поля, эллиптичность становится:
Затем, заменив I, используя закон Бера в форме натурального логарифма :
Эллиптичность теперь можно записать как:
С , это выражение можно аппроксимировать, разложив экспоненты в ряд Тейлора до первого порядка, а затем отбросив члены в сравнении с единицей и переводом из радиан в градусы:
Линейная зависимость концентрации растворенного вещества и длины пути устраняется путем определения молярной эллиптичности как:
Тогда, объединив два последних выражения с законом Бера , молярная эллиптичность становится:
Исторически единицами молярной эллиптичности являются (град·см 2 /дмол). Для расчета молярной эллиптичности необходимо знать концентрацию образца (г/л), длину пути клетки (см) и молекулярную массу (г/моль).
Если образец представляет собой белок, вместо молекулярной массы часто используется средняя масса остатка (средняя молекулярная масса содержащихся в нем аминокислотных остатков), при этом белок рассматривается как раствор аминокислот. Использование средней эллиптичности остатков облегчает сравнение CD белков с разной молекулярной массой; использование этого нормализованного CD важно при изучении структуры белка.
Средняя эллиптичность остатка
[ редактировать ]Методы оценки вторичной структуры полимеров, в частности белков и полипептидов, часто требуют, чтобы измеренный спектр молярной эллиптичности был преобразован в нормализованное значение, в частности, значение, не зависящее от длины полимера. Для этой цели используется средняя эллиптичность остатка; это просто измеренная молярная эллиптичность молекулы, деленная на количество мономерных единиц (остатков) в молекуле.
Применение к биологическим молекулам
[ редактировать ]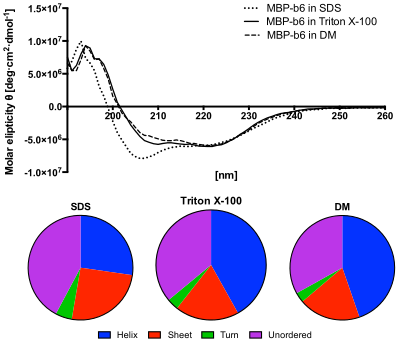
Нижняя панель: Содержание вторичных структур, предсказанное по спектрам КД с использованием алгоритма CDSSTR. Белок в растворе ДСН демонстрирует повышенное содержание неупорядоченных структур и пониженное содержание спиралей. [12]
В общем случае это явление будет проявляться в полосах поглощения любой оптически активной молекулы. Как следствие, биологические молекулы проявляют круговой дихроизм из-за их правовращающих и левовращающих компонентов. Еще более важно то, что вторичная структура также придает отчетливый CD соответствующим молекулам. Следовательно, альфа-спираль белков и двойная спираль нуклеиновых кислот имеют спектральные характеристики CD, представляющие их структуры. Способность CD давать репрезентативную структурную характеристику делает его мощным инструментом в современной биохимии, приложения которого можно найти практически во всех областях исследований.
CD тесно связан с методом оптической вращательной дисперсии (ORD) и обычно считается более продвинутым. CD измеряется в полосах поглощения интересующей молекулы или вблизи них, тогда как ORD может быть измерен вдали от этих полос. Преимущество компакт-диска очевидно при анализе данных. Структурные элементы различаются более четко, поскольку их записанные полосы не перекрываются сильно на определенных длинах волн, как это происходит в ORD. В принципе, эти два спектральных измерения могут быть взаимно преобразованы посредством интегрального преобразования ( соотношение Крамерса-Кронига ), если все поглощения включены в измерения.
Спектр КД белков в дальнем УФ ( ультрафиолетовом ) диапазоне может выявить важные характеристики их вторичной структуры . Спектры КД можно легко использовать для оценки доли молекулы, находящейся в конформации альфа-спирали , конформации бета-листа , конформации бета-поворота или какой-либо другой конформации (например, случайного клубка ). [13] [14] [15] [16] Эти дробные распределения накладывают важные ограничения на возможные вторичные конформации, в которых может находиться белок. CD, как правило, не может сказать, где обнаруженные альфа-спирали расположены внутри молекулы, или даже полностью предсказать, сколько их. Несмотря на это, CD является ценным инструментом, особенно для демонстрации изменений в телосложении. Его можно, например, использовать для изучения того, как вторичная структура молекулы изменяется в зависимости от температуры или концентрации денатурирующих агентов, например хлорида гуанидиния или мочевины . Таким образом, он может раскрыть важную термодинамическую информацию о молекуле (например, энтальпию и свободную Гиббса энергию денатурации ), которую иначе невозможно легко получить. Любой, кто попытается изучить белок, найдет CD ценным инструментом для проверки того, что белок находится в своей нативной конформации, прежде чем проводить с ним обширные и/или дорогостоящие эксперименты. Кроме того, существует ряд других применений спектроскопии КД в химии белков, не связанных с оценкой доли альфа-спирали. Кроме того, спектроскопия КД использовалась в исследованиях бионеорганических интерфейсов. В частности, его использовали для анализа различий во вторичной структуре сконструированного белка до и после титрования реагентом. [17]
Спектр КД в ближней УФ-области (>250 нм) белков дает информацию о третичной структуре . Сигналы, полученные в области 250–300 нм, обусловлены поглощением, дипольной ориентацией и природой окружающего окружения аминокислот фенилаланина, тирозина, цистеина (или мостиков SS ) и триптофана дисульфидных . В отличие от КД в дальнем УФ-диапазоне, спектр КД в ближнем УФ-диапазоне нельзя отнести к какой-либо конкретной трехмерной структуре. Скорее, спектры КД в ближнем УФ-диапазоне предоставляют структурную информацию о природе простетических групп в белках, например, гем-групп в гемоглобине и цитохроме с .
Видимая КД-спектроскопия является очень мощным методом изучения взаимодействий металл-белок и может разрешать отдельные электронные dd-переходы как отдельные полосы. Спектры КД в видимой области света возникают только тогда, когда ион металла находится в хиральном окружении, поэтому свободные ионы металлов в растворе не обнаруживаются. Преимущество этого метода состоит в том, что он позволяет наблюдать только металл, связанный с белком, поэтому легко получить зависимость от pH и стехиометрию. Оптическая активность в комплексах ионов переходных металлов объясняется конфигурационными, конформационными и вицинальными эффектами. Клевпатинонд и Вайлс (2007) разработали набор эмпирических правил для прогнозирования появления видимых спектров КД для Cu. 2+ и Ни 2+ плоскоквадратные комплексы, включающие координацию гистидина и основной цепи.
КД дает менее конкретную структурную информацию, чем рентгеновская кристаллография и ЯМР-спектроскопия белков , например, , которые оба дают данные об атомном разрешении. Однако КД-спектроскопия — быстрый метод, не требующий больших количеств белков или обширной обработки данных. Таким образом, CD можно использовать для исследования большого количества условий растворителя , варьирующейся температуры , pH , солености и присутствия различных кофакторов.
КД- спектроскопия обычно используется для изучения белков в растворе и, таким образом, дополняет методы исследования твердого состояния. Это также является ограничением, поскольку многие белки встроены в мембраны в нативном состоянии, а растворы, содержащие мембранные структуры, часто сильно рассеиваются. CD иногда измеряют в тонких пленках.
КД Спектроскопия также проводилась с использованием полупроводниковых материалов, таких как TiO 2 , для получения сильных сигналов в УФ-диапазоне длин волн, где часто происходят электронные переходы биомолекул. [18]
Экспериментальные ограничения
[ редактировать ]Эта статья нуждается в дополнительных цитатах для проверки . ( март 2010 г. ) |
КД также изучался в углеводах , но с ограниченным успехом из-за экспериментальных трудностей, связанных с измерением спектров КД в вакуумной ультрафиолетовой (ВУФ) области спектра (100–200 нм), где лежат соответствующие полосы КД незамещенных углеводов. . Замещенные углеводы с полосами выше ВУФ-области были успешно измерены.
Измерение CD также осложняется тем фактом, что типичные водные буферные системы часто поглощают в диапазоне, в котором структурные особенности демонстрируют дифференциальное поглощение циркулярно поляризованного света. Фосфатный , сульфатный , карбонатный и ацетатный буферы обычно несовместимы с ЦД, если они не сильно разбавлены, например, в диапазоне 10–50 мМ. Буферную систему TRIS следует полностью избегать при выполнении CD в дальнем УФ-диапазоне. бората и Соединения ония часто используются для установления подходящего диапазона pH для экспериментов по КД. Некоторые экспериментаторы заменили ион хлорида фторидом, поскольку фторид меньше поглощает в дальнем УФ-диапазоне, а некоторые работали в чистой воде. Другой, почти универсальный метод заключается в минимизации поглощения растворителя за счет использования ячеек с более короткой длиной пути при работе в дальнем УФ-диапазоне, длина пути 0,1 мм не является редкостью в этой работе.
Помимо измерений в водных системах, КД, особенно в дальней УФ-области спектра, можно измерять в органических растворителях, например, этаноле, метаноле, трифторэтаноле (ТФЭ). Последний имеет то преимущество, что индуцирует структурообразование белков, индуцируя бета-листы в одних и альфа-спирали в других, чего они не проявляют в нормальных водных условиях. Однако наиболее распространенные органические растворители, такие как ацетонитрил , ТГФ , хлороформ , дихлорметан , несовместимы с КД в дальнем УФ-диапазоне.
Может быть интересно отметить, что спектры CD белка, используемые при оценке вторичной структуры, связаны с орбитальным поглощением от π до π* амидных связей, связывающих аминокислоты. Эти полосы поглощения частично лежат в так называемом вакуумном ультрафиолете (длины волн менее 200 нм). Интересующая область длин волн фактически недоступна в воздухе из-за сильного поглощения света кислородом на этих длинах волн. На практике эти спектры измеряются не в вакууме, а в бескислородном приборе (заполненном чистым газообразным азотом).
После устранения кислорода, возможно, вторым наиболее важным техническим фактором при работе на длинах волн ниже 200 нм является проектирование остальной части оптической системы с низкими потерями в этой области. Важным в этом отношении является использование алюминизированных зеркал , покрытия которых оптимизированы для снижения потерь в этой области спектра.
Обычным источником света в этих приборах является ксеноновая лампа высокого давления с короткой дугой . Обычные ксеноновые дуговые лампы непригодны для использования в условиях слабого ультрафиолета. специально сконструированные лампы с колбой из синтетического кварца Вместо этого необходимо использовать высокой чистоты.
Свет синхротронных источников имеет гораздо более высокий поток на коротких длинах волн и используется для записи компакт-диска с длиной волны до 160 нм. В 2010 году спектрофотометр КД на установке накопителя электронов ISA в Орхусском университете в Дании использовался для регистрации твердотельных спектров КД до 120 нм. [19] На квантовомеханическом уровне плотности признаков кругового дихроизма и оптического вращения идентичны. Оптическая вращающаяся дисперсия и круговой дихроизм имеют один и тот же квантовый информационный контент.
См. также
[ редактировать ]- Спиновая селективность, индуцированная киральностью
- Оптическая активность гиперрэлеевского рассеяния
- Линейный дихроизм
- Магнитный круговой дихроизм
- Оптическая активность
- Оптическая изомерия
- Оптическое вращение
- Оптическая вращательная дисперсия
- Банк данных по круговому дихроизму белков
- Спектроскопия кругового дихроизма синхротронного излучения
- Двухфотонный круговой дихроизм
- Колебательный круговой дихроизм
Ссылки
[ редактировать ]- ^ П. Аткинс; Ж. де Паула (2005). Элементы физической химии (4-е изд.). Издательство Оксфордского университета . ISBN 978-0-7167-7329-0 .
- ^ Перейти обратно: а б с Эдвард И. Соломон; ABP Lever (3 февраля 2006 г.). Неорганическая электронная структура и спектроскопия . Уайли-Интерсайенс . п. 78. ИСБН 978-0-471-97124-5 . Проверено 29 апреля 2011 г.
- ^ Введение в квантовую теорию 2ED Дэвид Парк, раздел 2.2, стр. 32 «... поляризация луча света - это точно такая же вещь, как вращение луча электронов, различия в терминологии отражают только случайности исторического порядка. открытия».
- ^ Джеральд Д. Фасман (1996). Круговой дихроизм и конформационный анализ биомолекул . Спрингер. стр. 3–. ISBN 978-0-306-45142-3 . Проверено 29 апреля 2011 г.
- ^ Перейти обратно: а б с Кодзи Наканиси; Нина Берова ; Роберт Вуди (1994). Круговой дихроизм: принципы и приложения . ВЧ. п. 473. ИСБН 978-1-56081-618-8 . Проверено 29 апреля 2011 г.
- ^ Соломон, Нейдиг; А. Т. Векслер; Г. Шенк; Т. Р. Холман (2007). «Кинетические и спектроскопические исследования липоксигеназы N694C: исследование механизма активации субстрата негемового фермента железа» . Дж. Ам. хим. Соц . 129 (24): 7531–7537. дои : 10.1021/ja068503d . ПМК 2896304 . ПМИД 17523638 .
- ^ Элисон Роджер; Бенгт Норден (1997). Круговой дихроизм и линейный дихроизм . Издательство Оксфордского университета. ISBN 978-0-19-855897-2 . Проверено 29 апреля 2011 г.
- ^ Р. Уильямс (1968). «Эффект оптического вращения в нематической жидкой фазе п-азоксианизола». Письма о физических отзывах . 21 (6): 342. Бибкод : 1968PhRvL..21..342W . дои : 10.1103/PhysRevLett.21.342 .
- ^ Р. Уильямс (1969). «Оптико-вращательная сила и линейный электрооптический эффект в нематических жидких кристаллах п-азоксианизола». Журнал химической физики . 50 (3): 1324. Бибкод : 1969JChPh..50.1324W . дои : 10.1063/1.1671194 .
- ^ Слива, Э.; Федотов В.А.; Желудев Н.И. (2008). «Оптическая активность во внешне хиральном метаматериале» (PDF) . Письма по прикладной физике . 93 (19): 191911. arXiv : 0807.0523 . Бибкод : 2008ApPhL..93s1911P . дои : 10.1063/1.3021082 . S2CID 117891131 .
- ^ Слива, Э.; Федотов В.А.; Желудев Н.И. (2016). «Зеркальная оптическая активность ахиральных метаповерхностей» (PDF) . Письма по прикладной физике . 108 (14): 141905. Бибкод : 2016ApPhL.108n1905P . дои : 10.1063/1.4944775 . hdl : 10220/40854 .
- ^ Сурма М.А.; Щепаньяк А.; Круличевски Ю. (2014). «Сравнительные исследования восстановления апоцитохрома b6 с помощью детергентов в липосомальные бислои под контролем инструментов Zetasizer» . ПЛОС ОДИН . 9 (11): e111341. Бибкод : 2014PLoSO...9k1341S . дои : 10.1371/journal.pone.0111341 . ISSN 1932-6203 . ПМК 4244035 . ПМИД 25423011 .
- ^ Зал V, Нэш А., Роджер А. (2014). «SSNN, метод подбора вторичной структуры белка нейронной сети с использованием данных кругового дихроизма» (PDF) . Аналитические методы . 6 (17): 6721–26. дои : 10.1039/C3AY41831F . Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Холл V, Нэш А., Хайнс Э., Роджер А. (2013). «Выявление вторичной структуры белка с круговым дихроизмом и нейронной сетью». Журнал вычислительной химии . 34 (32): 2774–86. дои : 10.1002/jcc.23456 . ПМИД 24122928 . S2CID 19685126 .
- ^ Уитмор Л., Уоллес Б.А. (2008). «Анализ вторичной структуры белков с помощью спектроскопии кругового дихроизма: методы и справочные базы данных». Биополимеры . 89 (5): 392–400. дои : 10.1002/bip.20853 . ПМИД 17896349 .
- ^ Гринфилд, Нью-Джерси (2006). «Использование спектров кругового дихроизма для оценки вторичной структуры белка» . Протоколы природы . 1 (6): 2876–90. дои : 10.1038/нпрот.2006.202 . ПМЦ 2728378 . ПМИД 17406547 .
- ^ Биоинорганический интерфейс: механистические исследования белково-направленного синтеза наноматериалов. (2016, 5 мая). Получено 1 марта 2019 г. с https://pubs.acs.org/doi/pdf/10.1021/acs.jpcc.6b02569 .
- ^ Саркар, Сумант, Райан Бехунин и Джон Г. Гиббс. «Зависимый от формы хирооптический отклик УФ-активных наноспиральных метаматериалов». Нанобуквы (2019). https://pubs.acs.org/doi/10.1021/acs.nanolett.9b03274
- ^ У. Мейеренрих; Джей Джей Филиппи; Дж. Мейнерт; Дж. Х. Бредехофт; Дж. Такахаши; Л. Нахон; Н. К. Джонс; С.В. Хоффманн (2010). «Круговой дихроизм аминокислот в области вакуума и ультрафиолета» . Энджью. хим. Намекать. Эд . 49 (42): 7799–7802. дои : 10.1002/anie.201003877 . ПМИД 20845349 . [ постоянная мертвая ссылка ]
Внешние ссылки
[ редактировать ]- Спектроскопия кругового дихроизма от Alliance Protein Laboratories, коммерческого поставщика услуг.
- Введение в спектроскопию кругового дихроизма от Applied Photophysicals, поставщика оборудования
- Анимированное пошаговое руководство по круговому дихроизму и оптическому вращению от профессора Валева.























![{\displaystyle [\theta ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1456b03b038385e3bc52344dbf1a9bfbc41b4cf)
![{\displaystyle [\theta ]=3298,2\,\Delta \varepsilon .\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c66e42a40570e3d3cb312c0eadd95d59170dc258)











![{\displaystyle [\theta ]={\frac {100\theta }{Cl}}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec21d26e0b12e81313ef0b42bbb5ec4f63369c3d)
![{\displaystyle [\theta ]=100\,\Delta \varepsilon \left({\frac {\ln 10}{4}}\right)\left({\frac {180}{\pi }}\right) =3298.2\,\Дельта \varepsilon \,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88756c2cb3877d28ff0932ef432b0a5e4861ab58)