Основные белки мочи

Основные белки мочи ( Mups ), также известные как α 2 u-глобулины , представляют собой подсемейство белков, которые в изобилии обнаруживаются в моче и других выделениях многих животных. Mups предоставляют небольшой диапазон идентификационной информации о животном-доноре при обнаружении сошниково-носовым органом принимающего животного. Они принадлежат к более широкому семейству белков, известных как липокалины . Mups кодируются кластером генов , расположенных рядом друг с другом на одном участке ДНК, число которых сильно различается у разных видов: от по крайней мере 21 функционального гена у мышей до ни одного у человека. Белки Mup образуют характерную форму перчатки , включающую лиганд -связывающий карман, в котором размещаются определенные небольшие органические химические вещества.
Белки мочи были впервые обнаружены у грызунов в 1932 году во время исследований Томасом Аддисом причин протеинурии . Они являются сильными аллергенами человека и в значительной степени ответственны за ряд аллергий на животных , в том числе на кошек, лошадей и грызунов. Их эндогенная функция у животного неизвестна, но может включать регулирование расхода энергии. Однако в качестве секретируемых белков они играют множество ролей в химической коммуникации между животными, выступая в качестве переносчиков и стабилизаторов феромонов у грызунов и свиней. Mups также могут сами действовать как белковые феромоны. Было продемонстрировано, что они способствуют агрессии у самцов мышей, а один специфический белок Mup, обнаруженный в моче самцов мышей, сексуально привлекателен для самок мышей. Mups также могут служить сигналами между различными видами : мыши демонстрируют инстинктивную реакцию страха при обнаружении Mups, полученного от хищников, таких как кошки и крысы.
Открытие
[ редактировать ]
Здоровые люди выделяют мочу, которая в основном не содержит белка. Поэтому с 1827 года врачей и ученых заинтересовала протеинурия — избыток белка в моче человека, как показатель заболевания почек . [примечания 1] [2] Чтобы лучше понять этиологию протеинурии, некоторые ученые попытались изучить это явление на лабораторных животных . [3] Между 1932 и 1933 годами ряд учёных, в том числе Томас Аддис , независимо друг от друга сообщили об удивительном открытии: у некоторых здоровых грызунов в моче содержится белок. [4] [5] [6] Однако только в 1960-х годах основные белки мочи мышей и крыс были впервые подробно описаны. [7] [8] Было обнаружено, что белки в основном вырабатываются в печени мужчин и выделяются через почки в мочу в больших количествах (миллиграммы в день). [7] [8] [9]
С тех пор, как они были названы, было обнаружено, что белки по-разному экспрессируются в других железах , которые выделяют продукты непосредственно во внешнюю среду. К ним относятся слезные , околоушные , подчелюстные , подъязычные , препуциальные и молочные железы. [10] [11] [12] У некоторых видов, таких как кошки и свиньи, Mups вообще не экспрессируются в моче и в основном обнаруживаются в слюне. [13] [14] Иногда термин Mups в моче (uMups) используется, чтобы отличить те Mups, которые экспрессируются в моче, от тех, которые находятся в других тканях. [15]
Mup-гены
[ редактировать ]В период с 1979 по 1981 год было подсчитано, что Mups кодируются семейством генов , состоящим из 15–35 генов и псевдогенов у мышей и примерно 20 генов у крыс. [16] [17] [18] В 2008 году более точное количество генов Mup у ряда видов было определено путем анализа последовательности ДНК целых геномов . [1] [19]
Грызуны
[ редактировать ]
мыши Эталонный геном имеет по меньшей мере 21 отдельный ген Mup (с открытыми рамками считывания ) и еще 21 псевдоген Mup (с рамками считывания, нарушенными бессмысленной мутацией или неполной дупликацией гена ). Все они сгруппированы вместе, расположены бок о бок на 1,92 мегабазах ДНК на хромосоме 4. 21 функциональный ген был разделен на два подкласса в зависимости от положения и сходства последовательностей: 6 периферических Mups класса A и 15 центральных Mups класса B. [1] [20] Центральный кластер генов Mup класса B сформировался в результате ряда последовательных дупликаций одного из Mup класса A. Поскольку все гены класса B практически идентичны друг другу, исследователи пришли к выводу, что эти дупликации произошли совсем недавно в эволюции мышей. Действительно, повторяющаяся структура этих центральных генов Mup означает, что они, вероятно, нестабильны и их количество может различаться среди диких мышей. [20] Мупы класса А больше отличаются друг от друга и поэтому, вероятно, представляют собой более стабильные и старые гены, но какие функциональные различия есть у этих классов, неизвестно. [1] Сходство между генами затрудняет изучение этой области с использованием современной технологии секвенирования ДНК . Следовательно, кластер генов Mup является одной из немногих частей всей последовательности генома мыши , в которой остаются пробелы, и дальнейшие гены могут остаться необнаруженными. [1] [20]
Крысиная моча также содержит гомологичные белки мочи; хотя первоначально им дали другое название — α2 u - глобулины , [8] [9] с тех пор они стали известны как крысиные Мупы. [21] [22] У крыс есть 9 различных генов Mup и еще 13 псевдогенов, сгруппированных вместе на 1,1 мегабазах ДНК на хромосоме 5. Как и у мышей, кластер формируется путем множественных дупликаций. Однако это произошло независимо от дупликаций у мышей, а это означает, что оба вида грызунов расширили свои семейства генов Mup отдельно, но параллельно . [1] [23]
Негрызуны
[ редактировать ]Большинство других изученных млекопитающих, в том числе свиньи, коровы, кошки, собаки, кустарники, макаки, шимпанзе и орангутанги, имеют один ген Mup. У некоторых, однако, их число расширено: у лошадей есть три гена Mup, а у серых мышиных лемуров — как минимум два. Насекомые, рыбы, земноводные, птицы и сумчатые , по-видимому, нарушили синтению в хромосомном положении кластера генов Mup, что позволяет предположить, что это семейство генов может быть специфичным для плацентарных млекопитающих. [1] Люди - единственные плацентарные млекопитающие , у которых нет активных генов Mup; вместо этого у них есть единственный псевдоген Mup, содержащий мутацию, которая вызывает неправильное сплайсинг , что делает его дисфункциональным. [1]
Функция
[ редактировать ]Транспортные белки
[ редактировать ]
Mups являются членами большого семейства низкомолекулярных ( ~19 кДа ) белков, известных как липокалины . [25] Они имеют характерную структуру из восьми бета-листов, расположенных в антипараллельном бета-цилиндре, открытом с одной стороны, с альфа-спиралями на обоих концах. [25] Следовательно, они образуют характерную форму перчаток, заключающую в себе чашеобразный карман , который связывает небольшие органические химические вещества с высоким сродством. [1] [26] Ряд этих лигандов связываются с мышиными Mups, включая 2-втор-бутил-4,5-дигидротиазол ( сокращенно SBT или DHT), 6-гидрокси-6-метил-3- гептанон (HMH) и 2,3-дигидротиазол. -экзо-бревикомин (DHB). [27] [28] [29] Все это химические вещества, специфичные для мочи, которые, как было показано, действуют как феромоны — молекулярные сигналы, выделяемые одним человеком, которые вызывают врожденную поведенческую реакцию у другого представителя того же вида. [27] [30] Было также показано, что Mouse Mups действуют как стабилизаторы феромонов, обеспечивая механизм медленного высвобождения, который увеличивает эффективность летучих феромонов в запахах мужской мочи . [31] Учитывая разнообразие Mups у грызунов, первоначально считалось, что разные Mups могут иметь связывающие карманы разной формы и, следовательно, связывать разные феромоны. Однако детальные исследования показали, что большинство вариабельных сайтов расположены на поверхности белков и, по-видимому, мало влияют на связывание лигандов. [32]
Крысиные Mups связывают различные мелкие химические вещества. Наиболее распространенным лигандом является 1-хлордекан , менее заметными являются 2-метил-N-фенил- 2-пропенамид , гексадекан и 2,6,11-триметилдекан. [33] Крысиные Mups также связывают лимонен -1,2-эпоксид, что приводит к заболеванию почек хозяина — гиалиново -капельной нефропатии , которая прогрессирует в рак. У других видов это заболевание не развивается, поскольку их Mups не связывают это конкретное химическое вещество. [34] Соответственно, когда трансгенных мышей создали для экспрессии крысиного Mup, в их почках развилось заболевание. [35] Обнаруженный у свиней Mup, названный слюнным липокалин (SAL), экспрессируется в слюнной железе самцов, где он прочно связывает андростенон и андростенол , оба феромона, которые заставляют самок свиней принимать брачную позицию . [1] [14]
Исследования изотермической титровальной калориметрии , проведенные с Mups и связанными с ними лигандами (пиразины, [36] [37] спирты, [38] [39] тиазолины, [40] [28] 6-гидрокси-6-метил-3-гептанон, [41] и N-фенилнатиламин, [42] [43] ) выявил необычный феномен связывания. счет энтальпийных Было обнаружено, что активный центр недостаточно гидратирован, в результате чего связывание лиганда осуществляется за дисперсионных сил . Это противоречит большинству других белков, которые проявляют энтропийные силы связывания в результате реорганизации молекул воды . Этот необычный процесс получил название неклассического гидрофобного эффекта . [43]
Феромоны
[ редактировать ]
Исследования были направлены на определение точной функции Mups в передаче феромонов. Было показано, что белки Mup способствуют половому созреванию и ускоряют цикл течки у самок мышей, вызывая эффекты Ванденберга и Уиттена . [38] [44] Однако в обоих случаях Mups пришлось давать самке растворенным в мужской моче, что указывает на то, что для функционирования белка требуется некоторый мочевой контекст. В 2007 году Mups, обычно обнаруживаемые в моче самцов мышей, были созданы из трансгенных бактерий и, следовательно, лишены химических веществ, которые они обычно связывают. Было показано, что этих Mups достаточно, чтобы способствовать агрессивному поведению самцов даже при отсутствии мочи. [19] Кроме того, было обнаружено, что Mups, вырабатываемые бактериями, активируют обонятельные сенсорные нейроны в сошниково-носовом органе (VNO), подсистеме носа, которая, как известно, обнаруживает феромоны через специфические сенсорные рецепторы мышей и крыс. [19] [45] В совокупности это продемонстрировало, что белки Mup могут сами действовать как феромоны, независимо от их лигандов. [46]

В соответствии с ролью в агрессии между самцами взрослые мыши-самцы выделяют в мочу значительно больше Mups, чем самки, молодые особи или кастрированные самцы мышей. Точный механизм, лежащий в основе этой разницы между полами , сложен, но известно, что по крайней мере три гормона — тестостерон , гормон роста и тироксин — положительно влияют на выработку Mups у мышей. [47] Моча диких домашних мышей содержит различные комбинации от четырех до семи различных белков Mup на мышь. [48] Некоторые инбредные линии лабораторных мышей , такие как BALB/c и C57BL/6 , также имеют разные белки, экспрессируемые в моче. [20] Однако, в отличие от диких мышей, разные особи одной и той же линии экспрессируют один и тот же образец белка, что является результатом многих поколений инбридинга . [49] [50] Один необычный Mup менее изменчив, чем другие: он постоянно продуцируется большим количеством диких мышей-самцов и почти никогда не обнаруживается в моче самок. Когда этот Mup был создан из бактерий и использован в поведенческих тестах, было обнаружено, что он привлекает самок мышей. Другие Mup были протестированы, но не обладали такими же привлекательными качествами, что позволяет предположить, что Mup, специфичный для мужчин, действует как половой феромон. [51] Ученые назвали этот Муп- дарсин ( Mup20 , Q5FW60 ) как юмористическую отсылку к Фицуильяму Дарси , романтическому герою из «Гордости и предубеждения» . [52] [53] В совокупности сложные образцы полученных Mups потенциально могут предоставить разнообразную информацию о животном-доноре, такую как пол , плодовитость, социальное доминирование , возраст, генетическое разнообразие или родство . [19] [54] [55] Дикие мыши (в отличие от лабораторных мышей, которые генетически идентичны и, следовательно, также имеют идентичные образцы Mups в моче) имеют индивидуальные образцы экспрессии Mup в моче, которые действуют как « штрих-код », позволяющий однозначно идентифицировать владельца запаховой метки. [54]
У домовой мыши основной кластер генов MUP обеспечивает высокополиморфный запаховой сигнал генетической идентичности. Дикие мыши, свободно размножающиеся в полуестественных вольерах, избегали инбридинга . Это избегание было результатом сильного дефицита успешных спариваний между мышами, имеющими оба гаплотипа MUP (полное совпадение). [56] В другом исследовании с использованием белоногих мышей было обнаружено, что когда мыши, полученные из диких популяций, были инбредными, выживаемость снижалась, когда таких мышей повторно вводили в естественную среду обитания. [57] Эти данные свидетельствуют о том, что инбридинг снижает приспособленность и что распознавание запаховых сигналов развилось у мышей как средство предотвращения инбридинговой депрессии .
Кайромонес
[ редактировать ]Помимо того, что Mups служат социальными сигналами между представителями одного и того же вида, они могут действовать как кайромоны — химические сигналы, которые передают информацию между видами. [58] [59] [60] Мыши инстинктивно боятся запаха своих естественных хищников , включая кошек и крыс. Это происходит даже у лабораторных мышей, которые были изолированы от хищников на протяжении сотен поколений. [61] Когда химические сигналы, ответственные за реакцию страха , были очищены из кошачьей слюны и крысиной мочи, были идентифицированы два гомологичных белковых сигнала: Fel d 4 ( Felis Domesticus аллерген 4; Q5VFH6 ), продукт кошачьего гена Mup , и Rat n 1 ( Rattus norvegicus Аллерген 1 P02761 ), продукт крысиного гена Mup13 ; [59] Мыши боятся этих Mups, даже если они производятся бактериями, но животные-мутанты, которые не способны обнаружить Mups, не проявляют страха перед крысами, демонстрируя их важность в инициировании пугливого поведения. [58] [62] Точно неизвестно, как Mups разных видов инициируют разное поведение, но было показано, что Mups мышей и Mups хищников активируют уникальные паттерны сенсорных нейронов в носу мышей-реципиентов. Это означает, что мышь воспринимает их по-разному, через разные нейронные цепи . [58] [59] Рецепторы феромонов, ответственные за обнаружение Mup, также неизвестны, хотя считается, что они относятся к классу рецепторов V2R . [19] [59]
Аллергены
[ редактировать ]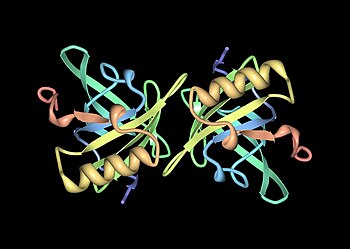
Наряду с другими членами семейства белков липокалинов, основные белки мочи могут быть сильными аллергенами для человека. [64] Причина этого неизвестна; однако молекулярная мимикрия между Mups и структурно сходными человеческими липокалинами. в качестве возможного объяснения была предложена [65] Белковый продукт мышиных генов Mup6 и Mup2 (ранее ошибочно принятый за Mup17 из-за сходства мышиных MUP), известный как Mus m 1, Ag1 или MA1, [66] объясняет большую часть аллергенных свойств мышиной мочи. [1] [67] Белок чрезвычайно стабилен в окружающей среде; исследования показали, что 95% домов в центре города и 82% всех типов домов в Соединенных Штатах имеют обнаруживаемые уровни по крайней мере в одной комнате. [68] [69] Аналогичным образом, Rat n 1 является известным человеческим аллергеном. [64] Исследование, проведенное в США, показало его присутствие в 33% домов в центре города, а 21% жителей были сенсибилизированы к аллергену. [70] Воздействие и сенсибилизация к белкам Mup грызунов считается фактором риска развития астмы у детей и является основной причиной аллергии на лабораторных животных (ЛАА) — профессионального заболевания лабораторий, работающих с животными, и ученых. [71] [72] [73] [74] Одно исследование показало, что две трети лабораторных работников, у которых развилась астматическая реакция на животных, имели антитела к крысе № 1. [75]
Гены Mup других млекопитающих также кодируют аллергенные белки, например, Fel d 4 в основном вырабатывается в подчелюстной слюнной железе и откладывается на перхоти , когда кошка ухаживает за собой. Исследование показало, что 63% людей с аллергией на кошек имеют антитела против этого белка. У большинства из них были более высокие титры антител против Fel d 4, чем против Fel d 1 , еще одного известного кошачьего аллергена. [13] Аналогичным образом, Equ c 1 ( аллерген 1 Equus caballus ; Q95182 ) представляет собой белковый продукт гена Mup лошади , который обнаруживается в печени, подъязычных и подчелюстных слюнных железах. [1] [76] Он отвечает за около 80% реакции антител у пациентов, хронически подвергающихся воздействию аллергенов лошадей. [76]
Метаболизм
[ редактировать ]Хотя обнаружение Mups, выделяемого другими животными, хорошо изучено, функциональная роль у животных-производителей менее ясна. Однако в 2009 году было показано, что Mups связан с регуляцией расхода энергии у мышей. Ученые обнаружили, что мыши с генетически вызванным ожирением и диабетом производят в тридцать раз меньше РНК Mup , чем их худые братья и сестры. [77] Когда они доставили белок Mup непосредственно в кровоток этих мышей, они наблюдали увеличение расхода энергии, физической активности и температуры тела и соответствующее снижение непереносимости глюкозы и резистентности к инсулину . Они предполагают, что благотворное влияние Mups на энергетический обмен происходит за счет улучшения функции митохондрий в скелетных мышцах. [77] Другое исследование показало, что количество Mups уменьшилось у мышей с ожирением, вызванным диетой. В этом случае присутствие Mups в кровотоке мышей ограничивало выработку глюкозы путем прямого ингибирования экспрессии генов в печени. [78]
См. также
[ редактировать ]- Цис-вакценилацетат , феромон, вызывающий агрессию насекомых.
- Главный комплекс гистосовместимости , пептиды также участвуют в индивидуальном распознавании у мышей.
- Белки, вырабатываемые и секретируемые печенью
Примечания
[ редактировать ]- ↑ В том же году Ричард Брайт впервые связал болезнь почек, позже ставшую известной как болезнь Брайта , с белковой мочой.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л Логан Д.В., Мартон Т.Ф., Стоуэрс Л. (сентябрь 2008 г.). «Видовая специфичность основных белков мочи путем параллельной эволюции» . ПЛОС ОДИН . 3 (9): е3280. Бибкод : 2008PLoSO...3.3280L . дои : 10.1371/journal.pone.0003280 . ПМЦ 2533699 . ПМИД 18815613 .
- ^ Comper WD, Хиллиард LM, Николич-Патерсон DJ, Руссо LM (декабрь 2008 г.). «Болезнезависимые механизмы альбуминурии». Американский журнал физиологии. Почечная физиология . 295 (6): Ф1589-600. дои : 10.1152/ajprenal.00142.2008 . ПМИД 18579704 .
- ^ Лемли К.В., Полинг Л. (1994). «Томас Аддис: 1881–1949» . Биографические мемуары Национальной академии наук . 63 : 1–46.
- ^ Аддис Т. (1932). «Протеинурия и цилиндрурия». Труды Калифорнийской академии наук . 2 : 38–52.
- ^ Белл М.Э. (сентябрь 1933 г.). «Альбуминурия у нормального самца крысы» . Журнал физиологии . 79 (2): 191–3. дои : 10.1113/jphysicalol.1933.sp003040 . ПМЦ 1394952 . ПМИД 16994453 .
- ^ Парфентьев И.А., Перльцвейг В.А. (1933). «Состав мочи белых мышей» . Журнал биологической химии . 100 (2): 551–55. дои : 10.1016/S0021-9258(18)75972-3 .
- ^ Jump up to: а б Финлейсон Дж. С., Асофски Р., Поттер М., Бегун CC (август 1965 г.). «Основной белковый комплекс мочи нормальных мышей: происхождение». Наука . 149 (3687): 981–2. Бибкод : 1965Sci...149..981F . дои : 10.1126/science.149.3687.981 . ПМИД 5827345 . S2CID 23007588 .
- ^ Jump up to: а б с Рой А.К., Нойхаус О.В. (март 1966 г.). «Идентификация белков мочи крыс методом зонального и иммуноэлектрофореза». Труды Общества экспериментальной биологии и медицины . 121 (3): 894–9. дои : 10.3181/00379727-121-30917 . ПМИД 4160706 . S2CID 41096617 .
- ^ Jump up to: а б Рой А.К., Нойхаус О.В. (сентябрь 1966 г.). «Доказательство печеночного синтеза белка, зависящего от пола, у крыс». Biochimica et Biophysical Acta (BBA) – Общие предметы . 127 (1): 82–7. дои : 10.1016/0304-4165(66)90478-8 . PMID 4165835 .
- ^ Проведено Вашингтоном, Галлахером Дж. Ф. (апрель 1985 г.). «Экспрессия мРНК альфа-2u-глобулина крысы в препуциальной железе». Биохимическая генетика . 23 (3–4): 281–90. дои : 10.1007/BF00504325 . ПМИД 2409959 . S2CID 25646065 .
- ^ Губитс Р.М., Линч К.Р., Кулкарни А.Б., Долан К.П., Гресик Э.В., Холландер П. и др. (октябрь 1984 г.). «Дифференциальная регуляция экспрессии гена альфа-2у-глобулина в печени, слезной железе и слюнной железе» . Журнал биологической химии . 259 (20): 12803–9. дои : 10.1016/S0021-9258(18)90817-3 . ПМИД 6208189 .
- ^ Шахан К., Денаро М., Гилмартин М., Ши Ю., Дерман Э. (май 1987 г.). «Экспрессия шести генов основных белков мочи мышей в молочных, околоушных, подъязычных, подчелюстных и слезных железах и в печени» . Молекулярная и клеточная биология . 7 (5): 1947–54. дои : 10.1128/MCB.7.5.1947 . ПМК 365300 . ПМИД 3600653 .
- ^ Jump up to: а б Смит В., Батлер А.Дж., Хэзелл Л.А., Чепмен М.Д., Помес А., Никелс Д.Г. и др. (ноябрь 2004 г.). «Fel d 4, аллерген кошачьего липокалина». Клиническая и экспериментальная аллергия . 34 (11): 1732–8. дои : 10.1111/j.1365-2222.2004.02090.x . ПМИД 15544598 . S2CID 20266013 .
- ^ Jump up to: а б Лебель Д., Скалони А., Паолини С., Фини С., Феррара Л., Брир Х. и др. (сентябрь 2000 г.). «Клонирование, посттрансляционные модификации, гетерологичная экспрессия и связывание лиганда липокалина слюны кабана» . Биохимический журнал . 350 Ч. 2 (Часть 2): 369–79. дои : 10.1042/0264-6021:3500369 . ПМЦ 1221263 . ПМИД 10947950 .
- ^ Бейнон Р.Дж., Херст Дж.Л. (февраль 2003 г.). «Множественные роли основных белков мочи у домашней мыши Mus Domesticus». Труды Биохимического общества . 31 (Часть 1): 142–6. дои : 10.1042/BST0310142 . ПМИД 12546672 .
- ^ Курц Д.Т. (1981). «Крысиный альфа-2u-глобулин кодируется мультигенным семейством». Журнал молекулярной и прикладной генетики . 1 (1): 29–38. ПМИД 6180115 .
- ^ Хасти Н.Д., Хелд В.А., Тул Дж.Дж. (июнь 1979 г.). «Множественные гены, кодирующие основные белки мочи мыши, регулируемые андрогенами». Клетка . 17 (2): 449–57. дои : 10.1016/0092-8674(79)90171-5 . ПМИД 88267 . S2CID 20636057 .
- ^ Епископ Дж.О., Кларк А.Дж., Клиссолд П.М., Хейни С., Франк У (1982). «Две основные группы генов основных белков мочи мыши, обе в основном расположены на хромосоме 4» . Журнал ЭМБО . 1 (5): 615–20. дои : 10.1002/j.1460-2075.1982.tb01217.x . ПМК 553096 . ПМИД 6329695 .
- ^ Jump up to: а б с д и Чамеро П., Мартон Т.Ф., Логан Д.В., Фланаган К., Круз Дж.Р., Сагателян А. и др. (декабрь 2007 г.). «Идентификация белковых феромонов, способствующих агрессивному поведению». Природа . 450 (7171): 899–902. Бибкод : 2007Natur.450..899C . дои : 10.1038/nature05997 . ПМИД 18064011 . S2CID 4398766 .
- ^ Jump up to: а б с д и Мадж Дж.М., Армстронг С.Д., Макларен К., Бейнон Р.Дж., Херст Дж.Л., Николсон С. и др. (2008). «Динамическая нестабильность семейства генов основного белка мочи, выявленная путем геномного и фенотипического сравнения мышей линий C57 и 129» . Геномная биология . 9 (5): Р91. дои : 10.1186/gb-2008-9-5-r91 . ПМЦ 2441477 . ПМИД 18507838 .
- ^ Херст Дж., Бейнон Р.Дж., Робертс С.К., Вятт Т.Д. (2007). Мочевые липокалины в Rodenta: существует ли универсальная модель? . Химические сигналы у позвоночных 11. Springer New York. ISBN 978-0-387-73944-1 .
- ^ Каваджиони А., Мучинья-Каретта С (октябрь 2000 г.). «Основные белки мочи, альфа (2U)-глобулины и афродизин». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1482 (1–2): 218–28. дои : 10.1016/S0167-4838(00)00149-7 . ПМИД 11058763 .
- ^ Макфадьен Д.А., Аддисон В., Локк Дж. (май 1999 г.). «Геномная организация кластера генов альфа-2u-глобулина крысы». Геном млекопитающих . 10 (5): 463–70. дои : 10.1007/s003359901024 . ПМИД 10337619 . S2CID 1121039 .
- ^ Бёкскей З., Грум Ч.Р., Флауэр Д.Р., Райт С.Э., Филлипс С.Е., Каваджиони А. и др. (ноябрь 1992 г.). «Связывание феромонов с двумя белками мочи грызунов, выявленное с помощью рентгеновской кристаллографии». Природа . 360 (6400): 186–8. Бибкод : 1992Natur.360..186B . дои : 10.1038/360186a0 . ПМИД 1279439 . S2CID 4362015 .
- ^ Jump up to: а б Цветочный ДР (август 1996 г.). «Семейство белков липокалинов: структура и функции» . Биохимический журнал . 318 (Часть 1) (1): 1–14. дои : 10.1042/bj3180001 . ПМЦ 1217580 . ПМИД 8761444 .
- ^ Ганфорнина, доктор медицинских наук, Гутьеррес Г., Бастиани М., Санчес Д. (январь 2000 г.). «Филогенетический анализ семейства белков липокалина» . Молекулярная биология и эволюция . 17 (1): 114–26. doi : 10.1093/oxfordjournals.molbev.a026224 . ПМИД 10666711 .
- ^ Jump up to: а б Хальперн М., Мартинес-Маркос А. (июнь 2003 г.). «Структура и функции вомероназальной системы: обновленная информация» (PDF) . Прогресс нейробиологии . 70 (3): 245–318. дои : 10.1016/S0301-0082(03)00103-5 . ПМИД 12951145 . S2CID 31122845 . Архивировано из оригинала (PDF) 7 ноября 2017 г.
- ^ Jump up to: а б Тимм Д.Э., Бейкер Л.Дж., Мюллер Х., Зидек Л., Новотный М.В. (май 2001 г.). «Структурная основа связывания феромона с основным белком мочи мыши (MUP-I)» . Белковая наука . 10 (5): 997–1004. дои : 10.1110/ps.52201 . ПМК 2374202 . ПМИД 11316880 .
- ^ Армстронг С.Д., Робертсон Д.Х., Читам С.А., Херст Дж.Л., Бейнон Р.Дж. (октябрь 2005 г.). «Структурные и функциональные различия в изоформах основных белков мочи мыши: специфичный для самцов белок, который преимущественно связывает мужской феромон» . Биохимический журнал . 391 (Часть 2): 343–50. дои : 10.1042/BJ20050404 . ПМЦ 1276933 . ПМИД 15934926 .
- ^ Стоуэрс Л., Мартон Т.Ф. (июнь 2005 г.). «Что такое феромон? Новый взгляд на феромоны млекопитающих» . Нейрон . 46 (5): 699–702. дои : 10.1016/j.neuron.2005.04.032 . ПМИД 15924856 . S2CID 9354126 .
- ^ Херст Дж.Л., Робертсон Д.Х., Толладей Ю., Бейнон Р.Дж. (май 1998 г.). «Белки в ароматических метках мочи самцов домовых мышей продлевают продолжительность жизни обонятельных сигналов». Поведение животных . 55 (5): 1289–97. дои : 10.1006/anbe.1997.0650 . ПМИД 9632512 . S2CID 9879771 .
- ^ Дарвиш Мари А., Веггерби С., Робертсон Д.Х., Гаскелл С.Дж., Хаббард С.Дж., Мартинсен Л. и др. (февраль 2001 г.). «Влияние полиморфизмов на связывание лигандов основными белками мочи мыши» . Белковая наука . 10 (2): 411–7. дои : 10.1110/ps.31701 . ПМК 2373947 . ПМИД 11266626 .
- ^ Раджкумар Р., Илаяраджа Р., Мучиннат С., Каваджиони А., Арчунан Дж. (август 2009 г.). «Идентификация альфа2у-глобулина и связанных летучих веществ у индийской обычной домашней крысы (Rattus rattus)». Индийский журнал биохимии и биофизики . 46 (4): 319–24. ПМИД 19788064 .
- ^ Леман-МакКиман Л.Д., Каудилл Д. (февраль 1992 г.). «Биохимическая основа устойчивости мышей к гиалиново-капельной нефропатии: отсутствие значимости суперсемейства белков альфа-2u-глобулина в этом синдроме, специфичном для самцов крыс». Токсикология и прикладная фармакология . 112 (2): 214–21. дои : 10.1016/0041-008X(92)90190-4 . ПМИД 1371614 .
- ^ Леман-МакКиман LD, Кодилл Д. (ноябрь 1994 г.). «D-лимонен индуцировал гиалиново-капельную нефропатию у трансгенных мышей с альфа-2u-глобулином». Фундаментальная и прикладная токсикология . 23 (4): 562–8. дои : 10.1006/faat.1994.1141 . ПМИД 7532604 .
- ^ Бингхэм Р.Дж., Финдли Дж.Б., Се С.Ю., Калверда А.П., Кьельберг А., Пераццоло С. и др. (февраль 2004 г.). «Термодинамика связывания 2-метокси-3-изопропилпиразина и 2-метокси-3-изобутилпиразина с основным белком мочи». Журнал Американского химического общества . 126 (6): 1675–81. дои : 10.1021/ja038461i . ПМИД 14871097 .
- ^ Барратт Э., Бингхэм Р.Дж., Warner DJ, Лотон, Калифорния, Филлипс С.Э., Хоманс С.В. (август 2005 г.). «Взаимодействия Ван-дер-Ваальса доминируют в ассоциации лиганд-белок в сайте связывания белка, закрытом от воды-растворителя». Журнал Американского химического общества . 127 (33): 11827–34. дои : 10.1021/ja0527525 . ПМИД 16104761 .
- ^ Jump up to: а б Мучинья-Каретта С, Каретта А, Каваджиони А (июль 1995 г.). «Ускорение наступления полового созревания у самок мышей белками мочи самцов» . Журнал физиологии . 486 (Часть 2) (Часть 2): 517–22. doi : 10.1113/jphysicalol.1995.sp020830 . ПМЦ 1156539 . ПМИД 7473215 .
- ^ Малхэм Р., Джонстон С., Бингхэм Р.Дж., Барратт Е., Филлипс С.Е., Лотон Калифорния и др. (декабрь 2005 г.). «Сильные дисперсионные взаимодействия растворенного вещества в комплексе белок-лиганд». Журнал Американского химического общества . 127 (48): 17061–7. дои : 10.1021/ja055454g . ПМИД 16316253 .
- ^ Шарроу С.Д., Новотный М.В., Стоун М.Дж. (май 2003 г.). «Термодинамический анализ связывания основного белка мочи-I мыши с феромоном 2-втор-бутил-4,5-дигидротиазолом». Биохимия . 42 (20): 6302–9. дои : 10.1021/bi026423q . ПМИД 12755635 .
- ^ Шарроу С.Д., Эдмондс К.А., Гудман М.А., Новотный М.В., Стоун М.Дж. (январь 2005 г.). «Термодинамические последствия разрушения сети водородных связей, опосредованной водой, в комплексе белок:феромон» . Белковая наука . 14 (1): 249–56. дои : 10.1110/ps.04912605 . ПМЦ 2253314 . ПМИД 15608125 .
- ^ Пертинез Т.А., Феррари Э., Казали Э., Патель Х.А., Списни А., Смит Л.Дж. (декабрь 2009 г.). «Полость связывания основного белка мочи мыши оптимизирована для различных способов связывания лигандов». Связь с биохимическими и биофизическими исследованиями . 390 (4): 1266–71. дои : 10.1016/j.bbrc.2009.10.133 . ПМИД 19878650 .
- ^ Jump up to: а б Хоманс SW (июль 2007 г.). «Вода, вода повсюду, кроме тех случаев, когда это имеет значение?». Открытие наркотиков сегодня . 12 (13–14): 534–9. дои : 10.1016/j.drudis.2007.05.004 . ПМИД 17631247 .
- ^ Мархлевска-кой А, Каретта А, Муцинья-Каретта С, Олейничак, П (2000). «Стимуляция течки у самок мышей белками мочи самцов». Журнал химической экологии . 26 (10): 2355–65. дои : 10.1023/А:1005578911652 . S2CID 9181177 .
- ^ Кригер Дж., Шмитт А., Лебель Д., Гудерманн Т., Шульц Г., Брир Х. и др. (февраль 1999 г.). «Селективная активация подтипов G-белка в сошниково-носовом органе при стимуляции соединениями, полученными из мочи» . Журнал биологической химии . 274 (8): 4655–62. дои : 10.1074/jbc.274.8.4655 . ПМИД 9988702 .
- ^ «Белок агрессии обнаружен у мышей» . Новости Би-би-си . 5 декабря 2007 года . Проверено 26 сентября 2009 г.
- ^ Кнопф Дж.Л., Галлахер Дж.Ф., Хелд, Вашингтон (декабрь 1983 г.). «Дифференциальная мультигормональная регуляция семейства генов основного белка мочи мыши в печени» . Молекулярная и клеточная биология . 3 (12): 2232–40. дои : 10.1128/MCB.3.12.2232 . ПМК 370094 . ПМИД 6656765 .
- ^ Робертсон Д.Х., Херст Дж.Л., Болгар М.С., Гаскелл С.Дж., Бейнон Р.Дж. (1997). «Молекулярная гетерогенность белков мочи в популяциях диких домашних мышей». Быстрая связь в масс-спектрометрии . 11 (7): 786–90. Бибкод : 1997RCMS...11..786R . doi : 10.1002/(SICI)1097-0231(19970422)11:7<786::AID-RCM876>3.0.CO;2-8 . ПМИД 9161047 .
- ^ Робертсон Д.Х., Кокс К.А., Гаскелл С.Дж., Эвершед Р.П., Бейнон Р.Дж. (май 1996 г.). «Молекулярная гетерогенность основных белков мочи Mus musculus домовой мыши» . Биохимический журнал . 316 (Часть 1) (Часть 1): 265–72. дои : 10.1042/bj3160265 . ПМЦ 1217333 . ПМИД 8645216 .
- ^ Читам С.А., Смит А.Л., Армстронг С.Д., Бейнон Р.Дж., Херст Дж.Л. (февраль 2009 г.). «Ограниченное изменение основных белков мочи лабораторных мышей». Физиология и поведение . 96 (2): 253–61. дои : 10.1016/j.physbeh.2008.10.005 . ПМИД 18973768 . S2CID 20637696 .
- ^ Бреннан, Пенсильвания (июнь 2010 г.). «На запах сексуального влечения» . БМК Биология . 8 (1): 71. дои : 10.1186/1741-7007-8-71 . ПМК 2880966 . ПМИД 20504292 .
- ^ Робертс С.А., Симпсон Д.М., Армстронг С.Д., Дэвидсон А.Дж., Робертсон Д.Х., Маклин Л. и др. (июнь 2010 г.). «Дарцин: мужской феромон, который стимулирует женскую память и сексуальное влечение к запаху отдельного мужчины» . БМК Биология . 8 (1): 75. дои : 10.1186/1741-7007-8-75 . ПМК 2890510 . ПМИД 20525243 .
- ^ Московиц С. (3 июня 2010 г.). «Биологи узнают, почему мыши сходят с ума от мочи» . FoxNews.com . Сеть новостей FOX . Проверено 9 июня 2010 г.
- ^ Jump up to: а б Херст Дж.Л., Пейн С.Э., Невисон К.М., Мари А.Д., Хамфрис Р.Э., Робертсон Д.Х. и др. (декабрь 2001 г.). «Индивидуальное распознавание у мышей, опосредованное основными белками мочи». Природа . 414 (6864): 631–4. Бибкод : 2001Natur.414..631H . дои : 10.1038/414631a . ПМИД 11740558 . S2CID 464644 .
- ^ Том М.Д., Стокли П., Джури Ф., Оллиер В.Е., Бейнон Р.Дж., Херст Дж.Л. (апрель 2008 г.). «Прямая оценка генетической гетерозиготности у мышей по запаху» . Современная биология . 18 (8): 619–23. Бибкод : 2008CBio...18..619T . дои : 10.1016/j.cub.2008.03.056 . ПМИД 18424142 . S2CID 268741 .
- ^ Шерборн А.Л., Том М.Д., Патерсон С., Джури Ф., Оллиер В.Е., Стокли П. и др. (декабрь 2007 г.). «Генетическая основа предотвращения инбридинга у домашних мышей» . Современная биология . 17 (23): 2061–6. Бибкод : 2007CBio...17.2061S . дои : 10.1016/j.cub.2007.10.041 . ПМК 2148465 . ПМИД 17997307 .
- ^ Хименес Х.А., Хьюз К.А., Алакс Г., Грэм Л., Лейси Р.К. (октябрь 1994 г.). «Экспериментальное исследование инбредной депрессии в естественной среде обитания». Наука . 266 (5183): 271–3. Бибкод : 1994Sci...266..271J . дои : 10.1126/science.7939661 . ПМИД 7939661 .
- ^ Jump up to: а б с Пейпс Ф., Логан Д.В., Стоуэрс Л. (май 2010 г.). «Вомероназальный орган опосредует межвидовое защитное поведение посредством обнаружения гомологов белковых феромонов» . Клетка . 141 (4): 692–703. дои : 10.1016/j.cell.2010.03.037 . ПМЦ 2873972 . ПМИД 20478258 .
- ^ Jump up to: а б с д Родригес I (май 2010 г.). «Химический МУПпитеер» . Клетка . 141 (4): 568–70. дои : 10.1016/j.cell.2010.04.032 . ПМИД 20478249 . S2CID 13992615 .
- ^ «Почему мыши боятся запаха кошек» . Новости Би-би-си . 17 мая 2010 года . Проверено 18 мая 2010 г.
- ^ Эренберг Р. (5 июня 2010 г.). «Борись или беги, дело в моче» . Новости науки . Архивировано из оригинала 12 октября 2012 года . Проверено 10 июня 2010 г.
- ^ Бхану С. (17 мая 2010 г.). «Когда мышь чует крысу» . Нью-Йорк Таймс .
- ^ Ласкомб М.Б., Грегуар С., Понсе П., Таварес Г.А., Росински-Чупен I, Рабиллон Дж. и др. (июль 2000 г.). «Кристаллическая структура аллергена Equ c 1. Димерный липокалин с ограниченными IgE-реактивными эпитопами» . Журнал биологической химии . 275 (28): 21572–7. дои : 10.1074/jbc.M002854200 . ПМИД 10787420 .
- ^ Jump up to: а б Локки Р., Ледфорд Д.К. (2008). «Аллергены млекопитающих». Аллергены и аллергенная иммунотерапия . Том 21 Клинической аллергии и иммунологии. Информа Здравоохранение. стр. 201–218. ISBN 978-1-4200-6197-0 .
- ^ Виртанен Т., Зейлер Т., Мянтюярви Р. (декабрь 1999 г.). «Важными аллергенами животных являются белки липокалин: почему они аллергенны?». Международный архив аллергии и иммунологии . 120 (4): 247–58. дои : 10.1159/000024277 . ПМИД 10640908 . S2CID 1171463 .
- ^ «Подробности об аллергене Mus m 1» . www.allergen.org .
- ^ Лоруссо-младший, Моффат С., Оман Дж.Л. (ноябрь 1986 г.). «Иммунологические и биохимические свойства основного аллергена мочи мыши (Mus m 1)». Журнал аллергии и клинической иммунологии . 78 (5, часть 1): 928–37. дои : 10.1016/0091-6749(86)90242-3 . ПМИД 3097107 .
- ^ Кон Р.Д., Арбес С.Дж., Инь М., Харамилло Р., Зельдин, округ Колумбия (июнь 2004 г.). «Национальная распространенность и риск воздействия мышиного аллергена в домохозяйствах США» . Журнал аллергии и клинической иммунологии . 113 (6): 1167–71. дои : 10.1016/j.jaci.2003.12.592 . ПМИД 15208600 .
- ^ Фипатанакул В., Эгглстон П.А., Райт Э.К., Вуд Р.А. (декабрь 2000 г.). «Мышиный аллерген. I. Распространенность мышиного аллергена в городских домах. Национальное совместное исследование астмы в центре города». Журнал аллергии и клинической иммунологии . 106 (6): 1070–4. дои : 10.1067/mai.2000.110796 . ПМИД 11112888 .
- ^ Перри Т., Мацуи Э., Мерриман Б., Дуонг Т., Эгглстон П. (август 2003 г.). «Распространенность крысиного аллергена в городских домах и его связь с сенсибилизацией и заболеваемостью астмой». Журнал аллергии и клинической иммунологии . 112 (2): 346–52. дои : 10.1067/май.2003.1640 . ПМИД 12897741 . S2CID 25216587 .
- ^ Вуд Р.А. (2001). «Аллергены лабораторных животных» . Журнал ИЛАР . 42 (1): 12–6. дои : 10.1093/ilar.42.1.12 . ПМИД 11123185 .
- ^ Гаффин Дж. М., Фипатанакул В. (апрель 2009 г.). «Роль комнатных аллергенов в развитии астмы» . Современное мнение в области аллергии и клинической иммунологии . 9 (2): 128–35. дои : 10.1097/ACI.0b013e32832678b0 . ПМК 2674017 . ПМИД 19326507 .
- ^ Понграчич Дж.А., Виснесс СМ, Гручалла Р.С., Эванс Р., Митчелл Х.Э. (июль 2008 г.). «Влияние мышиного аллергена и воздействия окружающей среды на грызунов на астму у детей из бедных районов». Анналы аллергии, астмы и иммунологии . 101 (1): 35–41. дои : 10.1016/S1081-1206(10)60832-0 . ПМИД 18681082 .
- ^ Гордон С., Прис Р. (сентябрь 2003 г.). «Профилактика аллергии на лабораторных животных» . Профессиональная медицина . 53 (6): 371–7. doi : 10.1093/ocmed/kqg117 . ПМИД 14514903 .
- ^ Платтс-Миллс Т.А., Лонгботтом Дж., Эдвардс Дж., Кокрофт А., Уилкинс С. (март 1987 г.). «Профессиональная астма и ринит, связанные с лабораторными крысами: сывороточные антитела IgG и IgE к аллергену мочи крысы». Журнал аллергии и клинической иммунологии . 79 (3): 505–15. дои : 10.1016/0091-6749(87)90369-1 . ПМИД 3819230 .
- ^ Jump up to: а б Грегуар С., Росински-Шюпен I, Рабийон Дж., Альзари П.М., Дэвид Б., Дандеу Дж.П. (декабрь 1996 г.). «Клонирование и секвенирование кДНК выявили, что основной лошадиный аллерген Equ c1 является членом гликопротеина суперсемейства липокалинов» . Журнал биологической химии . 271 (51): 32951–9. дои : 10.1074/jbc.271.51.32951 . ПМИД 8955138 .
- ^ Jump up to: а б Хуэй Икс, Чжу В, Ван Ю, Лам К.С., Чжан Дж, Ву Д и др. (май 2009 г.). «Основной белок-1 мочи увеличивает расход энергии и улучшает непереносимость глюкозы за счет улучшения митохондриальной функции в скелетных мышцах мышей с диабетом» . Журнал биологической химии . 284 (21): 14050–7. дои : 10.1074/jbc.M109.001107 . ПМЦ 2682853 . ПМИД 19336396 .
- ^ Чжоу Ю, Цзян Л, Жуй Л (апрель 2009 г.). «Идентификация MUP1 как регулятора метаболизма глюкозы и липидов у мышей» . Журнал биологической химии . 284 (17): 11152–9. дои : 10.1074/jbc.M900754200 . ПМК 2670120 . ПМИД 19258313 .
Внешние ссылки
[ редактировать ]- Запах грызуна , Файлы «Почему» – Наука, лежащая в основе новостей
- Сигналы страха от хищников на YouTube , видео, описывающее исследование, которое определило, что Мупы были кайромонами.