Липокалин
 | |||
| Идентификаторы | |||
|---|---|---|---|
| Символ | Липокалин | ||
| Пфам | PF00061 | ||
| Пфам Клан | CL0116 | ||
| ИнтерПро | IPR000566 | ||
| PROSITE | PDOC00187 | ||
| СКОП2 | 1hms / SCOPe / СУПФАМ | ||
| Суперсемейство OPM | 50 | ||
| белок OPM | 1кт6 | ||
| |||
| Липокалин-подобный домен | |||
|---|---|---|---|
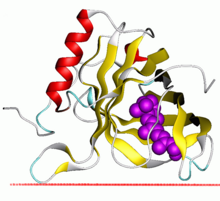
 Структура липокалина Escherichia coli . [1] | |||
| Идентификаторы | |||
| Символ | Липокалин_2 | ||
| Пфам | PF08212 | ||
| Пфам Клан | CL0116 | ||
| ИнтерПро | ИПР013208 | ||
| |||
Липокалины стероиды — это семейство белков, которые транспортируют небольшие гидрофобные молекулы, такие как , билины , ретиноиды и липиды . Большинство липокалинов также способны связываться с комплексным железом (через сидерофоры) . [2] или флавоноиды [3] ), а также гем . [4] Они имеют ограниченные области гомологии последовательностей и общую архитектуру третичной структуры. [5] [6] [7] [8] [9] Это восьмицепочечный антипараллельный бета-цилиндр с повторяющейся топологией +1, включающий внутренний сайт связывания лиганда. [7] [8]
Эти белки обнаружены в грамотрицательных бактериях, клетках позвоночных и беспозвоночных , а также в растениях. Липокалины связаны со многими биологическими процессами, в том числе с иммунным ответом, транспортом феромонов , биологическим синтезом простагландинов , связыванием ретиноидов и взаимодействием раковых клеток. [10]
Функция
[ редактировать ]Иммунный ответ
[ редактировать ]Белки липокалин играют важную роль в пищевом иммунитете, удерживая и изолируя микроэлементы. [11] Таким образом, они способны регулировать воспалительные и детоксикационные процессы, вызванные активацией иммунной системы млекопитающих. Они являются известными респираторными аллергенами мышей, кошек, собак, лошадей и других животных. Примеры белков липокалина, участвующих в реакциях иммунной системы, включают альфа-1-микроглобулин , альфа-1-кислотный гликопротеин и C8gamma . Структурная информация для многих белков липокалина, влияющих на иммунную систему, доступна, хотя их точная роль в биологических системах все еще неясна. Было показано, что аллергены липокалина вызывают Th2 -отклоненный иммунный ответ, важный для аллергической сенсибилизации, при применении в их апо-форме (с пустой чашечкой, лишенной лигандов), тогда как голо-форма, по-видимому, проявляет иммуносупрессивные свойства in vitro. . [12]
Транспорт феромонов
[ редактировать ]Семейство липокалинов связано с транспортом феромонов млекопитающих благодаря легко наблюдаемым белок-феромонным взаимодействиям. Липокалины сравнительно малы по размеру, и поэтому их легче изучать по сравнению с большими, объемистыми белками. Они также могут связываться с различными лигандами для разных биологических целей. Липокалины были обнаружены в качестве белков-переносчиков важных феромонов в носовой слизи грызунов. Основные белки мочи , подсемейство липокалинов, обнаруживаются в моче мышей и крыс и сами могут действовать как белковые феромоны. [13]
Синтез простагландинов
[ редактировать ]Это семейство белков играет роль в биологической системе синтеза терминальных простагландинов.
Связывание ретиноидов
[ редактировать ]Ретинол (витамин А) является важным микроэлементом , который влияет на зрение, дифференцировку клеток , функцию иммунной системы, рост костей и подавление опухолей . Всасывание и метаболизм ретинола зависят от липокалинов, которые действуют как связывающие белки. ретинила Эфиры (присутствующие в мясе) и бета-каротин (присутствующие в растениях) являются двумя основными источниками ретиноидов в рационе. После поступления в организм они превращаются в ретинол, последовательно метаболизируются и, наконец, связываются с ретинолсвязывающими белками (липокалинами) в плазме крови .
Взаимодействие раковых клеток
[ редактировать ]Поскольку липокалины являются внеклеточными белками, их внутриклеточные эффекты неочевидны и требуют дальнейшего изучения. Однако липофильные лиганды, присутствующие в качестве заместителей липокалинов, обладают способностью проникать в клетку, где они могут действовать как ингибиторы опухолевых протеаз . Это исследование предлагает другой возможный путь исследования белков-опухолей.
Аллергены
[ редактировать ]Некоторые белки этого семейства являются аллергенами. Аллергия — это реакция гиперчувствительности иммунной системы на определенные вещества, называемые аллергенами (например, пыльца, укусы, лекарства или пища), которая у большинства людей не приводит к появлению симптомов. Установлена система номенклатуры антигенов (аллергенов), вызывающих у человека IgE-опосредованную атопическую аллергию. [14] Эта номенклатурная система определяется обозначением, состоящим из первых трехбуквы рода; пространство; первая буква названия вида; пробел и арабская цифра. В случае, если два видовых названия имеют одинаковые обозначения, их отличают друг от друга добавлением одной или нескольких букв (при необходимости) к каждому видовому обозначению.
К аллергенам этого семейства относятся аллергены со следующими обозначениями: Bla g 4, Bos d 2, Bos d 5, Can f 1, Can f 2, Fel d 4, Equ c 1 и Equ c 2. [ нужна ссылка ]
Гормон
[ редактировать ]LCN2 (липокалин 2) действует как гормон костного происхождения, который проникает через ГЭБ и действует на паравентрикулярное ядро PVN гипоталамуса в головном мозге. [ нужна ссылка ]
Структура
[ редактировать ]Хотя липокалины представляют собой широкое семейство очень разнообразных белков, их трехмерная структура является объединяющей характеристикой. Липокалины имеют восьминитевую антипараллельную симметричную складку β-бочонка, которая, по сути, представляет собой бета-лист , свернутый в цилиндрическую форму. Внутри этого бочонка расположен сайт связывания лиганда, который играет важную роль в классификации липокалина как транспортного белка. [15] Если липокалины создаются с помощью генной инженерии с целью изменить их связывающие свойства, их называют антикалинами . [16]
Члены семьи
[ редактировать ]Было предложено название «липокалин». [5] для этого семейства белков, но цитозольные белки, связывающие жирные кислоты также включены . Последовательности большинства членов семейства, ядерных или ядерных липокалинов, характеризуются тремя короткими консервативными участками остатков, в то время как другие, выделяющиеся группы липокалинов, имеют только один или два из них. [8] [17] Белки, которые, как известно, принадлежат к этому семейству, включают альфа-1-микроглобулин (белок HC); основные белки мочи ; альфа-1-кислый гликопротеин ( оросомукоид ); [18] афродизин; аполипопротеин D ; бета-лактоглобулин ; компонент комплемента гамма-цепи C8; [19] ракоцианин ; [20] белок, связывающий эпидидимальную ретиноевую кислоту (E-RABP); [21] инсектацианин; белок, связывающий одорант (OBP); человеческий альфа-2-глобулин эндометрия, связанный с беременностью ( PAEP ); пробазин (PB), белок простаты; простагландин D-синтаза ; [22] пурпурин; белок железы фон Эбнера ( VEGP ); [23] и секреторный белок IV придатков ящерицы (LESP IV). [24]
Белки человека, содержащие домен липокалина, включают:
- АМБП , Астрономическая картинка дня
- C8G , КРАБП1 , КРАБП2
- FABP1 , FABP2 , FABP3 , FABP4 , FABP5 , FABP6 , FABP7
- LCN1 , LCN2 , LCN8 , LCN9 , LCN10 , LCN12
- ОБП2А , ОБП2Б
- ОРМ1 , ОРМ2
- ПАЭП , ПЕРФ15 , ПМП2 , ПТГДС
- RBP1 , RBP2 , RBP4 , RBP5 , RBP7
- UNQ2541
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Кампаначчи В., Нуриццо Д., Спинелли С., Валенсия С., Тегони М., Камбийо С. (март 2004 г.). «Кристаллическая структура липокалина Blc Escherichia coli предполагает возможную роль в связывании фосфолипидов» . Письма ФЭБС . 562 (1–3): 183–188. Бибкод : 2004FEBSL.562..183C . дои : 10.1016/S0014-5793(04)00199-1 . ПМИД 15044022 . S2CID 26737744 .
- ^ Гетц Д.Х., Холмс М.А., Боррегор Н., Блюм М.Е., Раймонд К.Н., Стронг Р.К. (ноябрь 2002 г.). «Нейтрофильный липокалин NGAL является бактериостатическим агентом, который препятствует опосредованному сидерофором усвоению железа» . Молекулярная клетка . 10 (5): 1033–1043. дои : 10.1016/s1097-2765(02)00708-6 . ПМИД 12453412 .
- ^ Рот-Вальтер Ф., Пасиос Л.Ф., Бьянкини Р., Йенсен-Яролим Э. (декабрь 2017 г.). «Связь дефицита железа с аллергией: роль молекулярных аллергенов и микробиома» . Металломика . 9 (12): 1676–1692. дои : 10.1039/c7mt00241f . ПМИД 29120476 .
- ^ Мац Дж.М., Дреппер Б., Блюм Т.Б., ван Гендерен Э., Баррелл А., Мартин П. и др. (июль 2020 г.). «Липокалин опосредует однонаправленную биоминерализацию гема у малярийных паразитов» . Труды Национальной академии наук Соединенных Штатов Америки . 117 (28): 16546–16556. Бибкод : 2020PNAS..11716546M . дои : 10.1073/pnas.2001153117 . ПМЦ 7368307 . ПМИД 32601225 .
- ^ Jump up to: а б Перваиз С., Брю К. (сентябрь 1987 г.). «Гомология и структурно-функциональные корреляции между альфа-1-кислотным гликопротеином и сывороточным ретинол-связывающим белком и его родственниками» . Журнал ФАСЭБ . 1 (3): 209–214. дои : 10.1096/fasebj.1.3.3622999 . ПМИД 3622999 . S2CID 12416282 .
- ^ Игараси М., Нагата А., Тох Х., Ураде Ю., Хаяиси О. (июнь 1992 г.). «Структурная организация гена синтазы простагландина D в мозге крысы» . Труды Национальной академии наук Соединенных Штатов Америки . 89 (12): 5376–5380. Бибкод : 1992PNAS...89.5376I . дои : 10.1073/pnas.89.12.5376 . ПМК 49294 . ПМИД 1608945 .
- ^ Jump up to: а б Коуэн С.В., новичок М.Э., Джонс Т.А. (1990). «Кристаллографическое уточнение ретинол-связывающего белка сыворотки человека с разрешением 2А». Белки . 8 (1): 44–61. дои : 10.1002/прот.340080108 . ПМИД 2217163 . S2CID 21613341 .
- ^ Jump up to: а б с Flower DR, North AC, Attwood TK (май 1993 г.). «Структура и взаимоотношения последовательности липокалинов и родственных белков» . Белковая наука . 2 (5): 753–761. дои : 10.1002/pro.5560020507 . ПМК 2142497 . ПМИД 7684291 .
- ^ Годовац-Циммерманн Дж. (февраль 1988 г.). «Структурный мотив бета-лактоглобулина и ретинол-связывающего белка: основная основа связывания и транспорта небольших гидрофобных молекул?». Тенденции биохимических наук . 13 (2): 64–66. дои : 10.1016/0968-0004(88)90031-X . ПМИД 3238752 .
- ^ Араос П., Амадор, Калифорния (2022 г.). «Липокалин, связанный с желатиназой нейтрофилов, как иммуномодулятор при эндокринной гипертензии» . Фронт Эндокринол (Лозанна) . 13 : 1006790. дои : 10.3389/fendo.2022.1006790 . ПМЦ 9640732 . ПМИД 36387895 .
- ^ Рот-Вальтер, Франциска (2022). «Дефицит железа при атопических заболеваниях: подготовка врожденного иммунитета под действием аллергенов и сидерофоров» . Границы аллергии . 3 : 859922. doi : 10.3389/falgy.2022.859922 . ISSN 2673-6101 . ПМЦ 9234869 . ПМИД 35769558 .
- ^ Рот-Вальтер Ф., Пасиос Л.Ф., Гомес-Касадо С., Хофстеттер Г., Рот Г.А., Сингер Дж. и др. (август 2014 г.). «Основной аллерген коровьего молока Bos d 5 манипулирует Т-хелперными клетками в зависимости от их нагрузки железом, связанным с сидерофором» . ПЛОС ОДИН . 9 (8): е104803. Бибкод : 2014PLoSO...9j4803R . дои : 10.1371/journal.pone.0104803 . ПМК 4130594 . ПМИД 25117976 .
- ^ Чамеро П., Мартон Т.Ф., Логан Д.В., Фланаган К., Круз Дж.Р., Сагателян А. и др. (декабрь 2007 г.). «Идентификация белковых феромонов, способствующих агрессивному поведению». Природа . 450 (7171): 899–902. Бибкод : 2007Natur.450..899C . дои : 10.1038/nature05997 . ПМИД 18064011 . S2CID 4398766 .
- «Белок агрессии обнаружен у мышей» . Новости Би-би-си . 5 декабря 2007 г.
- ^ [Подкомитет по номенклатуре аллергенов ВОЗ/IUIS Кинг Т.П., Хоффманн Д., Левенштейн Х., Марш Д.Г., Platts-Mills TAE, Томас В. Булл. Всемирный орган здравоохранения. 72:797-806(1994)]
- ^ Флауэр, ДР; Север, AC; Сансом, CE (01 октября 2000 г.). «Семейство белков липокалина: обзор структуры и последовательности» . Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1482 (1–2): 9–24. дои : 10.1016/s0167-4838(00)00148-5 . ISSN 1878-2434 . ПМИД 11058743 .
- ^ Ахац, С; Джараш, А; Скерра, А. (01 января 2022 г.). «Структурная пластичность в области петли сконструированных липокалинов с новой специфичностью лигандов, так называемых антикалинов» . Журнал структурной биологии: X. 6 : 100054. doi : 10.1016/j.yjsbx.2021.100054 . ISSN 2590-1524 . ПМЦ 8693463 . ПМИД 34988429 .
- ^ Flower DR, North AC, Attwood TK (октябрь 1991 г.). «Мышиный онкогенный белок 24p3 является членом семейства белков липокалина». Связь с биохимическими и биофизическими исследованиями . 180 (1): 69–74. дои : 10.1016/S0006-291X(05)81256-2 . ПМИД 1834059 .
- ^ Кремер Дж. М., Уилтинг Дж., Янссен Л. Х. (март 1988 г.). «Связывание лекарств с гликопротеином альфа-1-кислоты человека в норме и при заболеваниях». Фармакологические обзоры . 40 (1): 1–47. ПМИД 3064105 .
- ^ Хефлигер Дж.А., Пайч М.К., Дженне Д.Е., Чопп Дж. (1991). «Структурная и функциональная характеристика гамма-комплемента C8, члена семейства белков липокалина». Молекулярная иммунология . 28 (1–2): 123–131. дои : 10.1016/0161-5890(91)90095-2 . ПМИД 1707134 .
- ^ Кин Дж.Н., Касерес И., Элиопулос Э.Э., Загальский П.Ф., Финдли Дж.Б. (апрель 1991 г.). «Полная последовательность и модель субъединицы А2 пигментного комплекса каротиноидов, ракоцианина». Европейский журнал биохимии . 197 (2): 407–417. дои : 10.1111/j.1432-1033.1991.tb15925.x . ПМИД 2026162 .
- ^ Новичок МЭ (сентябрь 1993 г.). «Структура придаточного белка, связывающего ретиноевую кислоту, с разрешением 2,1 А» . Структура . 1 (1): 7–18. дои : 10.1016/0969-2126(93)90004-Z . ПМИД 8069623 .
- ^ Пейч М.С., Богуски М.С. (октябрь 1991 г.). «Первый липокалин с ферментативной активностью». Тенденции биохимических наук . 16 (10): 363. doi : 10.1016/0968-0004(91)90149-P . ПМИД 1723819 .
- ^ Кок К., Алерс К., Шмале Х. (май 1994 г.). «Структурная организация генов белков 1 и 2 железы фон Эбнера крысы показывает их тесное родство с липокалинами» . Европейский журнал биохимии . 221 (3): 905–916. дои : 10.1111/j.1432-1033.1994.tb18806.x . ПМИД 7514123 .
- ^ Морель Л., Дюфор Дж.П., Депейж А. (май 1993 г.). «LESP, андроген-регулируемое семейство секреторных белков придатков ящерицы, идентифицированное как новый член суперсемейства липокалинов» . Журнал биологической химии . 268 (14): 10274–10281. дои : 10.1016/S0021-9258(18)82200-1 . ПМИД 8486691 .
Дальнейшее чтение
[ редактировать ]- Пейн К., Flower DR (октябрь 2000 г.). «Сайт липокалина». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1482 (1–2): 351–352. дои : 10.1016/S0167-4838(00)00166-7 . ПМИД 11058775 .
- Виртанен Т., Зейлер Т., Мянтюярви Р. (декабрь 1999 г.). «Важными аллергенами животных являются белки липокалин: почему они аллергенны?». Международный архив аллергии и иммунологии . 120 (4): 247–258. дои : 10.1159/000024277 . ПМИД 10640908 . S2CID 1171463 .
- Брэтт Т. (октябрь 2000 г.). «Липокалины и рак». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1482 (1–2): 318–326. дои : 10.1016/S0167-4838(00)00154-0 . ПМИД 11058772 .
- Чаррон Ж.Б., Уэлле Ф., Пеллетье М., Данилюк Дж., Шов С., Сархан Ф. (декабрь 2005 г.). «Идентификация, экспрессия и эволюционный анализ растительных липокалинов» . Физиология растений . 139 (4): 2017–2028. дои : 10.1104/стр.105.070466 . ПМЦ 1310578 . ПМИД 16306142 .
- Новотный М.В. (февраль 2003 г.). «Феромоны, связывающие белки и реакции рецепторов у грызунов». Труды Биохимического общества . 31 (Часть 1): 117–122. дои : 10.1042/BST0310117 . ПМИД 12546667 .
Внешние ссылки
[ редактировать ]- Липокалины в базе данных SCOP
- UMich Ориентация белков в семействах мембран/суперсемействе-52 - Расчетное пространственное положение некоторых липокалинов в мембранах