Ангиотензинпревращающий фермент
 Мономер ангиотензинпревращающего фермента, Drosophila melanogaster | |||
| Идентификаторы | |||
|---|---|---|---|
| Номер ЕС. | 3.4.15.1 | ||
| Номер CAS. | 9015-82-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
| ТУЗ | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | АПФ , ангиотензинпревращающий фермент, ACE1, CD143, DCP, DCP1, ICH, MVCD3, ангиотензинпревращающий фермент | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 106180 ; МГИ : 87874 ; Гомологен : 37351 ; Генные карты : ACE ; ОМА : ACE — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Ангиотензинпревращающий фермент ( EC 3.4.15.1 ), или АПФ , является центральным компонентом ренин-ангиотензиновой системы (РАС), который контролирует кровяное давление путем регулирования объема жидкости в организме. Он превращает гормон ангиотензин I в активный сосудосуживающий ангиотензин II . Таким образом, АПФ косвенно повышает кровяное давление, вызывая сужение кровеносных сосудов. Ингибиторы АПФ широко используются в качестве фармацевтических препаратов для лечения сердечно-сосудистых заболеваний . [5]
Другими менее известными функциями АПФ являются деградация брадикинина , [6] вещество Р [7] и бета-амилоидный белок . [8]
Номенклатура
[ редактировать ]ACE также известен под следующими названиями:
- дипептидилкарбоксипептидаза I
- пептидаза Р
- дипептид гидролаза
- пептидилдипептидаза
- ангиотензинпревращающий фермент
- киназа II
- ангиотензин I-превращающий фермент
- карбоксикатепсин
- дипептидилкарбоксипептидаза
- «гипертензинпревращающий фермент» пептидилдипептидаза I
- пептидил-дипептидгидролаза
- пептидилдипептидгидролаза
- пептидилдипептидаза эндотелиальных клеток
- пептидилдипептидаза-4
- ПДХ
- пептидилдипептидгидролаза
- ДКП
- CD143
Функция
[ редактировать ]АПФ гидролизует пептиды путем удаления дипептида с С-конца. Аналогичным образом он превращает неактивный декапептид ангиотензин I в октапептид ангиотензин II путем удаления дипептида His-Leu. [9]

АПФ является центральным компонентом ренин-ангиотензиновой системы (РАС), которая контролирует кровяное давление путем регулирования объема жидкости в организме.

Ангиотензин II является мощным вазоконстриктором , действие которого зависит от концентрации субстрата. [10] Ангиотензин II связывается с рецептором ангиотензина II типа 1 (АТ1) , что запускает ряд действий, которые приводят к сужению сосудов и, следовательно, к повышению артериального давления.
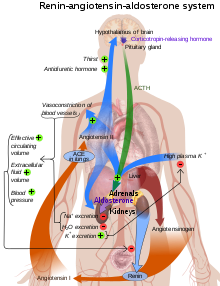
АПФ также является частью кинин-калликреиновой системы , где он разрушает брадикинин , мощный сосудорасширяющий препарат , и другие вазоактивные пептиды. [12]
Кининаза II аналогична ангиотензинпревращающему ферменту. Таким образом, тот же фермент (АПФ), который генерирует вазоконстриктор (АНГ II), также избавляется от вазодилататоров (брадикинина). [11]
Механизм
[ редактировать ]цинка АПФ представляет собой металлопротеиназу . [13] Цинковый центр катализирует гидролиз пептидов. Отражая решающую роль цинка, АПФ может ингибироваться металл -хелатирующими агентами. [14]

Остаток E384 имеет механистическое значение. Как общее основание, он депротонирует связанную с цинком воду , образуя нуклеофильный центр Zn-OH. Образующаяся аммониевая группа затем служит обычной кислотой, расщепляющей связь CN. [16]
Функция хлорид-иона очень сложна и широко обсуждается. Активация анионов хлоридом является характерной особенностью АПФ. [17] Экспериментально установлено, что активация гидролиза хлоридом сильно зависит от субстрата. Хотя он увеличивает скорость гидролиза, например, Hip-His-Leu, он ингибирует гидролиз других субстратов, таких как Hip-Ala-Pro. [16] В физиологических условиях фермент достигает около 60% своей максимальной активности в отношении ангиотензина I и полной активности в отношении брадикинина. Поэтому предполагается, что функция активации анионов в ACE обеспечивает высокую субстратную специфичность. [17] Другие теории утверждают, что хлорид может просто стабилизировать общую структуру фермента. [16]
Генетика
[ редактировать ]Ген ACE, ACE , кодирует два изофермента . Соматический изофермент экспрессируется во многих тканях, главным образом в легких, включая эндотелиальные клетки сосудов, эпителиальные клетки почек и яичек клетки Лейдига , тогда как зародышевый экспрессируется только в сперме . Ткани головного мозга содержат фермент АПФ, который принимает участие в локальной РАС и превращает Аβ42 (который агрегирует в бляшки) в Аβ40 (который считается менее токсичным) формы бета-амилоида . Последнее преимущественно является функцией части N-домена фермента АПФ. Таким образом, ингибиторы АПФ, которые проникают через гематоэнцефалический барьер и имеют преимущественно выбранную N-концевую активность, могут вызывать накопление Aβ42 и прогрессирование деменции. [ нужна ссылка ]
Актуальность заболевания
[ редактировать ]Ингибиторы АПФ широко используются в качестве фармацевтических препаратов при лечении таких состояний, как высокое кровяное давление , сердечная недостаточность , диабетическая нефропатия и сахарный диабет 2 типа .
Ингибиторы АПФ конкурентно ингибируют АПФ. [18] Это приводит к снижению образования ангиотензина II и снижению метаболизма брадикинина , что приводит к систематическому расширению артерий и вен и снижению артериального давления. Кроме того, ингибирование образования ангиотензина II снижает опосредованную ангиотензином II секрецию альдостерона из коры надпочечников , что приводит к уменьшению реабсорбции воды и натрия и уменьшению внеклеточного объема. [19]
Влияние АПФ на болезнь Альцгеймера до сих пор широко обсуждается. У пациентов с болезнью Альцгеймера обычно наблюдаются более высокие уровни АПФ в мозгу. Некоторые исследования показывают, что ингибиторы АПФ, способные преодолевать гематоэнцефалический барьер (ГЭБ), могут повышать активность основных ферментов, разрушающих бета-амилоидный пептид, таких как неприлизин, в мозге, что приводит к замедлению развития болезни Альцгеймера. [20] Более поздние исследования показывают, что ингибиторы АПФ могут снизить риск болезни Альцгеймера при отсутствии аллелей аполипопротеина Е4 (ApoE4) , но не окажут никакого эффекта у носителей ApoE4. [21] Другая, более поздняя гипотеза заключается в том, что более высокие уровни АПФ могут предотвратить болезнь Альцгеймера. Предполагается, что АПФ может разрушать бета-амилоид в кровеносных сосудах головного мозга и, следовательно, способствовать предотвращению прогрессирования заболевания. [22]
отрицательная корреляция между частотой D-аллели ACE1 и распространенностью и смертностью от COVID-19 . Установлена [23]
Патология
[ редактировать ]- Повышенные уровни АПФ также обнаруживаются при саркоидозе и используются при диагностике и мониторинге этого заболевания. Повышенные уровни АПФ обнаруживаются также при проказе , гипертиреозе , остром гепатите , первичном билиарном циррозе печени , сахарном диабете , множественной миеломе , остеоартрите , амилоидозе , болезни Гоше , пневмокониозе , гистоплазмозе и милиарном туберкулезе . Это также отмечается у некоторых пациентов с обширным бляшечным псориазом.
- Уровни в сыворотке снижаются при заболеваниях почек , обструктивной болезни легких и гипотиреозе .
Влияние на спортивные результаты
[ редактировать ]Ген ангиотензинпревращающего фермента имеет более 160 полиморфизмов, описанных по состоянию на 2018 год. [24]
Исследования показали, что разные генотипы ангиотензинпревращающего фермента могут по-разному влиять на спортивные результаты. [25] [26]
Полиморфизм I/D rs1799752 состоит из вставки (I) или отсутствия (D) последовательности аланина из 287 пар оснований в интроне 16 гена. [24] Генотип DD связан с более высокими уровнями белка ACE в плазме, генотип DI — с промежуточными уровнями, а генотип II — с более низкими уровнями. [24] Во время физических упражнений из-за более высокого уровня АПФ у носителей D-аллели и, следовательно, более высокой способности вырабатывать ангиотензин II, кровяное давление будет повышаться раньше, чем у носителей I-аллеля. Это приводит к снижению максимальной частоты сердечных сокращений и снижению максимального потребления кислорода (VO2max ) . Таким образом, у носителей D-аллеля риск сердечно-сосудистых заболеваний увеличивается на 10%. Более того, D-аллель связана с большим увеличением роста левого желудочка в ответ на тренировку по сравнению с I-аллелем. [27] С другой стороны, носители I-аллеля обычно демонстрируют повышенную максимальную частоту сердечных сокращений из-за более низких уровней АПФ, более высокого максимального поглощения кислорода и, следовательно, демонстрируют повышенную выносливость. [27] Аллель I чаще встречается у элитных бегунов на длинные дистанции, гребцов и велосипедистов. У пловцов на короткие дистанции наблюдается повышенная частота D-аллели, поскольку их дисциплина больше зависит от силы, чем от выносливости. [28] [29]
История
[ редактировать ]Об этом ферменте сообщил Леонард Т. Скеггс-младший в 1956 году. [30] Кристаллическая структура ACE человеческого яичка была расшифрована в 2002 году Р. Натешем, С. Швагером и Э. Старроком в лаборатории К. Рави Ачарья. [15] Он расположен главным образом в капиллярах легких, но также может быть обнаружен в эндотелиальных и эпителиальных клетках почек . [31]
См. также
[ редактировать ]- Ингибиторы АПФ
- Ангиотензинпревращающий фермент 2 (ACE2)
- Гипотензивная трансфузионная реакция
- Ренин-ангиотензиновая система
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000159640 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000020681 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Основы сердечной анестезии Каплана . Эльзевир. 2018. дои : 10.1016/c2012-0-06151-0 . ISBN 978-0-323-49798-5 .
Механизмы действия: Ингибиторы АПФ действуют путем ингибирования одной из нескольких протеаз, ответственных за расщепление декапептида Ang I с образованием октапептида Ang II. Поскольку АПФ также является ферментом, расщепляющим брадикинин, ингибиторы АПФ повышают уровень брадикинина в крови и тканях (рис. 8.4).
- ^ Филларди П.П. (2015). ИАПФ и БРА при гипертонии и сердечной недостаточности . Том. 5. Швейцария: Международное издательство Springer. стр. 10–13. ISBN 978-3-319-09787-9 .
- ^ Дикпинигайтис П.В. (январь 2006 г.). «Кашель, вызванный ингибитором ангиотензинпревращающего фермента: научно обоснованные рекомендации по клинической практике ACCP». Грудь . 129 (1 доп.): 169С–173С. doi : 10.1378/chest.129.1_suppl.169S . ПМИД 16428706 .
- ^ Хемминг М.Л., Selkoe DJ (ноябрь 2005 г.). «Бета-амилоидный белок разрушается клеточным ангиотензинпревращающим ферментом (АПФ) и повышается под действием ингибитора АПФ» . Журнал биологической химии . 280 (45): 37644–37650. дои : 10.1074/jbc.M508460200 . ПМК 2409196 . ПМИД 16154999 .
- ^ Коутс Д. (июнь 2003 г.). «Ангиотензинпревращающий фермент (АПФ)». Международный журнал биохимии и клеточной биологии . Ренин-ангиотензиновые системы: современное состояние. 35 (6): 769–773. дои : 10.1016/S1357-2725(02)00309-6 . ПМИД 12676162 .
- ^ Чжан Р., Сюй С, Чен Т, Ли Л, Рао П (май 2000 г.). «Анализ ангиотензинпревращающего фермента с использованием капиллярного зонального электрофореза» . Аналитическая биохимия . 280 (2): 286–290. дои : 10.1006/abio.2000.4535 . ПМИД 10790312 .
- ^ Перейти обратно: а б «Интеграция водно-солевого баланса». Медицинская физиология: клеточный и молекулярный подход . Филадельфия, Пенсильвания: Эльзевир Сондерс. 2005. стр. 866–867. ISBN 978-1-4160-2328-9 .
- ^ Imig JD (март 2004 г.). «Ингибирование АПФ и опосредованные брадикинином реакции почечных сосудов: участие EDHF» . Гипертония . 43 (3): 533–535. doi : 10.1161/01.HYP.0000118054.86193.ce . ПМИД 14757781 .
- ^ Ван В., МакКинни С.М., Фархан М., Пол М., Макдональд Т., Маклин Б. и др. (август 2016 г.). «Ангиотензинпревращающий фермент 2 метаболизирует и частично инактивирует пир-апелин-13 и апелин-17: физиологические эффекты в сердечно-сосудистой системе» . Гипертония . 68 (2): 365–377. doi : 10.1161/ГИПЕРТЕНЗИЯ.115.06892 . ПМИД 27217402 . S2CID 829514 .
- ^ Бюннинг П., Риордан Дж. Ф. (июль 1985 г.). «Функциональная роль цинка в ангиотензинпревращающем ферменте: значение для ферментативного механизма». Журнал неорганической биохимии . 24 (3): 183–198. дои : 10.1016/0162-0134(85)85002-9 . ПМИД 2995578 .
- ^ Перейти обратно: а б Натеш Р., Швагер С.Л., Старрок Э.Д., Ачарья К.Р. (январь 2003 г.). «Кристаллическая структура комплекса ангиотензинпревращающего фермента человека-лизиноприла» . Природа . 421 (6922): 551–554. Бибкод : 2003Natur.421..551N . дои : 10.1038/nature01370 . ПМИД 12540854 . S2CID 4137382 . Архивировано из оригинала 26 ноября 2022 года . Проверено 22 мая 2020 г.
- ^ Перейти обратно: а б с Чжан С., Ву С., Сюй Д. (июнь 2013 г.). «Каталитический механизм ангиотензинпревращающего фермента и действие иона хлорида». Журнал физической химии Б. 117 (22): 6635–6645. дои : 10.1021/jp400974n . ПМИД 23672666 .
- ^ Перейти обратно: а б Бюннинг П. (1983). «Каталитический механизм ангиотензинпревращающего фермента». Клиническая и экспериментальная гипертония. Часть А. Теория и практика . 5 (7–8): 1263–1275. дои : 10.3109/10641968309048856 . ПМИД 6315268 .
- ^ «Ингибиторы ангиотензинпревращающего фермента (АПФ)» (PDF) . Британское общество гипертонии . Архивировано из оригинала (PDF) 18 ноября 2017 года.
- ^ Клабанде РЭ. «Ингибиторы АПФ» . Концепции сердечно-сосудистой фармакологии . cvpharmacology.com. Архивировано из оригинала 2 февраля 2009 года . Проверено 26 марта 2009 г.
- ^ «Важность лечения артериального давления: ингибиторы АПФ могут замедлить развитие болезни Альцгеймера» . Медскейп . Медскейп Кардиология. 2004. Архивировано из оригинала 31 августа 2016 года . Проверено 1 марта 2016 г.
- ^ Цю В.К., Мвамбури М., Бессер Л.М., Чжу Х., Ли Х., Уоллак М. и др. (1 января 2013 г.). «Ингибиторы ангиотензинпревращающего фермента и снижение риска болезни Альцгеймера при отсутствии аллели аполипопротеина Е4» . Журнал болезни Альцгеймера . 37 (2): 421–428. дои : 10.3233/JAD-130716 . ПМК 3972060 . ПМИД 23948883 .
- ^ «Фермент ACE может усилить иммунные реакции и предотвратить болезнь Альцгеймера» . Наука 2.0 . 27 августа 2014 года. Архивировано из оригинала 7 марта 2016 года . Проверено 1 марта 2016 г.
- ^ Деланж-младший, Спикаерт М.М., Де Бюзер М.Л. (июнь 2020 г.). «Полиморфизм ангиотензинпревращающего фермента хозяина может объяснить эпидемиологические данные при инфекциях COVID-19» . Клиника Химика Акта; Международный журнал клинической химии . 505 : 192–193. doi : 10.1016/j.cca.2020.03.031 . ПМК 7102561 . ПМИД 32220422 .
- ^ Перейти обратно: а б с Синтра М.Т., Баларин М.А., Танака С.С., Сильва В.И., Марки А.Б., Ресенде Э.А. и др. (ноябрь 2018 г.). «Синдром поликистозных яичников: полиморфизм rs1799752 гена ACE» . Журнал Бразильской медицинской ассоциации . 64 (11): 1017–1022. дои : 10.1590/1806-9282.64.11.1017 . ПМИД 30570054 .
- ^ Флюк М., Крамер М., Фитце Д.П., Каспер С., Франки М.В., Вальдивьесо П. (8 мая 2019 г.). «Клеточные аспекты специализации мышц демонстрируют эффекты взаимодействия генотипа и фенотипа у спортсменов» . Границы в физиологии . 10 :526. дои : 10.3389/fphys.2019.00526 . ПМК 6518954 . ПМИД 31139091 .
- ^ Ван П., Федорук М.Н., Руперт Дж.Л. (2008). «Идти в ногу с АПФ: являются ли ингибиторы АПФ и антагонисты рецепторов ангиотензина II типа 1 потенциальными допинговыми агентами?». Спортивная медицина . 38 (12): 1065–1079. дои : 10.2165/00007256-200838120-00008 . ПМИД 19026021 . S2CID 7614657 .
- ^ Перейти обратно: а б Монтгомери Х.Э., Кларксон П., Доллери С.М., Прасад К., Лоси М.А., Хемингуэй Х. и др. (август 1997 г.). «Связь полиморфизма гена ангиотензинпревращающего фермента I/D с изменением массы левого желудочка в ответ на физическую тренировку». Тираж . 96 (3): 741–747. дои : 10.1161/01.CIR.96.3.741 . ПМИД 9264477 .
- ^ Сандерс Дж., Монтгомери Х., Вудс Д. (2001). «Адаптация сердца к физическим тренировкам» [Реакция сердца на физические тренировки] (PDF) . Немецкий журнал спортивной медицины (на немецком языке). 52 (3): 86–92. Архивировано (PDF) из оригинала 8 марта 2016 г. Проверено 1 марта 2016 г.
- ^ Коста А.М., Силва А.Дж., Гарридо Н.Д., Луро Х., де Оливейра Р.Дж., Брайтенфельд Л. (август 2009 г.). «Ассоциация между аллелем ACE D и элитным плаванием на короткие дистанции». Европейский журнал прикладной физиологии . 106 (6): 785–790. дои : 10.1007/s00421-009-1080-z . hdl : 10400.15/3565 . ПМИД 19458960 . S2CID 21167767 .
- ^ Скеггс Л.Т., Кан младший, Шамуэй, Н.П. (март 1956 г.). «Приготовление и функция гипертензинпревращающего фермента» . Журнал экспериментальной медицины . 103 (3): 295–299. дои : 10.1084/jem.103.3.295 . ПМК 2136590 . ПМИД 13295487 .
- ^ Кирзенбаум, Авраам Л. (2007). Гистология и клеточная биология: введение в патологию . Мосби Эльзевир. ISBN 978-0-323-04527-8 .
Дальнейшее чтение
[ редактировать ]- Ню Т, Чен X, Сюй X (2002). «Полиморфизм вставки/делеции гена ангиотензинпревращающего фермента и сердечно-сосудистые заболевания: терапевтические последствия». Наркотики . 62 (7): 977–993. дои : 10.2165/00003495-200262070-00001 . ПМИД 11985486 . S2CID 46986772 .
- Roĭtberg GE, Tikhonravov AV, Dorosh ZV (2004). "Rol' polimorfizma gena angiotenzinprevrashchaiushchego fermenta v razvitii metabolicheskogo sindroma" [Role of angiotensin-converting enzyme gene polymorphism in the development of metabolic syndrome]. Terapevticheskii Arkhiv (in Russian). 75 (12): 72–77. PMID 14959477 .
- Виноградова С.В. (2005). «[Роль полиморфизма гена ангиотензинпревращающего фермента I/D в развитии метаболических нарушений у больных с сердечно-сосудистой патологией]». Цитология и генетика . 39 (1): 63–70. ПМИД 16018179 .
- Кениг С., Люгер Т.А., Шольцен Т.Е. (октябрь 2006 г.). «Мониторинг нейропептид-специфических протеаз: обработка пептидов проопиомеланокортина, адренокортикотропина и альфа-меланоцитстимулирующего гормона в коже» . Экспериментальная дерматология . 15 (10): 751–761. дои : 10.1111/j.1600-0625.2006.00472.x . ПМИД 16984256 . S2CID 32034934 .
- Саббах А.С., Отрок З.К., Махфуд З.Р., Заатари Г.С., Махфуз Р.А. (март 2007 г.). «Полиморфизм генов ангиотензинпревращающего фермента и частоты аллелей в населении Ливана: распространенность и обзор литературы». Отчеты по молекулярной биологии . 34 (1): 47–52. дои : 10.1007/s11033-006-9013-y . ПМИД 17103020 . S2CID 9939390 .
- Кастельон Р., Хамди Х.К. (2007). «Демистификация полиморфизма ACE: от генетики к биологии». Текущий фармацевтический дизайн . 13 (12): 1191–1198. дои : 10.2174/138161207780618902 . ПМИД 17504229 .
- Лазартиг Э., Фэн Ю., Лавуа Дж.Л. (2007). «Два лица тканевой ренин-ангиотензиновой системы: влияние на сердечно-сосудистые заболевания». Текущий фармацевтический дизайн . 13 (12): 1231–1245. дои : 10.2174/138161207780618911 . ПМИД 17504232 .
Внешние ссылки
[ редактировать ]- Proteopedia Angiotensin-converting_enzyme – структура ангиотензинпревращающего фермента в интерактивном 3D
- Ангиотензин+превращающий+фермент в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- человека ACE Расположение генома и страница сведений о гене ACE в браузере генома UCSC .