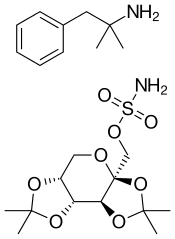
Фентермин/топирамат
 | |
| Сочетание | |
|---|---|
| Фентермин | Подавитель / стимулятор аппетита класса амфетаминов и фенэтиламинов . |
| Топирамат | Противосудорожное средство (используется форма пролонгированного действия) |
| Клинические данные | |
| Произношение | / k juː s ɪ ˈ m iː ə / kew -sim- EE to |
| Торговые названия | Ксимия |
| AHFS / Drugs.com | Профессиональные факты о наркотиках |
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| КЕГГ | |
| Панель управления CompTox ( EPA ) | |
| (проверять) | |
Фентермин/топирамат , продаваемый под торговой маркой Qsymia , представляет собой комбинированный препарат фентермина используемый и топирамата, для лечения ожирения . [ 1 ] Он используется вместе с диетическими изменениями и физическими упражнениями. [ 2 ] Если через 3 месяца наблюдается потеря веса менее 3%, рекомендуется прекратить прием препарата. [ 2 ] Потеря веса скромная. [ 2 ] Влияние на проблемы со здоровьем, связанные с сердцем, или смерть неясно. [ 2 ]
Общие побочные эффекты включают покалывание, головокружение, проблемы со сном и запор. [ 2 ] Серьезные побочные эффекты могут включать самоубийство , жестокое обращение . [ 2 ] Использование не рекомендуется во время беременности . [ 1 ] Фентермин является стимулятором и средством подавления аппетита . [ 2 ] Топирамат — противосудорожное средство , имеющее побочные эффекты для снижения веса. [ 2 ] Точный механизм действия обоих препаратов неизвестен. [ 2 ]
Фентермин/топирамат был одобрен для медицинского применения в США в 2012 году. [ 2 ] В октябре 2012 года в Европе было отказано в одобрении из-за опасений по поводу безопасности. [ 3 ] [ 4 ] [ 5 ]
Медицинское использование
[ редактировать ]В клинических испытаниях люди, получавшие самую высокую дозу фентермина/топирамата ER в сочетании с программой диеты и физических упражнений, потеряли от 10% до 11% массы тела по сравнению с 1%-2% у тех, кто получал плацебо. [ 2 ] Кроме того, от 62% до 70% субъектов, получавших рекомендованную дозу или максимальную дозу фентермина/топирамата ER, достигли снижения веса на ≥5% к 56 неделе (ITT-LOCF) по сравнению с 17%-21% пациентов, получавших плацебо . [ 2 ]
Кокрейновский обзор долгосрочного воздействия препаратов для снижения веса на людей с гипертонией показал, что фентермин/топирамат снижает массу тела (по сравнению с орлистатом и налтрексоном/бупропионом ), а также снижает кровяное давление. [ 4 ]
Побочные эффекты
[ редактировать ]В клинических исследованиях наиболее распространенными нежелательными явлениями, которые встречались с частотой ≥5% и в ≥1,5 раза чаще, чем у плацебо, были парестезия (покалывание в пальцах рук/ног), головокружение, изменение вкуса , бессонница , запор и сухость во рту . [ 2 ]
В США на этикетке препарата содержатся предупреждения об увеличении частоты сердечных сокращений, суицидальном поведении и мыслях, глаукоме, расстройствах настроения и сна, повышении уровня креатинина и метаболическом ацидозе. Некоторые из этих предупреждений основаны на исторических наблюдениях за пациентами с эпилепсией, принимавшими топирамат. FDA требует от компании провести пострегистрационное исследование сердечно-сосудистых последствий, отчасти из-за наблюдения увеличения частоты сердечных сокращений у некоторых людей, принимавших препарат в ходе клинических испытаний.
Беременность
[ редактировать ]Фентермин и топирамат могут нанести вред плоду. Данные регистров беременности и эпидемиологических исследований показывают, что плод, подвергшийся воздействию топирамата в первом триместре беременности, имеет повышенный риск развития расщелины полости рта (расщелины губы с расщелиной неба или без нее). [ 2 ] Если пациентка забеременела во время приема фентермина/топирамата ER, лечение следует немедленно прекратить и проинформировать пациентку о потенциальной опасности для плода. Женщины репродуктивного потенциала должны иметь отрицательный тест на беременность перед началом терапии фентермином/топираматом ER и в дальнейшем ежемесячно во время терапии фентермином/топираматом ER. Женщинам репродуктивного потенциала следует использовать эффективные методы контрацепции во время терапии фентермином/топираматом ER. [ 2 ]
Стратегия оценки и смягчения рисков
[ редактировать ]Фентермин и топирамат были одобрены в рамках программы оценки и смягчения рисков (REMS), чтобы гарантировать, что польза от лечения перевешивает риски. [ 6 ]
Противопоказания
[ редактировать ]Фентермин/топирамат ER противопоказан при беременности, глаукоме, гипертиреозе, во время или в течение 14 дней после приема ингибиторов моноаминоксидазы, а также у пациентов с гиперчувствительностью или идиосинкразией к симпатомиметическим аминам. Фентермин/топирамат ER может вызвать увеличение частоты сердечных сокращений в состоянии покоя. [ 2 ]
История
[ редактировать ]Фентермин и топирамат были разработаны Vivus калифорнийской фармацевтической компанией .
В декабре 2009 года компания Vivus, Inc. подала новую заявку на лекарство в FDA (NDA), а 1 марта 2010 года Vivus, Inc. объявила, что FDA приняло соглашение о неразглашении на рассмотрение.
В октябре 2010 года FDA объявило о своем решении не одобрять фентермин/топирамат ER в его нынешней форме и направило Vivus письмо с полным ответом из- за отсутствия долгосрочных данных и опасений по поводу побочных эффектов, включая повышенную частоту сердечных сокращений, серьезные неблагоприятные сердечно-сосудистые события. и врожденные дефекты. [ 7 ]
В январе 2011 года FDA выразило обеспокоенность по поводу того, что фентермин / топирамат ER может вызывать врожденные дефекты, и потребовало, чтобы компания Vivus оценила возможность анализа существующих медицинских баз данных для определения исторической частоты расщелины рта у потомков женщин, получавших топирамат для профилактики мигрени. (100 мг). [ 8 ]
В октябре 2011 года Vivus повторно представила NDA в FDA с ответами на вопросы, затронутые в CRL, и FDA приняло NDA в ноябре 2011 года. [ 9 ] [ 10 ]
В сентябре 2012 года Qsymia стала доступна на рынке США. [ 11 ]
В октябре 2012 года в Европейском Союзе было отказано в одобрении из-за опасений по поводу безопасности. [ 3 ] [ 4 ] [ 5 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б «Применение фентермина и топирамата, побочные эффекты и предупреждения» . Наркотики.com . Проверено 13 апреля 2019 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п «DailyMed - Qsymia - капсулы с фентермином и топираматом пролонгированного действия» . dailymed.nlm.nih.gov . Проверено 13 апреля 2019 г.
- ^ Jump up to: а б «www.ema.europa.eu» (PDF) . Архивировано из оригинала (PDF) 21 декабря 2014 года.
- ^ Jump up to: а б с Зибенхофер А., Винтерхолер С., Джейтлер К., Хорват К., Бергхольд А., Кренн С. и др. (январь 2021 г.). «Долгосрочные эффекты препаратов для снижения веса у людей с гипертонией» . Кокрановская база данных систематических обзоров . 1 (1): CD007654. дои : 10.1002/14651858.CD007654.pub5 . ПМЦ 8094237 . ПМИД 33454957 .
- ^ Jump up to: а б «Ксива» . ЭМА . 13 июня 2013 г.
- ^ «Vivus, Inc. – Vivus объявляет об одобрении FDA капсул Qsymia (фентермин и топирамат расширенного выпуска) для приема один раз в день» . Ir.vivus.com . Проверено 19 июня 2014 г.
- ^ «Vivus, Inc. — FDA направило компании Vivus полное ответное письмо относительно заявки на новый препарат для QNEXA(R)» . Ir.vivus.com . Проверено 19 июня 2014 г.
- ^ «Vivus сообщает, что FDA спрашивает о связи Qnexa с врожденным дефектом» . БизнесУик. 21 января 2011 года. Архивировано из оригинала 28 июня 2011 года . Проверено 19 июня 2014 г.
- ^ «Vivus, Inc. – Vivus повторно представляет Qnexa NDA в FDA» . Ir.vivus.com . Проверено 19 июня 2014 г.
- ^ «Vivus, Inc. – FDA принимает заявку на новое лекарство для Qnexa» . Ir.vivus.com . Проверено 19 июня 2014 г.
- ^ «Vivus, Inc. — Vivus объявляет о доступности капсул Qsymia (фентермин и топирамат расширенного выпуска) один раз в день» . Ir.vivus.com . Проверено 19 июня 2014 г.