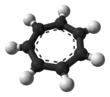
Катион тропилия
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
Циклогептатриенилий [ 3 ] | |||
| Другие имена | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 1902352 [ 1 ] | |||
| ХимическийПаук | |||
ПабХим CID
|
|||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 7 ч. + 7 [ 2 ] | |||
| Молярная масса | 91.132 g·mol −1 | ||
| Структура | |||
| Д 7ч. | |||
| правильный семиугольник | |||
| Родственные соединения | |||
Другие анионы
|
Тетрафторборат тропилия | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Ион тропилия или циклогептатриенильный катион представляет собой ароматическое соединение с формулой [C 7 H 7 ] + . [ 4 ] Его название происходит от молекулы тропина , из которой в 1881 году был впервые синтезирован циклогептатриен (тропилиден). Соли катиона тропилия могут быть стабильными даже с нуклеофилами умеренной силы, например, тетрафторборатом тропилия и бромидом тропилия ( см. ниже ). Его бромидные и хлоридные соли [ 5 ] может быть получен из циклогептатриена и пентахлорида брома или фосфора соответственно. [ 6 ]
Это правильный семиугольный , планарный, циклический ион. Он имеет 6 π-электронов (4 n + 2, где n = 1), что соответствует Хюккеля правилу ароматичности . Он может координировать свои действия как лиганд с металлов атомами . Показанная структура представляет собой совокупность семи резонансных вкладчиков , в которых каждый атом углерода несет часть положительного заряда.
История
[ редактировать ]В 1891 Г. Мерлинг получил водорастворимое бромсодержащее соединение реакцией циклогептатриена и брома . [ 7 ] В отличие от большинства алкилбромидов, это соединение, позже названное тропилиум бромидом, растворимо в воде, но нерастворимо во многих органических растворителях. Его очищают кристаллизацией из горячего этанола. Реакция с водным раствором нитрата серебра сразу же дает бромид серебра, что указывает на лабильный бромид. Было установлено, что бромид тропилия представляет собой соль C.
7 ч. +
77Бр −
, Дерингом и Ноксом в 1954 году путем анализа его инфракрасного и ультрафиолетового спектров. [ 8 ] [ 9 ] Ионные структуры перхлората тропилия ( C
7 ч. +
7 ClO −
4 ) и йодид тропилия ( C
7 ч. +
77Я −
) были подтверждены методом рентгеновской кристаллографии . [ 10 ] Длина связей углерод-углерод длиннее (147 пм), чем у бензола (140 пм), но все же короче, чем у типичных веществ с одинарной связью, таких как этан (154 пм).
Кислотность
[ редактировать ]Ион тропилия представляет собой кислоту в водном растворе (т. е. кислоту Аррениуса ) вследствие своей кислотности по Льюису: он сначала действует как кислота Льюиса, образуя аддукт с водой, который затем может отдать протон другой молекуле воды. следовательно, косвенно действует как кислота Аррениуса:
- С
7 ч. +
7 + 2 ч.
2 О ⇌ С
7 ч.
7ОН + Н
33О +
( Борная кислота дает кислые водные растворы примерно таким же образом.) Константа равновесия равна 1,8 × 10. −5 , что делает ее в воде такой же кислой, как и уксусная кислота . [ 8 ]
Масс-спектрометрия
[ редактировать ]Ион тропилия часто встречается в масс-спектрометрии в виде сигнала при m / z = 91 и используется в масс-спектральном анализе . Этот фрагмент часто встречается у ароматических соединений, содержащих бензильное звено. При ионизации бензильный фрагмент образует катион ( PhCH +
2 ), который перегруппировывается в высокостабильный катион тропилия ( C
7 ч. +
7 ). [ 11 ]
Реакции
[ редактировать ]Катион тропилия реагирует с нуклеофилами с образованием замещенных циклогептатриенов, например: [ 12 ]
- С
7 ч. +
7 + CN −
→ С
7 ч.
77CN
Восстановление алюмогидридом лития дает циклогептатриен . [ 12 ]
Реакция с циклопентадиенидной солью натрия или лития дает 7-циклопентадиенилциклогепта-1,3,5-триен : [ 12 ]
- С
7 ч. +
77X −
+ С
55Ч −
5 На +
→ С
7 ч.
77С
55Ч
5 + НаХ
При обработке окислителями, такими как хромовая кислота , катион тропилия перегруппировывается в бензальдегид : [ 12 ]
- С
7 ч. +
7 + HCrO −
4 → С
66Ч
5 СНО + КрО
2 + Ч
22О
Известны многие металлокомплексы тропилий-иона. Одним из примеров является [Mo( η 7 -C7H7 ( ) CO ) 3 ] + , который получают путем отделения гидрида от трикарбонила циклогептатриенмолибдена . [ 13 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г «тропилий | ChemSpider» . www.chemspider.com . п. Имена . Проверено 30 декабря 2018 г.
тропилий
- ^ Jump up to: а б с д и ж «Тропилий» . pubchem.ncbi.nlm.nih.gov . Проверено 30 декабря 2018 г.
Химические названия: Тропилий; Циклогептатриенилий; Цикл- C
7 ч. +
7 ; Циклогепта-2,4,6-триенилий - ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 1127. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Молекула ». два : 10.1351/goldbook.M04002
- ^ Смесь [C 7 H 7 ] + кл. − и [C 7 H 7 ] + [ ПКл −
6 ] получают обработкой тропилидена пентахлоридом фосфора. - ^ Органический синтез фторбората тропилия , Сб. Том. 5, с.1138 (1973); Том. 43, с.101 (1963). ссылка. Архивировано 29 августа 2012 г. на Wayback Machine.
- ^ Мерлинг, Г. (1891). «О Тропине». Отчеты Немецкого химического общества . 24 (2): 3108–3126. дои : 10.1002/cber.189102402151 .
- ^ Jump up to: а б Эггерс Деринг, В. фон; Нокс, Л.Х. (1954). «Ион циклогептатриенилия (тропилия)». Дж. Ам. хим. Соц . 76 (12): 3203–3206. дои : 10.1021/ja01641a027 .
- ^ Балабан Александру Т.; Оничу, Даниэла К.; Катрицки, Алан Р. (2004). «Ароматичность как краеугольный камень гетероциклической химии». хим. Преподобный . 104 (5): 2777–2812. дои : 10.1021/cr0306790 . ПМИД 15137807 .
- ^ Китайгородский А.И.; Стручков, Ю. Т.; Хоцянова, Т.Л.; Вольпин, Мэн; Курсанов, Д. Н. (1960). «Кристаллические структуры перхлората и иодида тропилия». Вестник Отделения химических наук АН СССР . 9 (1): 32–36. дои : 10.1007/bf01178699 . ISSN 0568-5230 .
- ^ Лифшиц, Хава (1994). «Образование ионов тропилия из толуола: решение старой проблемы органической масс-спектрометрии». Отчеты о химических исследованиях . 27 (5): 138–144. дои : 10.1021/ar00041a004 .
- ^ Jump up to: а б с д ОП Агарвай (2009). Реакции и реагенты (46-е изд.). Кришна Пракашан Медиа. стр. 614–615. ISBN 978-81-87224-65-5 .
- ^ Грин, Малкольм Л.Х.; Нг, Деннис КП (1995). «Циклогептатриен и -енильные комплексы ранних переходных металлов». Химические обзоры . 95 (2): 439–473. дои : 10.1021/cr00034a006 .