правило Марковникова
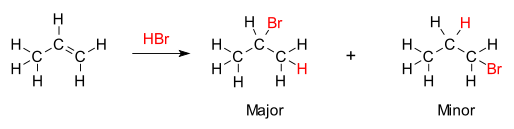
В органической химии правило Марковникова или правило Марковникова описывает результат некоторых реакций присоединения . Правило было сформулировано русским химиком Владимиром Марковниковым в 1870 году. [ 1 ] [ 2 ] [ 3 ]
Объяснение
[ редактировать ]Правило гласит, что при добавлении протонной кислоты HX или другого полярного реагента к асимметричному алкену кислый водород (H) или электроположительная часть присоединяется к углероду с большим количеством водородных заместителей, а галогенидная группа (X) или электроотрицательная часть присоединяется к углероду с большим количеством алкильных заместителей. Это контрастирует с первоначальным определением Марковникова, в котором утверждается правило, согласно которому компонент X добавляется к углероду с наименьшим количеством атомов водорода, а атом водорода добавляется к углероду с наибольшим числом атомов водорода. [ 4 ]

То же самое верно, когда алкен реагирует с водой в реакции присоединения с образованием спирта, которая включает образование карбокатионов. Гидроксильная группа (ОН) связывается с углеродом, который имеет большее количество углерод-углеродных связей, а водородная связь с углеродом на другом конце двойной связи, который имеет больше углерод-водородных связей.
Химической основой правила Марковникова является образование наиболее стабильного карбокатиона в процессе присоединения. Присоединение иона водорода к одному атому углерода в алкене создает положительный заряд на другом углероде, образуя промежуточный карбокатион. Чем более замещен карбокатион, тем он более стабилен за счет индукции и гиперконъюгации . Основным продуктом реакции присоединения будет продукт, образующийся из более стабильного промежуточного продукта. Следовательно, основной продукт присоединения HX (где X — некоторый атом более электроотрицательный, чем H) к алкену имеет атом водорода в менее замещенном положении, а атом X — в более замещенном положении. Но другой, менее замещенный и менее стабильный карбокатион все равно будет образовываться при некоторой концентрации и станет второстепенным продуктом с противоположным, сопряженным присоединением X.
Антимарковниковская реакция
[ редактировать ]Эти реакции, также называемые эффектом Хараша (названные в честь Морриса С. Хараша ), эти реакции, которые не включают промежуточный карбокатион, могут реагировать посредством других механизмов, которые имеют региоселективность, не диктуемую правилом Марковникова, например, присоединение свободных радикалов . Такие реакции называются антимарковниковскими , поскольку галоген присоединяется к менее замещенному углероду, что противоположно реакции Марковникова.
Правило антимарковникова можно проиллюстрировать на примере присоединения бромистого водорода к изобутилену в присутствии перекиси бензоила или перекиси водорода. Реакция HBr с замещенными алкенами является прототипом при изучении свободнорадикальных присоедине- ний. Ранние химики обнаружили, что причина изменчивости соотношения продуктов реакции Марковникова и продуктов антимарковниковской реакции связана с неожиданным присутствием ионизирующих веществ свободных радикалов, таких как пероксиды. Объяснение состоит в том, что связь ОО в пероксидах относительно слаба. С помощью света, тепла, а иногда и просто под действием самого по себе, связь ОО может расщепиться с образованием двух радикалов . Затем радикальные группы могут взаимодействовать с HBr с образованием радикала Br, который затем реагирует с двойной связью. Поскольку атом брома относительно велик, он с большей вероятностью встретится и прореагирует с наименее замещенным углеродом, поскольку это взаимодействие вызывает меньше статических взаимодействий между углеродом и радикалом брома. Более того, подобно положительно заряженным частицам, радикальные частицы наиболее стабильны, когда неспаренный электрон находится в более замещенном положении. Радикальный промежуточный продукт стабилизируется гиперконъюгация . В более замещенном положении больше углерод-водородных связей ориентировано на электронодефицитную молекулярную орбиталь радикала. Это означает, что эффекты гиперконъюгации сильнее, поэтому положение более благоприятно. [ 5 ] В этом случае концевой углерод представляет собой реагент, который производит первичный продукт присоединения вместо вторичного продукта присоединения.


Новый метод антимарковниковского присоединения был описан Гамильтоном и Ницевичем, которые использовали ароматические молекулы и энергию света низкоэнергетического диода, чтобы превратить алкен в катион-радикал. [ 6 ] [ 7 ]
Антимарковниковское поведение распространяется на большее количество химических реакций, чем на присоединение к алкенам. Антимарковниковское поведение наблюдается при гидратации фенилацетилена ацетофенона посредством аурового катализа с образованием ; хотя и со специальным рутениевым катализатором [ 8 ] он дает другой региоизомер 2-фенилацетальдегид : [ 9 ]

Антимарковниковское поведение может проявляться и в определенных реакциях перегруппировки . При катализируемом хлоридом титана(IV) формальном нуклеофильном замещении, при энантиочистоте 1 на схеме ниже, образуются два продукта – 2a и 2b. Благодаря двум хиральным центрам в целевой молекуле: углероду, несущему хлор, и углероду, несущему метил и ацетоксиэтильной группы, должны быть образованы четыре различных соединения: 1R,2R- (обозначено 2b) 1R,2S- 1S,2R- (обозначено как 2а) и 1S,2S-. Следовательно, обе изображенные структуры будут существовать в D- и L-форме. : [ 10 ]

Такое распределение продуктов можно объяснить, предположив, что потеря гидроксигруппы 1 приводит к образованию третичного карбокатиона A , который перегруппировывается в, по-видимому, менее стабильный вторичный карбокатион B. в Хлор может приближаться к этому центру с двух сторон, что приводит к наблюдаемой смеси изомеров.
Еще одним ярким примером антимарковниковского присоединения является гидроборирование .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ В. Марковников (1870). «О зависимости различных замещений радикала водорода в изомерных масляных кислотах» . Анналы химии . 153 (1): 228–259. дои : 10.1002/jlac.18701530204 .
- ^ Хьюз, Питер (2006). «Было ли правило Марковникова вдохновенной догадкой?». Журнал химического образования . 83 (8): 1152. Бибкод : 2006JChEd..83.1152H . дои : 10.1021/ed083p1152 .
- ^ Льюис, Дэвид Э. (2021). «Логика правила Марковникова: была ли это вдохновенная догадка?… Нет!». Angewandte Chemie, международное издание . 60 (9): 4412–4421. дои : 10.1002/anie.202008228 . S2CID 230570680 .
- ^ Макмерри, Джон. «Раздел 7.8: Направление электрофильных реакций: правило Марковникова». Органическая химия (8-е изд.). п. 240. ИСБН 9780840054548 .
- ^ Клейден, Джонатан (2012). Органическая химия . Издательство Оксфордского университета. стр. 977, 985.
- ^ Драл, Кармен. «Световая реакция изменяет двойные связи с нетрадиционной селективностью - выпуск от 15 апреля 2013 г. - том 91, выпуск 15 - Новости химии и техники» . cen.acs.org .
- ^ Гамильтон, Дэвид С.; Ницевич, Дэвид А. (2012). «Прямая каталитическая антимарковниковская гидроэтерификация алкенолов» . Журнал Американского химического общества . 134 (45): 18577–18580. дои : 10.1021/ja309635w . ПМЦ 3513336 . ПМИД 23113557 .
- ^ каталитическая система, основанная на in-situ реакции рутеноцена с Cp и нафталиновыми лигандами и вторым объемистым пиридиновым лигандом.
- ^ Лабонн, Орели; Криббер, Томас; Хинтерманн, Лукас (2006). «Высокоактивные in situ катализаторы антимарковниковской гидратации терминальных алкинов». Органические письма . 8 (25): 5853–6. дои : 10.1021/ol062455k . ПМИД 17134289 .
- ^ Нисидзава, Мугио; Асаи, Юмико; Имагава, Хироши (2006). « TiCl 4 Антимарковниковская перегруппировка, индуцированная ». Органические буквы 8 (25): 5793–6. дои : 10.1021/ol062337x . ПМИД 17134274 . .
Внешние ссылки
[ редактировать ]- Правило Марковникова и карбокатионы – Академия Хана . 25 августа 2010 г.