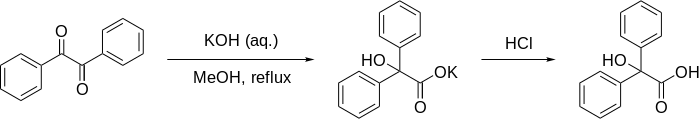
Перегруппировка бензиловой кислоты
Перегруппировка бензиловой кислоты формально представляет собой 1,2-перегруппировку 1,2- дикетонов с образованием α- гидрокси - карбоновых кислот с использованием основания . Эта реакция получила свое название от реакции бензила с гидроксидом калия с образованием бензиловой кислоты . Впервые исполнено Юстусом фон Либихом в 1838 году. [1] это первый зарегистрированный пример реакции перегруппировки . [2] Она стала классической реакцией органического синтеза и неоднократно рассматривалась ранее. [3] [4] [5] Ее можно рассматривать как внутримолекулярную окислительно-восстановительную реакцию, когда один углеродный центр окисляется, а другой восстанавливается.
Было показано, что реакция работает с ароматическими , полуароматическим, алифатическими и гетероциклическими субстратами. Реакция протекает лучше всего, когда функциональные группы кетонов не имеют соседних енолизируемых протонов, поскольку это позволяет альдольной конденсации конкурировать . Формально реакция представляет собой сжатие кольца при использовании циклических дикетонов. Было обнаружено, что арильные группы мигрируют легче, чем алкильные группы, и что арильные группы с электроноакцепторными группами мигрируют быстрее всего.
Механизм реакции
[ редактировать ]Реакция является представителем 1,2-перегруппировок. Давно установленный механизм реакции был впервые полностью предложен Кристофером Келком Ингольдом и дополнен in silico. данными [6] как указано ниже. В целом по скорости реакция имеет второй порядок: первый порядок по дикетону и первый порядок по основанию.
Гидроксид - анион атакует одну из кетоновых групп в 1 в результате нуклеофильного присоединения с образованием алкоксида 2 . Следующий шаг требует поворота связи к конформеру 3 , что помещает мигрирующую группу R в положение для атаки на вторую карбонильную группу. На согласованной стадии мигрирующая группа R атакует α-карбонильную группу, образуя другой алкоксид с одновременным образованием кетогруппы у другого углерода. Этот этап миграции является определяющим . Эта последовательность напоминает нуклеофильную ацильную замену . Расчеты показывают, что когда R представляет собой метил, накопление заряда этой группы в переходном состоянии может достигать 0,22 и что метильная группа располагается между центральной связью углерод-углерод.

Карбоновая кислота в промежуточном соединении 4 является менее основной, чем алкоксид, и поэтому происходит обратимый перенос протона в пользу промежуточного соединения 5 , которое протонируется при кислотной обработке до конечной α- гидрокси - карбоновой кислоты 6 . Расчеты показывают, что точное описание последовательности реакции возможно при участии 4 молекул воды, принимающих на себя ответственность за стабилизацию накопления заряда. Они также обеспечивают челнок для эффективного переноса одного протона при образовании интермедиата 5 .
Вышеописанный механизм согласуется со всеми имеющимися экспериментальными данными. [3] Равновесие видами между 1 и 2 поддерживается 18 O Эксперименты по мечению изотопов . В дейтерированной воде обмен карбонильного кислорода происходит намного быстрее, чем перегруппировка, что указывает на то, что первое равновесие не является стадией, определяющей скорость. Дальнейшие эксперименты показали более высокую относительную скорость в системе дейтерированных растворителей по сравнению с системой недейтерированных растворителей идентичного в остальном состава. Это было объяснено более высокой относительной основностью дейтерированного гидроксид-аниона по сравнению с обычным гидроксид-анионом и использовалось для указания на то, что миграция водорода не происходит на стадии, определяющей скорость реакции. Это исключало согласованный механизм реакции, поскольку перенос водорода происходил бы на стадии определения скорости.
Вариации
[ редактировать ]Перегруппировка бензилового эфира
[ редактировать ]Эта реакция идентична обычной перегруппировке бензиловой кислоты, за исключением того, что вместо гидроксид-иона используется алкоксид или амид-анион. Используемый алкоксид не должен легко окисляться (например, этоксид калия ), поскольку это благоприятствует пути восстановления Меервейна-Понндорфа-Верли в качестве побочной реакции. Реакция имеет второй порядок по скорости: первый порядок по алкоксиду и первый порядок по дикетону. Продуктом реакции является α гидроксиэфир - или α - гидроксиамид .
Перегруппировка альфа-кетола
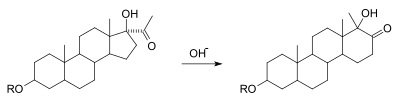
[ редактировать ]Перегруппировка альфа-кетола представляет собой взаимное превращение альфа-гидроксила в карбонил с образованием дополнительных карбонильных и гидроксильных групп с миграцией заместителя. Механически это эквивалентно перегруппировке бензиловой кислоты в момент, когда нуклеофил атакует 1,2-дикарбонил. Известно, что этот вариант реакции происходит во многих субстратах, несущих функциональную группу ацилоина . На рисунке ниже показано расширение циклопентана до циклогексанового кольца в качестве примера реакции. [7] [8]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Либих, Дж. (1838). «К теории органических соединений Лорана» . Анналы химии . 25 :1–31. дои : 10.1002/jlac.18380250102 .
- ^ « Прекурсоры нервно-паралитического действия: бензиловая кислота и метилбензилат », Информационные бюллетени по химическим и биологическим боевым агентам, Химические прекурсоры.
- ^ Jump up to: а б Селман, С.; Истхэм, Дж. (1960). «Бензиловая кислота и родственные перегруппировки». Q. Преподобный Chem. Соц . 14 (3): 221–235. дои : 10.1039/qr9601400221 .
- ^ Боуден, К.; Фабьен, WMF (2001). «Реакции карбонильных соединений в основных растворах. Часть 36: Реакции 1,2-дикарбонильных соединений, катализируемые основаниями». Дж. Физ. Орг. Хим . 14 (11): 794–796. дои : 10.1002/poc.433 .
- ^ Гилл, Великобритания (1961). «Перегруппировки бензилбензиловой кислоты». Комп. Орг. Синтез . 3 : 821–838.
- ^ Шиничи Ямабе; Норико Цучида и Сёко Ямадзаки (2006). «Путь реакции, контролируемый FMO, при перегруппировке бензил-бензиловой кислоты». Дж. Орг. хим. 71 (5): 1777–1783. дои : 10.1021/jo051862r . ПМИД 16496961 .
- ^ О стероидах и половых гормонах. 48. Обратите внимание. Превращение производных 17-этиниландростена в производные прегненона. Производство 17-окси-прогестерона Helvetica Chimica Acta Том 21, Выпуск 1, Дата: 1938 г. , Страницы: 1760–1770 Л. Ружичка , Х. Ф. Мелдал два : 10.1002/hlca.193802101214
- ^ О стероидах и половых гормонах. (51-е сообщение). Производство неопрегненолона из 5-3,17-диоксипрегненона-(20) Helvetica Chimica Acta Том 22, Выпуск 1, Дата: 1939 г. , Страницы: 421–424 Л. Ружичка, Х. Ф. Мелдал два : 10.1002/hlca.19390220155