Энол
В органической химии алкены ( сокращенно енолы ) — тип реакционноспособной структуры или промежуточного соединения в органической химии , который представлен в виде алкена ( олефина ) с гидроксильной группой алкена , присоединенной к одному концу двойной связи ( С=С-ОН ). Термины енол и алкенол представляют собой производные от «-ен» / «алкен» и суффикса «-ол», обозначающего гидроксильную группу спиртов , без концевого «-е» первого термина. Образование енолов часто включает депротонирование в α -положении карбонильной группы , т. е. удаление водорода там атома в виде протона. ЧАС + . Если этот протон не возвращается в конце поэтапного процесса, в результате образуется анион , называемый енолятом (см. изображения справа). Показанные енолятные структуры схематичны; более современное представление рассматривает молекулярные орбитали , которые образуются и заняты электронами в еноляте. Подобным образом, образование енола часто сопровождается «захватом» или маскировкой гидроксильной группы в виде простого эфира, такого как эфир силиленола . [1]
Кето-енольная таутомерия относится к химическому равновесию между «кето»-формой ( карбонилом , названным в честь обычного кетона ) и енолом. Взаимное превращение двух форм включает перенос альфа-атома водорода и реорганизацию связывающих электронов . Кето- и енольная формы являются таутомерами друг друга. [2]
Энолизация
[ редактировать ]Органические сложные эфиры , кетоны и альдегиды с α-водородом ( Связь C-H , соседняя с карбонильной группой ) часто образует енолы. Реакция включает миграцию протона ( H ) от углерода к кислороду: [1]
- RC(=O)C H R′R′′ ⇌ RC(O H )=CR′R′′
В случае кетонов превращение называется кето-енольной таутомерией, хотя это название часто применяется ко всем таким таутомеризациям в более общем смысле. Обычно константа равновесия настолько мала, что енол не обнаруживается спектроскопически.
В некоторых соединениях с двумя (или более) карбонилами преобладает енольная форма. Поведение 2,4-пентандиона иллюстрирует этот эффект: [3]
| карбонил | енол | Кенолизация |
|---|---|---|
| ацетальдегид CH 3 ДЛЯ | СН 2 =СНОН | 5.8 × 10 −7 |
| Ацетон СН3С ) (О СН3 | СН 3 С(ОН)=СН 2 | 5.12 × 10 −7 |
| Метилацетат СН 3 СО 2 СН 3 | СН 2 =СН(ОН)ОСН 3 | 4 × 10 −20 |
| Ацетофенон C6H5C ) О ( CH3 | С 6 Н 5 С(ОН)=СН 2 | 1 × 10 −8 |
| Ацетилацетон СН 3 С(О)СН 2 С(О)СН 3 | CH3C ) (O)CH=C(OH CH3 | 0.27 |
| Трифторацетилацетон СН 3 С(О)СН 2 С(О)CF 3 | СН 3 С(О)СН=С(ОН)CF 3 | 32 |
| Гексафторацетилацетон CF 3 C(O)CH 2 C(O)CF 3 | CF 3 C(O)CH=C(OH)CF 3 | ~10 4 |
| Циклогекса-2,4-диенон | Фенол С 6 Н 5 ОН | >10 12 |
Енолы – производные винилового спирта . C=C-OH Связность . Депротонирование органических карбонилов дает енолят-анионы , которые являются сильными нуклеофилами . Классический пример предпочтения кето-формы можно увидеть в равновесии между виниловым спиртом и ацетальдегидом (K = [енол]/[кето] ≈ 3 × 10 −7 ). В 1,3-дикетонах , таких как ацетилацетон (2,4-пентандион), предпочтительна енольная форма.
Катализируемое кислотой превращение енола в кето-форму протекает путем переноса протона от О к углероду. Процесс не происходит внутримолекулярно, а требует участия растворителя или других медиаторов.
Стереохимия кетонизации
[ редактировать ]Если Р 1 и Р 2 (примечание к уравнению вверху страницы) представляют собой разные заместители, в альфа-положении образуется новый стереоцентр, когда енол превращается в свою кето-форму. В зависимости от природы трех групп R полученные продукты в этой ситуации будут диастереомерами или энантиомерами . [ нужна ссылка ]
Энедиолы
[ редактировать ]Энедиолы – это алкены с гидроксильной группой на каждом атоме углерода двойной связи C=C. Обычно такие соединения являются нежелательными компонентами в равновесии с ацилоинами . Особым случаем является катехол , где субъединица C=C является частью ароматического кольца. Однако в некоторых других случаях эндиолы стабилизируются фланкирующими карбонильными группами. Эти стабилизированные эндиолы называются редуктонами . Такие виды важны в гликохимии, например, трансформация Лобри де Брюйна-ван Экенштейна . [5]

Кето-эндиоловые таутомеризации. Энедиол в центре; изомеры ацилоина слева и справа. Бывший. представляет собой гидроксиацетон , показан справа.
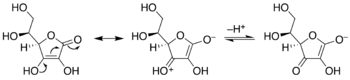
Рибулозо-1,5-бисфосфат ключевым субстратом цикла Кальвина фотосинтеза является . В цикле Кальвина рибулоза уравновешивается эндиолом, который затем связывает углекислый газ . Тот же эндиол также подвержен воздействию кислорода (O 2 ) в ходе (нежелательного) процесса, называемого фотодыханием .
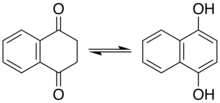
Фенолы
[ редактировать ]Фенолы представляют собой разновидность енолов. Для некоторых фенолов и родственных соединений важную роль играет кетотаутомер. Например, во многих реакциях резорцина участвует кетотаутомер. Нафталин-1,4-диол существует в наблюдаемом равновесии с дикетоном тетрагидронафталин-1,4-дионом. [6]
Биохимия
[ редактировать ]Кето-енольная таутомерия важна в нескольких областях биохимии . [ нужна ссылка ]
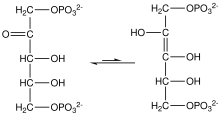
Высокий потенциал переноса фосфата фосфоенолпирувата обусловлен тем, что фосфорилированное соединение «захватывается» в менее термодинамически выгодную енольную форму, тогда как после дефосфорилирования оно может принять кето-форму. [ нужна ссылка ]
Фермент енолаза 2 катализирует дегидратацию -фосфоглицериновой кислоты до енолфосфатного эфира. Метаболизм PEP до пировиноградной кислоты под действием пируваткиназы (PK) приводит к образованию аденозинтрифосфата (АТФ) посредством фосфорилирования на уровне субстрата . [7]
 |  |  | ||||
| Н 2 О | АДП | СПС | ||||
 |  | |||||
| Н 2 О | ||||||
Реактивность
[ редактировать ]Добавление электрофилов
[ редактировать ]Конец двойной связи в енолах нуклеофильный . Его реакции с электрофильными органическими соединениями важны как в биохимии , так и в синтетической органической химии . В первом случае фиксация углекислого газа включает присоединение CO 2 к енолу. [ нужна ссылка ]
Депротонирование: еноляты
[ редактировать ]Депротонирование енолизируемых кетонов, альдегидов и сложных эфиров дает еноляты . [8] [9] Еноляты можно улавливать путем добавления электрофилов к кислороду. Силилирование дает эфир силилинола . [10] Ацилирование даетсложные эфиры, такие как винилацетат . [11]
Стабильные енолы
[ редактировать ]В целом енолы менее стабильны, чем их кето-эквиваленты, из-за преимущества двойной связи C=O над двойной связью C=C. Однако енолы можно стабилизировать кинетически или термодинамически. [ нужна ссылка ]
Некоторые енолы достаточно кинетически стабилизированы, чтобы их можно было охарактеризовать. [ нужна ссылка ]
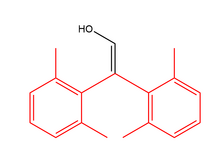
Делокализация может стабилизировать енольный таутомер. Таким образом, очень устойчивыми енолами являются фенолы . [13] Другим стабилизирующим фактором в 1,3-дикарбонилах являются внутримолекулярные водородные связи. [14] Оба эти фактора влияют на енол-дионовое равновесие в ацетилацетоне.
См. также
[ редактировать ]- Алкеналь
- Энолаза
- Кетон
- Назад
- Геминальный диол , еще одна форма кетонов и альдегидов в водных растворах.
- Региоселективность
Ссылки
[ редактировать ]- ^ Jump up to: а б Смит М.Б., Марч Дж. (2001). Продвинутая органическая химия (5-е изд.). Нью-Йорк: Wiley Interscience . стр. 1218–1223. ISBN 0-471-58589-0 .
- ^ Клейден, Джонатан; Гривз, Ник; Уоррен, Стюарт (2012). Органическая химия (2-е изд.). Нью-Йорк: Издательство Оксфордского университета. стр. 450–451. ISBN 978-0-19-927029-3 .
- ^ Манбек, Кимберли А.; Боаз, Николас К.; Баир, Натаниэль К.; Сандерс, Алликс М.С.; Марш, Андерсон Л. (2011). «Влияние заместителей на кето-енольное равновесие с использованием ЯМР-спектроскопии». Дж. Хим. Образование. 88 (10): 1444–1445. Бибкод : 2011ЖЧЭд..88.1444М . дои : 10.1021/ed1010932 .
- ^ Гатри, Дж. Питер; Повар, Игорь (2013). «Константы равновесия для енолизации в растворе только путем расчета». Журнал физической органической химии . 26 (12): 1077–1083. дои : 10.1002/poc.3168 .
- ^ Шанк, Курт (1972). «Редуктоны». Синтез . 1972 (4): 176–90. дои : 10.1055/s-1972-21845 . S2CID 260331550 .
- ^ Кюндиг, Э. Петер; Энрикес Гарсиа, Альваро; Ломберге, Тьерри; Бернардинелли, Джеральд (2006). «Повторное открытие, выделение и асимметричное восстановление 1,2,3,4-тетрагидронафталин-1,4-диона и исследование его комплекса [Cr(CO)3]». Angewandte Chemie, международное издание . 45 (1): 98–101. дои : 10.1002/anie.200502588 . ПМИД 16304647 .
- ^ Берг, Джереми М.; Тимочко, Страйер (2002). Биохимия (5-е изд.). Нью-Йорк: WH Freeman and Company . ISBN 0-7167-3051-0 .
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Манфред Браун (2015). Современная химия енолятов: от получения к применению в асимметричном синтезе . Вайли-ВЧ. дои : 10.1002/9783527671069 . ISBN 9783527671069 .
- ^ Мукаяма, Т.; Кобаяши, С. Орг. Реагировать. 1994 , 46 , 1. два : 10.1002/0471264180.or046.01
- ^ Г. Рошер (2007). «Виниловые эфиры». Энциклопедия химической технологии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a27_419 . ISBN 978-3527306732 . S2CID 241676899 .
- ^ «Стабильные простые енолы». Журнал Американского химического общества . 1989. дои : 10.1021/ja00203a019 .
- ^ Клейден, Джонатан (2012). Органическая химия . Издательство Оксфордского университета. стр. 456–459.
- ^ Чжоу, Ю-Цян; Ван, Най-Син; Син, Ялан; Ван, Янь-Цзин; Хун, Сяо-Вэй; Чжан, Цзя-Сян; Чен, Донг-Донг; Гэн, Цзин-Бо; Данг, Яньфэн; Ван, Чжи-Сян (14 января 2013 г.). «Стабильные ациклические алифатические твердые енолы: синтез, характеристика, рентгеноструктурный анализ и расчеты» . Научные отчеты . 3 (1): 1058. Бибкод : 2013NatSR...3E1058Z . дои : 10.1038/srep01058 . ISSN 2045-2322 . ПМК 3544012 . ПМИД 23320139 .