Перегруппировка Бекмана
| Перегруппировка Бекмана | |
|---|---|
| Назван в честь | Эрнст Отто Бекманн |
| Тип реакции | Реакция перегруппировки |
| Идентификаторы | |
| Портал органической химии | перестановка Бекмана |
| RSC Идентификатор онтологии | RXNO: 0000026 |
Перегруппировка Бекмана , названная в честь немецкого химика Эрнста Отто Бекмана (1853–1923), представляет собой перегруппировку функциональной группы оксима в замещенные амиды . [1] [2] Перегруппировка успешно проведена также на галоиминах и нитронах . Циклические оксимы и галоимины дают лактамы .
Перегруппировка Бекмана часто катализируется кислотой; однако известно, что другие реагенты способствуют перегруппировке. К ним относятся тозилхлорид , тионилхлорид , пентахлорид фосфора , пятиокись фосфора , триэтиламин , гидроксид натрия , триметилсилилиодид и другие. [3] Фрагментация Бекмана - еще одна реакция, которая часто конкурирует с перегруппировкой, хотя тщательный выбор условий промотирующего реагента и растворителя может способствовать образованию одного по сравнению с другим, иногда давая почти исключительно один продукт. Перегруппировка происходит стереоспецифично для кетоксимов и N-хлор/N-фториминов, при этом мигрирующая группа расположена антиперипланарно по отношению к уходящей группе азота. Известно, что определенные условия приводят к рацемизации геометрии оксима, что приводит к образованию обоих региоизомеров . Перегруппировка альдоксимов протекает со стереоспецифичностью в газовой фазе и без стереоспецифичности в фазе раствора. Некоторые методологии допускают перегруппировку альдоксимов в первичные амиды, но в этих системах обычно конкурирует фрагментация. Перегруппировка нитронов также происходит без стереоспецифичности; в образовавшемся региоизомере амидный азот замещен группой, обладающей наибольшей миграционной способностью .

Архетипическая перегруппировка Бекмана. [4] представляет собой превращение циклогексанона в капролактам через оксим. Капролактам является сырьем для производства нейлона 6 . [5]
Раствор Бекмана состоит из уксусной кислоты , соляной кислоты и уксусного ангидрида и широко использовался для катализа перегруппировки. другие кислоты, такие как серная кислота , полифосфорная кислота и фтористый водород Использовались и . Серная кислота является наиболее часто используемой кислотой для коммерческого производства лактама из-за образования побочного продукта сульфата аммония при нейтрализации аммиаком . Сульфат аммония является распространенным сельскохозяйственным удобрением, обеспечивающим азот и серу.
Механизм реакции
[ редактировать ]Наиболее распространенный механизм реакции перегруппировки Бекмана обычно состоит из алкила антиперипланарной миграции с вытеснением уходящей группы с образованием иона нитрилия . За этим следует сольволиз до имидата , а затем таутомеризация до амида: [6]
Известно, что этот ион нитрилия перехватывается другими нуклеофилами, в том числе уходящей группой оксима. [3]

Предположительно, после того как фенильная группа мигрирует и вытесняет цианат , последний затем атакует образовавшийся ион нитрилия. В четыреххлористом углероде изоцианат после можно выделить, тогда как в образуется сольволиза этаноле уретан изоцианата.
Одно компьютерное исследование установило механизм, учитывающий молекулы растворителя и заместители. [7] В перегруппировке оксима ацетона в растворе Бекмана участвуют три молекулы уксусной кислоты и один протон (присутствующий в виде иона оксония ). В переходном состоянии, приводящем к иону иминия (σ-комплексу), метильная группа мигрирует к атому азота в согласованной реакции по мере удаления гидроксильной группы. Атом кислорода в гидроксильной группе стабилизирован тремя молекулами уксусной кислоты. На следующем этапе электрофильный атом углерода в ионе нитрилия подвергается атаке воды, и протон отдается обратно уксусной кислоте. В переходном состоянии, ведущем к имидату, атом кислорода воды координируется с 4 другими атомами. На третьем этапе стадия изомеризации протонирует атом азота, что приводит к амиду .
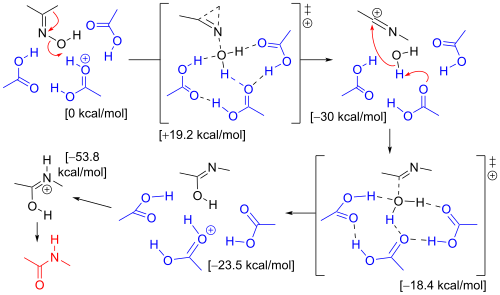
Тот же расчет с ионом гидроксония и 6 молекулами воды дает тот же результат, но когда мигрирующим заместителем является фенильная группа, механизм благоприятствует образованию промежуточного трехчленного π-комплекса. Этот π-комплекс не встречается в H 3 O + (Н 2 О) 6 .

В случае циклогексаноноксима ослабление напряжения кольца приводит к третьему механизму реакции, приводящему непосредственно к протонированному капролактаму за одну согласованную стадию без промежуточного образования π-комплекса или σ-комплекса.
Цианурхлорид участвует в реакции Бекмана
[ редактировать ]Перегруппировку Бекмана можно провести каталитически, используя хлорид циануровой кислоты и хлорид цинка в качестве сокатализаторов . Например, циклододеканон можно превратить в соответствующий лактам , мономер, используемый в производстве нейлона 12 . [8] [9]
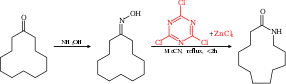
Механизм реакции этой реакции основан на каталитическом цикле , в котором цианурхлорид активирует гидроксильную группу посредством нуклеофильного ароматического замещения . Продукт реакции вытесняется и заменяется новым реагентом через промежуточный комплекс Мейзенгеймера .

Фрагментация Бекмана
[ редактировать ]Фрагментация Бекмана — это реакция, которая часто конкурирует с перегруппировкой Бекмана. [3] Когда группа α оксима способна стабилизировать образование карбокатиона , фрагментация становится жизнеспособным путем реакции. В результате реакции образуются нитрил и карбокатион, которые быстро перехватываются с образованием различных продуктов. Нитрил также может гидролизоваться в условиях реакции с образованием карбоновых кислот . Различные условия реакции могут способствовать фрагментации, а не перегруппировке.

Четвертичные углеродные центры способствуют фрагментации, стабилизируя образование карбокатионов посредством гиперконъюгации . Как показано на рисунке выше, образуется «стабильный» карбокатион, который затем теряет водород, образуя участок ненасыщенности . Атомы кислорода и азота также способствуют фрагментации за счет образования кетонов и иминов соответственно.

Сера также способна способствовать фрагментации, хотя и в более широком диапазоне, чем кислород или азот.

Кремний способен направлять фрагментацию за счет эффекта бета-кремния .
Промежуточный карбокатион в этой реакции перехватывается нуклеофильным фторидом трифторида диэтиламиносеры ( DAST ): [10]
Реакция Земмлера-Вольфа
[ редактировать ]Оксим циклогексенона с кислотой образует анилин в реакции дегидратации – ароматизации , называемой реакцией Земмлера-Вольфа или ароматизацией Вольфа. [11] [12] [13] [14]

Механизм можно представить следующим образом:

Реакция по своей сути является частным случаем перегруппировки Бекмана в сочетании с участием соседних групп .
Применение в синтезе лекарств
[ редактировать ]Промышленный синтез парацетамола, разработанный Hoechst - Celanese, включает превращение метилкетона в ацетанилид посредством перегруппировки Бекмана. [15]
Термическая перегруппировка, которая происходит при синтезе кетамина, была названа перегруппировкой Бекмана согласно: url .
См. также
[ редактировать ]- Более короткая перестановка
- Реакция Дакина
- реакция Шмидта
- Перегруппировка Штиглица
- Свободная перестановка
Ссылки
[ редактировать ]- ^ Эрнст Отто Бекманн (1886). « О [наших] знаниях об изонитрозосоединениях » (PDF) . Отчеты Немецкого химического общества . 19 :988-993. дои : 10.1002/cber.188601901222 .
- ^ Донарума, LG; Хелдт, WZ (1960). «Перегруппировка Бекмана. (Обзор)». Орг. Реагируйте . 11 : 1–156.
- ^ Jump up to: а б с Гоули, RE (1988). «Реакции Бекмана: перегруппировка, отщепление-присоединение, фрагментация и перегруппировка-циклизация. (Обзор)». Орг. Реагируйте . 35 : 14–24.
- ^ Эк, Джей Си; Марвел, CS (1939). «Э-бензоиламинокапроновая кислота» . Органические синтезы . 19:20 . дои : 10.15227/orgsyn.019.0020 . Архивировано из оригинала 28 сентября 2012 г. Проверено 18 августа 2005 г. Эк, Джей Си; Марвел, CS (1943). «Э-бензоиламинокапроновая кислота» . Органические синтезы . 2 : 76. Архивировано из оригинала 28 сентября 2012 г. Проверено 18 августа 2005 г.
- ^ Йозеф Ритц; Хьюго Фукс; Хайнц Кечка; Уильям К. Моран. «Капролактам». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a05_031.pub2 . ISBN 978-3527306732 .
- ^ Лескано-Гонсалес, Инес; Боронат, Мерседес; Бласко, Тереза (апрель 2009 г.). «Исследование реакции перегруппировки Бекмана, катализируемой пористыми твердыми телами: MAS-ЯМР и теоретические расчеты». Твердотельный ядерный магнитный резонанс . 35 (2): 120–129. дои : 10.1016/j.ssnmr.2009.02.001 . ПМИД 19286355 .
- ^ Ямабе, С.; Цучида, Н.; Ямадзаки, С. (2005). «Является ли перегруппировка Бекмана согласованной или ступенчатой реакцией? Вычислительное исследование» . Журнал органической химии . 70 (26): 10638–10644. дои : 10.1021/jo0508346 . ПМИД 16355980 .
- ^ Фуруя, Ю.; Исихара, К.; Ямамото, Х. (2005). «Цианурхлорид как мягкий и активный катализатор перегруппировки Бекмана» . Журнал Американского химического общества . 127 (32): 11240–11241. дои : 10.1021/ja053441x . ПМИД 16089442 .
- ^ Табер, Дуглас Ф.; Стрейни, Патрик Дж. (2010). «Синтез лауролактама из циклододеканона посредством перегруппировки Бекмана». Дж. Хим. Образование . 87 (12): 1392. Бибкод : 2010ЖЧЭд..87.1392Т . дои : 10.1021/ed100599q . S2CID 96699202 .
- ^ Кирихара, Масаюки; Ниими, Канако; Момосе, Такефуми (1997). «Фторативное расщепление циклических кетоксимов трифторидом диэтиламиносеры: эффективный синтез фторированных карбонитрилов». Химические коммуникации . 6 (6): 599–600. дои : 10.1039/a607749h .
- ^ В. Земмлер, Бер. 25, 3352 (1892)
- ^ Л. Вольф, Amp. 322, 351 (1902)
- ^ Назовите реакции и реагенты в органическом синтезе , Брэдфорд П. Манди, Майкл Г. Эллерд, Фрэнк Г. Фавалоро.
- ^ Перестановки Бекмана. Расследование особых случаев Э.К. Хорнинг, В.Л. Стромберг, Х.А. Ллойд Дж. Ам. хим. Соц. , 1952 , 74 (20), стр. 5153–5155. два : 10.1021/ja01140a048
- ^ патент США 5155273 , Фрич, Джон Р. (Корпус-Кристи, Техас); Фручи, Стэнли О. (Бад-Зоден/TS, DE); Хорленко, Теодор (Корпус-Кристи, Техас); Агилар, Дэниел А. (Корпус-Кристи, Техас); Хилтон, Чарльз Б. (Корпус-Кристи, Техас); Снайдер, Филлип С. (Рок-Хилл, Южная Каролина); Силигер, Уильям Дж. (Корпус-Кристи, Техас), «Производство ацетаминофена», опубликовано 13 октября 1992 г., передано Hoechst Celanese Corporation (Сомервилл, Нью-Джерси).


