Эпоксидирование аллиловых спиртов
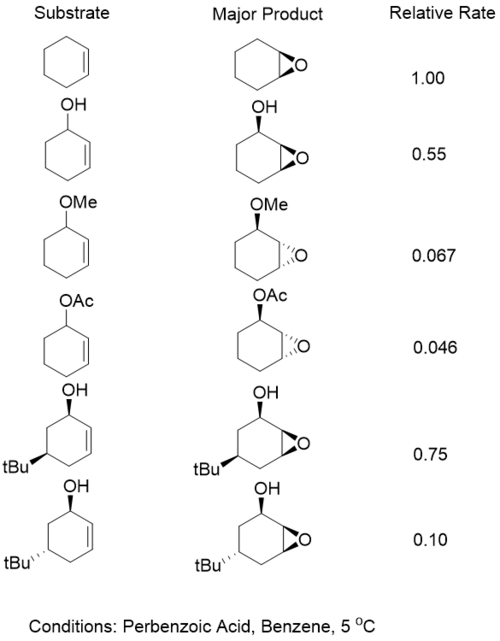
Эпоксидирование аллильных спиртов — класс реакций эпоксидирования в органической химии . Одним из вариантов реализации этой реакции является эпоксидирование Шарплесса . Ранние работы показали, что аллиловые спирты обеспечивают селективность по отношению к лицу при использовании метахлорпероксибензойной кислоты (м-ХПБА) в качестве окислителя. Эта селективность изменилась при ацетилировании аллилового спирта . Это открытие приводит к выводу, что водородные связи играют ключевую роль в селективности, и была предложена следующая модель. [1]
Для циклических аллильных спиртов большая селективность наблюдается, когда спирт зафиксирован в псевдоэкваториальном , а не в псевдоаксиальном положении. [2] Однако было обнаружено, что для систем, катализируемых металлами, например систем на основе ванадия, скорость реакции увеличивается, когда гидроксильная группа находится в аксиальном положении, в 34 раза. Было показано, что субстраты, заблокированные в псевдоэкваториальном положении, подвергаются окислению. чтобы образовать ен-единицу . В обоих случаях эпоксидирования, катализируемого ванадием, эпоксидированный продукт показал превосходную селективность в отношении син-диастереомера . [3]
В отсутствие водородных связей стерические эффекты направляют присоединение пероксида к противоположной стороне. Однако перфтористые перкислоты все еще способны образовывать водородные связи с защищенными спиртами и обеспечивать нормальную селективность по отношению к водороду, присутствующему в перкислоте. [4]
Хотя присутствие аллильного спирта действительно приводит к повышению стереоселективности, скорость этих реакций медленнее, чем в системах, не содержащих спирты. Однако скорость реакции субстратов с группой водородных связей все же выше, чем у эквивалентных защищенных субстратов. Это наблюдение объясняется балансом двух факторов. Первый — стабилизация переходного состояния в результате образования водородной связи. Во-вторых, это электроноакцепторная природа кислорода, которая оттягивает электронную плотность от алкена, снижая его реакционную способность. [5]
Ациклические аллильные спирты также обладают хорошей селективностью. В этих системах как A 1,2 (стерические взаимодействия с винилом ) и A 1,3 деформации считаются. Показано, что двугранный угол 120° лучше всего направляет субстраты, имеющие водородную связь с направляющей группой. Такая геометрия позволяет правильно расположить перекись, а также обеспечить минимальную передачу от CC pi в сигма-звезду CO. [6] Это пожертвование снизит электронную плотность алкена и деактивирует реакцию. Однако комплексы ванадия не образуют водородных связей со своими субстратами. Вместо этого они координируют свои действия с алкоголем. Это означает, что двугранный угол 40° обеспечивает идеальное положение орбитали сигма-звезды перекиси. [7]
В системах с водородными связями A 1,3 деформация играет большую роль, потому что требуемая геометрия заставляет любые аллильные заместители иметь строгие A 1,3 взаимодействия, но избегает А 1,2 . Это приводит к синприсоединению образующегося эпоксида. В случае ванадия требуемая геометрия приводит к серьезному A 1,2 взаимодействия, но избегает А 1,3 , что приводит к образованию эпоксидной анти-направленной группы. Было показано, что эпоксидирование, катализируемое ванадием, очень чувствительно к стерической массе винильной группы. [8] [9] [10]
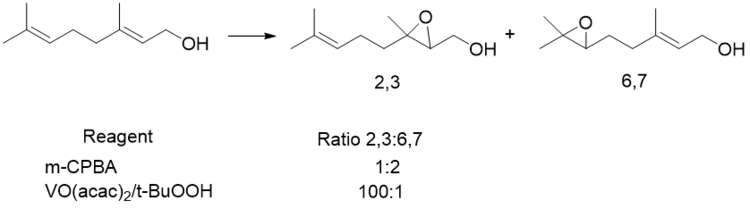
Гомоаллиловые спирты являются эффективными направляющими группами эпоксидирования как в циклических, так и в ациклических системах для субстратов, обладающих водородными связями. Однако эти реакции, как правило, имеют более низкий уровень селективности. [11] [12]
В то время как субстраты, связывающие водородные связи, обеспечивают одинаковую селективность в аллильных и гомоаллических случаях, в случае ванадиевых катализаторов наблюдается обратное.
Переходное состояние, предложенное Михеличом, показывает, что для этих реакций движущей силой селективности является минимизация A 1,3 напряжение в конструкции псевдокресла.
Предложенное переходное состояние показывает, что субстрат будет пытаться принять конформацию, которая минимизирует аллильную деформацию. Для этого наименее стерически объемистая группа R повернется и займет положение R4. [13]
Хотя надкислоты и эпоксидирование, катализируемое металлами, демонстрируют разную селективность в ациклических системах, они демонстрируют относительно схожую селективность в циклических системах. Для систем с циклическими кольцами, которые меньше семи или меньше или 10 или больше, наблюдаются аналогичные закономерности селективности. Однако было показано, что для колец среднего размера (восьми и девяти) надкислотные окислители проявляют обратную селективность, тогда как реакции, катализируемые ванадием, продолжают демонстрировать образование синэпоксида. [14]
Хотя ванадий является наименее реакционноспособным металлическим катализатором эпоксидирования, он очень селективен в отношении алкенов с аллильными спиртами. Ранние работы Шарплесса показывают, что он предпочитает реагировать с алкенами с аллильными спиртами, а не с более замещенными электронно-плотными алкенами. В этом случае ванадий продемонстрировал обратную региоселективность как по отношению к м-CPBA, так и по отношению к более реакционноспособным формам молибдена. Хотя ванадий обычно менее реакционноспособен, чем комплексы других металлов, в присутствии аллильных спиртов скорость реакции превышает скорость молибдена, наиболее реакционноспособного металла для эпоксидирования. [15]
Ссылки
[ редактировать ]- ^ Хенбест, HB; Уилсон, RAL (1957). «376. Вопросы стереохимии. Часть I. Стереоспецифичность образования эпоксидов из циклических аллильных спиртов». Журнал Химического общества (обновленный) : 1958. doi : 10.1039/JR9570001958 .
- ^ Чемберлен, П.; Робертс, ML; Уизем, GH (1970). «Эпоксидирование аллильных спиртов пероксикислотами. Попытки определить геометрию переходного состояния». Журнал Химического общества B: Физическая органика : 1374. doi : 10.1039/J29700001374 .
- ^ Вейершталь, Питер; Маршалл-Вейершталь, Хельга; Пеннингер, Джозеф; Вальтер, Лутц (1987). «Терпены и производные терпена-22». Тетраэдр . 43 (22): 5287–5298. doi : 10.1016/S0040-4020(01)87705-X .
- ^ МакКиттрик, Брайан А.; Ганем, Брюс (1985). «Син-стереоселективное эпоксидирование аллиловых эфиров с использованием CF3CO3H». Буквы тетраэдра . 26 (40): 4895–4898. дои : 10.1016/S0040-4039(00)94979-7 .
- ^ Ховейда, Амир Х.; Эванс, Дэвид А.; Фу, Грегори К. (1993). «Химические реакции, управляемые субстратом». Химические обзоры . 93 (4): 1307–1370. дои : 10.1021/cr00020a002 .
- ^ Хоук, КН; Паддон-Роу, Миннесота; Рондан, штат Нью-Йорк; Ву, Ю.Д.; Браун, ФК; Спеллмейер, округ Колумбия; Мец, Джей Ти; Ли, Ю.; Лончарич, Р.Дж. Сайенс , 1986 , 231 , 1108-1117.
- ^ Вальдемар, А.; Вирт, Т. Отчеты о химических исследованиях , 1999 , 32.8 , 703-710.
- ^ Михелич, Эдвард Д. (1979). «Эпоксидирование, катализируемое ванадием. I. Новая картина селективности для ациклических аллильных спиртов». Буквы тетраэдра . 20 (49): 4729–4732. дои : 10.1016/S0040-4039(01)86695-8 .
- ^ Росситер, Бельгия; Верховен, ТР; Шарплесс, КБ (1979). «Стереоселективное эпоксидирование ациклических аллильных спиртов. Исправление нашей предыдущей работы». Буквы тетраэдра . 20 (49): 4733–4736. дои : 10.1016/S0040-4039(01)86696-X .
- ^ Нарула, Ачаран С. (1982). «Стереоселективное введение хиральных центров в ациклические предшественники: зонд переходного состояния для V5+-катализируемого эпоксидирования т-бутилгидропероксида (TBHP) ациклических аллильных спиртов и его синтетические последствия». Буквы тетраэдра . 23 (52): 5579–5582. дои : 10.1016/S0040-4039(00)85899-2 .
- ^ Крэгг, GML; Микинс, Джорджия (1965). «366. Стероиды неприродной конфигурации. Часть IX. Окисление 9α-люмистерола (пирокальциферола) и 9β-эргостерина (изопирокальциферола) пербензойной кислотой». Дж. Хим. Соц. : 2054–2063 гг. дои : 10.1039/JR9650002054 .
- ^ Джонсон, MR; Киши, Ю. Тетраэдр Летт. , 1979 , 4347-4350.
- ^ Михелич, Эдвард Д.; Дэниелс, Карен; Эйкхофф, Дэвид Дж. (1981). «Эпоксидирование, катализируемое ванадием. 2. Высокостереоселективное эпоксидирование ациклических гомоаллиловых спиртов, предсказанное с помощью подробной модели переходного состояния». Журнал Американского химического общества . 103 (25): 7690–7692. дои : 10.1021/ja00415a067 .
- ^ Ито, Такаши; Джицукава, Коитиро; Канеда, Киётоми; Тераниши, Сиитиро (1979). «Эпоксидирование циклических аллильных спиртов, катализируемое ванадием. Стереоселективность и механизм стереоконтроля». Журнал Американского химического общества . 101 : 159–169. дои : 10.1021/ja00495a027 .
- ^ Шарплесс, КБ; Майклсон, RC J. Am. хим. Соц. , 1973 , 95 (18)