Синтез хинолина Кнорра
| Синтез хинолина Кнорра | |
|---|---|
| Назван в честь | Людвиг Кнорр |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC Идентификатор онтологии | RXNO: 0000394 |
Синтез хинолина Кнорра представляет собой внутримолекулярную органическую реакцию превращения β-кетоанилида в 2-гидроксихинолин с использованием серной кислоты . Эту реакцию впервые описал Людвиг Кнорр (1859–1921) в 1886 году. [1]

Реакция представляет собой тип электрофильного ароматического замещения, сопровождающегося отщеплением воды. Исследование 1964 года показало, что при определенных условиях реакции образование 4-гидроксихинолина является конкурирующей реакцией. [2] Например, соединение бензоилацетанилид ( 1 ) образует 2-гидроксихинолин ( 2 ) при большом избытке полифосфорной кислоты (ПФА) и 4-гидроксихинолин 3 , когда количество ПФА мало. Механизм реакции выявил N,O-дикатионное промежуточное соединение A с избытком кислоты, способное замыкать кольцо, и монокатионное промежуточное соединение B , которое фрагментируется до анилина и (в конечном итоге до) ацетофенона . Анилин реагирует с другим эквивалентом бензоилацетанилида с образованием 4-гидроксихинолина.

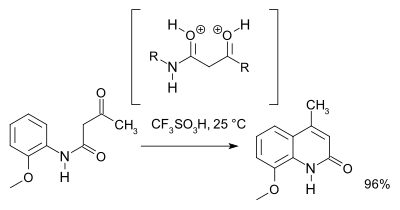
Исследование 2007 года [3] пересмотрел механизм реакции и на основе ЯМР-спектроскопии и теоретических расчетов отдал предпочтение O,O-дикатионному промежуточному соединению ( суперэлектрофилу ) по сравнению с дикатионным промежуточным соединением N,O. Для препаративных целей трифликовая кислота рекомендуется :
Ссылки
[ редактировать ]- ^ Синтетические эксперименты с ацетоуксусным эфиром, Анналы химии Юстуса Либиха , том 236, выпуск 1–2, дата: 1886 г. , страницы: 69–115 Людвиг Кнорр два : 10.1002/jlac.18862360105
- ^ Превращение бензоилацетанилидов в 2- и 4-гидроксихинолины Б. Стаскун J. Org. хим. 1964 год ; 29(5); 1153–1157. два : 10.1021/jo01028a038
- ^ Циклизации Кнорра и дистонические суперэлектрофилы Киран Кумар Солингапурам Сай, Томас М. Гилберт и Дуглас А. Клампп J. Org. хим. 2007 , 72, 9761–9764 дои : 10.1021/jo7013092