Аллильная перегруппировка
Аллильная перегруппировка или аллильный сдвиг — это органическая химическая реакция , в которой реакция в центре, вицинальном по отношению к двойной связи , приводит к сдвигу двойной связи к соседней паре атомов:

Он встречается как при нуклеофильном , так и при электрофильном замещении , хотя обычно подавляется по сравнению с неаллильным замещением. Например, реакция 1-хлор-2-бутена с гидроксидом натрия дает 2-бутен-1-ол и 3-бутен-2-ол:

При аналогичном замещении 1-хлор-3-метил-2-бутена вторичный 2-метил-3-бутен-2-ол образуется с выходом 85%, а первичный 3-метил-2-ол. бутен-1-ол составляет 15%.
Аллильные сдвиги происходят потому, что переходное состояние представляет собой промежуточное аллильное соединение . В остальном они подобны классическому нуклеофильному замещению и допускают как бимолекулярный , так и мономолекулярный механизмы (соответственно замены S N 2' и S N 1'/S N i' ).
Объем
[ редактировать ]Аллильные сдвиги становятся доминирующим путем реакции, когда существует значительная устойчивость к нормальному (неаллильному) замещению. Что касается нуклеофильного замещения, то такая устойчивость известна, когда существует существенное стерическое препятствие в районе уходящей группы или вокруг нее , или если имеется геминальный заместитель, дестабилизирующий накопление положительного заряда. Эффекты замещения винильной группы менее ясны. [1]
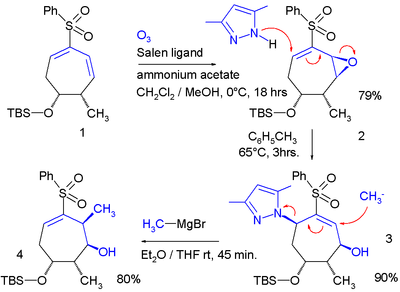
Аллильные сдвиги , хотя и реже, чем S N ', могут происходить винилологически, как «бутадиенильный сдвиг»: [2]
S N 2' редукция
[ редактировать ]При S N 2' гидрид восстановлении аллильно замещает хорошую уходящую группу при формальном органическом восстановлении , аналогично синтезу диена Уайтинга . Один пример произошел при общем синтезе таксола (кольцо C): [3]
Гидрид фосфониевую представляет собой литийалюминийгидрид , а уходящая группа представляет собой соль ; аллильный сдвиг вызывает образование экзоциклической двойной связи в продукте. Только когда циклогексановое кольцо правильно замещено, протон присоединит транс к соседней метильной группе.
Электрофильные аллильные сдвиги
[ редактировать ]Аллильные сдвиги также могут происходить с электрофилами . В приведенном ниже примере карбонильная группа бензальдегида активируется дибороновой кислотой перед реакцией с аллиловым спиртом (см. Реакцию Принса ): [4]
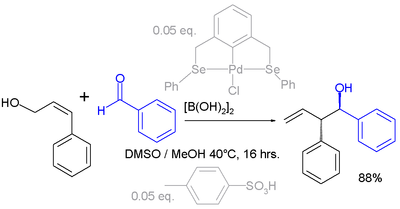
Активная каталитическая система в этой реакции представляет собой комбинацию соединения палладиевых клещей и п -толуолсульфокислоты , продукт реакции получается в виде одного региоизомера и стереоизомера .
Примеры
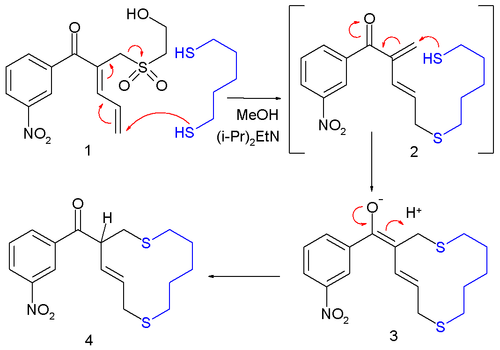
[ редактировать ]Повторяющиеся аллильные сдвиги могут «перевернуть» двойную связь между двумя возможными местами: [5]
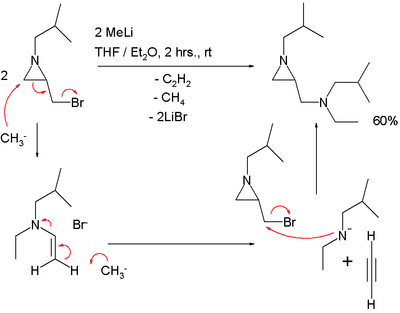
Реакция S N 2' должна объяснить результат реакции азиридина, несущего бромметиленовую группу, с метиллитием : [6]
один эквивалент ацетилена В этой реакции теряется .
Именованные реакции
[ редактировать ]Ссылки
[ редактировать ]- ^ ДеВулф, Роберт Х.; Янг, Уильям Г. (1964-01-01), Патай, Саул (редактор), «Аллильные реакции» , The Alkenes: Vol. 1 (1964) , Чичестер, Великобритания: John Wiley & Sons, Ltd., стр. 690–691, doi : 10.1002/9780470771044.ch10 , ISBN 978-0-470-77104-4 , получено 10 марта 2024 г.
- ^ Молекулярные критерии. Синтез алкилирующих сшивающих реагентов с расширенным равновесным переносом и их использование в образовании макроциклов Стивен Дж. Броккини, Мартин Эберле и Ричард Г. Лоутон Дж. Ам. хим. Соц. ; 1988 год ; 110(15) стр. 5211 – 5212; два : 10.1021/ja00223a061
- ^ Синтетические исследования таксола: высокостереоселективное построение C-кольца таксола посредством восстановления S N 2' аллильной фосфониевой соли Масаюки Уцуги, Масаюки Мияно и Масахиса Накада Org. Летт. ; 2006 год ; 8(14) стр. 2973 - 2976; (Письмо) два : 10.1021/ol0608606
- ^ Высокоселективное и надежное углерод-углеродное взаимодействие, катализируемое палладием, между аллиловыми спиртами и альдегидами через переходные аллилбороновые кислоты Никлас Селандер, Сара Себелиус, Сезар Эстей, Калман Дж. Сабо Европейский журнал органической химии , том 2006 , выпуск 18, страницы 4085–4087 два : 10.1002/ejoc.200600530
- ^ Двойное добавление Lawton SN 2 ' к эпоксивинилсульфонам: избирательное построение стереотетрад аплиронина А. Ахмад Эль-Ава и Philip Fuchs Org. Летт. ; 2006 год ; 8(14) стр. 2905 - 2908; (Письмо) два : 10.1021/ol060530l
- ^ Весьма необычное преобразование 1-алкил-2-(бромметил)азиридинов в 1-алкил-2-( N -алкил- N -этиламинометил)азиридины с использованием метиллития . Маттиас Д'Хог и Норберт Де Кимпе Chem. Коммун. , 2007 , 1275 - 1277, два : 10.1039/b616606g