Бороновая кислота

Бороновая кислота - это органическое соединение, связанное с борной кислотой ( B (OH) 3 ), в которой одна из трех гидроксильных групп ( -OH ) заменяется алкильной или арильной группой (представленной R в общей формуле R - B (OH) 2 ). [ 1 ] В качестве соединения, содержащего углероновую связь , члены этого класса, таким образом, принадлежат к более крупному классу органоборанов .
Бороновые кислоты действуют как кислоты Льюиса . Их уникальная особенность состоит в том, что они способны образовывать обратимые ковалентные комплексы с сахарами , аминокислотами , гидроксамическими кислотами и т. Д. (Молекулы с вик -вик (1,2) или иногда (1,3) заменили доноров Льюиса ( спирт , амин , амин ,, карбоксилат)). P тетраэдрические k a из бориновой кислоты составляет ~ 9, но они могут образовывать борнатные комплексы с P k a ~ 7. Они иногда используются в области молекулярного распознавания, чтобы связываться с сахаридами для обнаружения флуоресценции или селективного транспорта сахаридов в мембранах.
Бороновые кислоты широко используются в органической химии, поскольку химические строительные блоки и промежуточные продукты преимущественно в связке Сузуки . Ключевой концепцией в его химии является транстерация его органического остатка в переходный металл.
Соединение Bortezomib с группой бориновой кислоты - это лекарство, используемое при химиотерапии . Атом бора в этой молекуле является ключевой субструктурой, потому что через него некоторые протеасомы блокируются, которые в противном случае разлагали белки. Известно, что борновые кислоты связываются с серинами активного сайта и являются частью ингибиторов для липазы поджелудочной железы свиньи , [ 2 ] субтилис [ 3 ] и протеаза Kex2 . [ 4 ] Кроме того, производные бороновой кислоты представляют собой класс ингибиторов для ацилпротеин-тиоэстеразы человека 1 и 2 человека, которые являются мишенями для раковых лекарств в рамках цикла RAS . [ 5 ]
Предполагается, что функциональная группа из бороновой кислоты обладает низкой неотъемлемой токсичностью. Это одна из причин популярности сузуки в развитии и синтезе фармацевтических агентов. Однако значительная часть обычно используемых борновых кислот и их производные недавно обнаружили, что дает положительный тест Ames и действует как химические мутагены . Считается, что механизм мутагенности включает в себя генерацию органических радикалов посредством окисления боиновой кислоты атмосферным кислородом. [ 6 ]
Структура и синтез
[ редактировать ]В 1860 году Эдвард Франкленд был первым, кто сообщил о подготовке и выделении боронной кислоты. Этилбороновая кислота была синтезирована двухэтапным процессом. Во -первых, диэтилцинк и триэтил -борат отреагировали на производство триэтилборина . Это соединение затем окислялось в воздухе с образованием этилбороновой кислоты. [ 7 ] [ 8 ] [ 9 ] В настоящее время в настоящее время используются несколько синтетических маршрутов, и многие боронные кислоты в воздухе имеются в продаже.
Бороновые кислоты обычно имеют высокие точки плавления. Они склонны к формированию ангидридов путем потери молекул воды, как правило, дают циклические тримеры .
| Бороновая кислота | Ведущий | Структура | Молярная масса | Номер CAS | Температура плавления ° C. |
|---|---|---|---|---|---|
| Фенилбороновая кислота | Фенил |  |
121.93 | 98-80-6 | 216–219 |
| 2-тиенилобороновая кислота | Тиофен |  |
127.96 | 6165-68-0 | 138–140 |
| Метилбороновая кислота | Метил |  |
59.86 | 13061-96-6 | 91–94 |
| цис -пропенилбороновая кислота | пропен | 85.90 | 7547-96-8 | 65–70 | |
| Транспропенилбороновая кислота | пропен |  |
85.90 | 7547-97-9 | 123–127 |
Синтез
[ редактировать ]Бороновые кислоты могут быть получены несколькими методами. Наиболее распространенным способом является реакция органометаллических соединений на основе лития или магния ( Grignards ) с эфирами бората . [ 10 ] [ 11 ] [ 12 ] [ 13 ] Например, фенилбороновая кислота продуцируется из бромида фенилмагний и триметил борат с последующим гидролизом [ 14 ]
- Phmgbr + b (ome) 3 → phb (ome) 2 + meomgbr
- PHB (OME) 2 + 2 H 2 O → PHB (OH) 2 + 2 MEOH
Другим методом является реакция арилсилана ( RSIR 3 ) с трибромидом бора (BBR 3 ) в транстерации до RBBR 2 с последующим кислым гидролизом.
Третий метод - это катализированная на палладие реакция арилгалогенидов и трифлаты диборонильными эфирами в реакции связи, известной как реакция борилирования Мияуры . Альтернативой эфиров в этом методе является использование дибороновой кислоты или тетрагидроксидиборон ([B (OH 2 )] 2 ). [ 15 ] [ 16 ] [ 17 ]
Бороновые сложные эфиры (также названные борнатные эфиры)
[ редактировать ]Бороновые сложные эфиры - это сложные эфиры между борной кислотой и спиртом.
| Сложный | Общая формула | Общая структура |
|---|---|---|
| Бороновая кислота | RB (OH) 2 |  |
| Борновый эфир | RB (или) 2 |  |
Соединения могут быть получены из эфиров Bort [ 18 ] конденсацией спиртами и диолами . Фенилбороновая кислота может быть самостоятельно засорена с циклическим тримером, называемой трифениловой ангидридом или трифенилбороксином. [ 19 ]
| Борновый эфир | Диол | Структурная формула | Молярная масса | Номер CAS | Температура кипения (° C) |
|---|---|---|---|---|---|
| Эфир аллилболиновой кислоты пинакол | Пинакол | 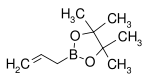 |
168.04 | 72824-04-5 | 50–53 (5 мм рт.ст.) |
| Фениловой бос кислота триметиленгликол эфир | триметиленгликоль |  |
161.99 | 4406-77-3 | 106 (2 мм рт. |
| Диизопропоксиметилборин | изопропанол |  |
144.02 | 86595-27-9 | 105 -107 |
Соединения с 5-членными циклическими структурами, содержащими связь с C-O-B-O-C, называются диоксабороланами , и с 6-членными кольцами диоксаборинаны .
Органическая химия
[ редактировать ]Реакция сцепления Сузуки
[ редактировать ]Бороновые кислоты используются в органической химии в реакции Сузуки . В этой реакции атом бора обменивается своей арильной группой с алкокси группой из Палладия.
| ( 1 ) |
Чан -лам. Связь
[ редактировать ]В Chan -Lam, связывающем алкил, алкенил или арилбуновую кислоту, реагирует с N -H или O -H, содержащим соединение с Cu (ii), таким как медный (II) ацетат и кислород , и основание, такое как пиридин [ 20 ] [ 21 ] Образование новой углеродно-антрогеновой связи или углерод-кислорода , например, в этой реакции 2-пиридона с транс -1-гексенилбороновой кислотой:
Последовательность механизма реакции - депротонирование амина, координация амина в медь (II), трансталлирование (передача группы алкил -борона в медь и группу ацетата меди в бор), окисление Cu (II) в Cu (III) по кислороду и, наконец, восстановительное устранение Cu (III) в Cu (i) с образованием продукта. Прямое восстановительное устранение Cu (ii) в Cu (0) также происходит, но очень медленно. В каталитических системах кислород также восстанавливает катализатор Cu (II).
Liebenkind - Sogl Coupling
[ редактировать ]В связке Liebeskind -Srogl сочетается в эфире тиола с борновой кислотой для получения кетона .
Сопряженное дополнение
[ редактировать ]Органический остаток борновой кислоты представляет собой нуклеофил в сопряжении также в сочетании с металлом. В одном исследовании эфир пинакола аллилбороновой кислоты реагирует с дибензилиденным ацетоном в таком сопряжении: [ 22 ]
- в Системой катализатора этой реакции является трис (дибензилиденацетон) дипалладий (0) / трициклогекэксилфосфин .
Другое конъюгатное добавление - это грамин с фенилбороновой кислотой, катализируемым циклооктадиеновым димером хлорида родия : [ 23 ]
Окисление
[ редактировать ]Бороновые сложные эфиры окисляются до соответствующих спиртов с помощью основания и перекиси водорода (для примера см.: Карбеноид )
Омологация
[ редактировать ]- борнового эфира В гомологизации алкильная группа смещается с бора в борнате на углерод: [ 24 ]
-
Гомологизация боринового эфира
-
Применение гомологизации
В этой реакции дихлорметиллитий превращает борновый эфир в боронат. Затем кислота Льюиса индуцирует перестройку алкильной группы с смещением группы хлора. Наконец, органометаллический реагент, такой как реагент Grignard, вытесняет второй атом хлора, который эффективно приводит к внедрению группы RCH 2 в связь CB. Еще одна реакция с алкильной миграцией бороната - реакция петиза .
Электрофильные сдвиги аллила
[ редактировать ]Эфирные сложные эфиры бориновых сдвигов участвуют в электрофильных сдвигах аллила, очень похожих на кремниевую кулон в реакции Сакураи . В одном исследовании реагент дивизиации объединяет оба [ 25 ] [ Примечание 1 ] :
Гидролиз
[ редактировать ]Гидролиз боронных сложных эфиров обратно в борновую кислоту и спирт может быть достигнут в определенных системах с тионилохлоридом и пиридином . [ 26 ] Арилбононические кислоты или эфиры могут быть гидролизованы до соответствующих фенолов путем реакции с гидроксиламином при комнатной температуре. [ 27 ]
C - H Реакции связывания
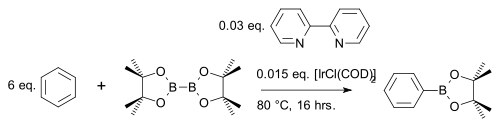
[ редактировать ]Диборон Diboron составной шины (пинаколато) Diboron [ 28 ] реагирует с ароматическими гетероциклами [ 29 ] или простые арены [ 30 ] к эфиру арилбоната с катализатором иридий [IRCL (COD)] 2 (модификация катализатора Crabtree ) и основания 4,4'-ди-трет-бутил-2,2'-бипиридин в реакции связи CH , например, с бензолом :
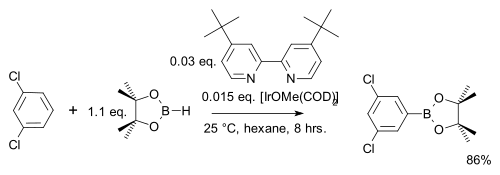
В одной модификации Арен реагирует только с использованием только стехиометрического эквивалента, а не большого избытка, используя более дешевый пинаколборан : [ 31 ]
В отличие от обычной электрофильной ароматической замещения (EAS), где электронные эффекты доминируют , региоселективность в этом типе реакции определяется исключительно стерической основной частью комплекса иридия. Это эксплуатируется в мета -браминке м -ксилола , который по стандартным AES давал бы продукт орто: [ 32 ] [ Примечание 2 ]
Протонолиз
[ редактировать ]Протодебонация -это химическая реакция, включающая протонолиз бороновой кислоты (или другого органоборанского соединения), в которой карбононовая связь разбита и заменена углеродной связью. Протодебонация является хорошо известной нежелательной боковой реакцией и часто связана с реакциями связи с металлом , которые используют боронные кислоты (см. Реакцию Сузуки ). Для данной бориновой кислоты склонность к протодеборонации сильно варьируется и зависит от различных факторов, таких как используемые условия реакции и органический заместитель бориновой кислоты:

Супрамолекулярная химия
[ редактировать ]Сахаридное признание
[ редактировать ]
Ковалентное парное взаимодействие между бородными кислотами и гидрокси групп , которое обнаружено в спиртах и кислотах , быстро и обратимо в водных растворах . Равновесное равновесие, установленное между боронистыми кислотами и гидроксильными группами, присутствующими на сахаридах, было успешно использовано для разработки ряда датчиков для сахаридов. [ 34 ] Одно из ключевых преимуществ с этой динамической ковалентной стратегией [ 35 ] лежит в способности бориновых кислот преодолевать проблему связывания нейтральных видов в водной среде. В случае правильного расположения введение третичного амина в этих супрамолекулярных системах позволит связывать при физиологическом рН и позволять сигнальному механизмы, такие как фотоиндуцированное перенос электронопосредованного флуоресцентного излучения, чтобы сообщить о событии связывания.
Потенциальные применения для этого исследования включают системы мониторинга глюкозы в крови, чтобы помочь управлять сахарным диабетом. Поскольку датчики используют оптический ответ, мониторинг может быть достигнут с использованием минимально инвазивных методов, одним из таких примеров является исследование контактной линзы , которая содержит молекулу датчика на основе боновой кислоты для обнаружения уровней глюкозы внутри окулярных жидкостей . [ 36 ]
Примечания
[ редактировать ]- ^ В этой последовательности сдвиг аллил -эфира боринового эфира катализируется трифторидом бора . На втором этапе гидроксильная группа активируется в качестве уходной группы путем преобразования в трифлат с помощью трифлического ангидрида, которым помогает 2,6-лутидин . Конечный продукт - виниловый циклопропан . Примечание: EE означает энантиомерное избыток
- ^ In situ Вторая ступенчатая реакция эфира борината с медным (II) бромидом
Ссылки
[ редактировать ]- ^ Iupac , сборник химической терминологии , 2 -е изд. («Золотая книга») (1997). Онлайн -исправленная версия: (2006–) « Бориновые кислоты ». Два : 10.1351/goldbook.b00714
- ^ Гарнер, CW (10 июня 1980 г.). «Ингибиторы борновой кислоты липазы поджелудочной железы свиньи» . Журнал биологической химии . 255 (11): 5064–5068. doi : 10.1016/s0021-9258 (19) 70749-2 . ISSN 0021-9258 . PMID 7372625 .
- ^ Линдквист, RN; Терри, С. (январь 1974 г.). «Ингибирование субтилизина борновыми кислотами, потенциальные аналоги промежуточных змеев тетраэдрической реакции». Архивы биохимии и биофизики . 160 (1): 135–144. doi : 10.1016/s0003-9861 (74) 80018-4 . ISSN 0003-9861 . PMID 4364061 .
- ^ Холиоак, Тодд; Уилсон, Марк А.; Фенн, Тимоти Д.; Кеттнер, Чарльз А.; Петско, Грегори А.; Фуллер, Роберт С.; Ринг, Дагмар (10 июня 2003 г.). «2.4 Кристаллическая структура разрешения прототипной гормональной протеазы Kex2 в комплексе с ингибитором бороновой кислоты Ala-Lys-Arg». Биохимия . 42 (22): 6709–6718. doi : 10.1021/bi034434t . ISSN 0006-2960 . PMID 12779325 .
- ^ Циммерманн, Тобиас Дж.; Бюргер, Марко; Таширо, Эцу; Кондо, Ясумицу; Мартинес, Нэнси Э.; Гёрмер, Кристина; Розовый-Стинер, Сигрид; Shimizu, Такеши; Озаки, Шоичиро (2 января 2013 г.). «Ингибиторы ацил белка тиоэстераз 1 и 2 ацил белка». Химбиохим . 14 (1): 115-122. Doi : 10.1002 / cbic.201200571 . ISSN 1439-7633 . PMID 23239555 . S2CID 205557212 .
- ^ Хансен, Марвин М.; Джолли, Роберт А.; Линдер, Райан Дж. (29 июля 2015 г.). «Бороновые кислоты и производные - обеспечивают структурно -активные отношения для мутагенности». Органические процессы исследования и разработки . 19 (11): 1507–1516. doi : 10.1021/acs.oprd.5b00150 . ISSN 1083-6160 .
- ^ Франкленд, E.; Duppa, Bf (1860). «Предварительная примечание о боратиле» . Юстус Либигс Энн. Хим .
- ^ Франкленд, E.; Duppa, B. (1860). «На борском этиде» . Труды Королевского общества . 10 : 568–570. doi : 10.1098/rspl.1859.0112 .
- ^ Франкленд, Э. (1862). «На новой серии органических соединений, содержащих бор» . J. Chem. Соц 15 : 363–381. Bibcode : 1862rspt..152..167f . doi : 10.1039/js8621500363 .
- ^ Деннис Г. Холл, изд. (2005). Бороновые кислоты . Уайли. ISBN 978-3-527-30991-7 .
- ^ Пример: Кристенсен, Джеспер Лэнггаард; Лизен, Мортен; Ведсо, за; Begtrup, Mikael (2005). «Синтез орто- замещенных арилборинических сложных эфиров путем ловушки in situ нестабильных промежуточных соединений Lithio: 2- (5,5-диметил-1,3,2-диоксаборинано-2-ил) этиловый эфир бензойной кислоты». Органические синтезы . 81 : 134 ; Собранные объемы , вып. 11, с. 1015 Prep = V81P0134 .
- ^ Пример: Ли, Вэнджи; Нельсон, Дориан П.; Дженсен, Марк С.; Скотт Хернер, Р.; Cai, Dongwei; Ларсен, Роберт Д. (2005). «Синтез 3-пиридилбороновой кислоты и ее пинакол . Органические синтезы . 81 : 89 ; Собранные объемы , вып. 11, с. 393 .
- ^ Шаретт, Андре Б.; Лебель, Элен (1999). «(2 с , 3 с )-(+)-(3-фенилциклопропил) метанол» . Органический синтез . 76 : 86 ; Собранные объемы , вып. 10, с. 613 .
- ^ Washburn, Robert M.; Левенс, Эрнест; Олбрайт, Чарльз Ф.; Биллиг, Франклин А. (1959). «Бензотборинован -ангидрид» . Органические синтезы . 39 : 3 ; Собранные объемы , вып. 4, с. 68
- ^ Пиларски, Лукаш Т.; Szabó, Kálmán J. (2011). «Катализированный палладием прямой синтез органобороновых кислот». Angewandte Chemie International Edition . 50 (36): 8230-8232. Doi : 10.1002/anie.201102384 . PMID 21721088 .
- ^ Моландер, Гари А.; Трис, Сара Л.Дж.; Дрехер, Спенсер Д. (2010). «Катализированный палладием, прямой синтез боронной кислоты из арилхлоридов: упрощенный путь к разнообразным производным эфир борната» . Журнал Американского химического общества . 132 (50): 17701–17703. doi : 10.1021/ja1089759 . PMC 3075417 . PMID 21105666 .
- ^ Исияма, Тацуо; Мурата, Мики; Мияура, Норо (1 ноября 1995 г.). «Палладий (0)-Катализированная реакция перекрестной связки алкоксидиборона с галоарентами: прямая процедура для арилборинических сложных эфиров». Журнал органической химии . 60 (23): 7508–7510. doi : 10.1021/jo00128a024 . S2CID 98029876 .
- ^ Кидвелл, RL; Мерфи, М.; Дарлинг, SD (1969). «Фенолы: 6-метокси-2-нафтол» . Органические синтезы . 49 : 90 ; Собранные объемы , вып. 5, с. 918 .
- ^ Washburn, Robert M.; Левенс, Эрнест; Олбрайт, Чарльз Ф.; Биллиг, Франклин А. (1959). «Бензотборинован -ангидрид» . Органические синтезы . 39 : 3 ; Собранные объемы , вып. 4, с. 68
- ^ Чан, Доминик М.Т. (2003). «Медь способствует перекрестному связке C-N и C-O с фенил и пиридилбонатами». Тетраэдр буквы . 44 (19): 3863–3865. doi : 10.1016/s0040-4039 (03) 00739-1 .
- ^ Лам, Патрик Ю.С. (2003). «Поперечная медь/катализированная C-N и C-O-перекрестная связь с винилбороновой кислотой и ее коммунальными услугами». Тетраэдр буквы . 44 (26): 4927–4931. doi : 10.1016/s0040-4039 (03) 01037-2 .
- ^ Зибер, Джошуа Д. (2007). «Каталитическое сопряжение добавление аллильных групп к стиль-активированным энонами». Журнал Американского химического общества . 129 (8): 2214–2215. Citeseerx 10.1.1.624.3153 . doi : 10.1021/ja067878w . PMID 17266312 .
- ^ Габриэла (2007). «Бензиловая замена граминов борновыми кислотами и родиевыми или иридиальными катализаторами †». Органические буквы . 9 (6): 961–964. doi : 10.1021/ol063042m . PMID 17305348 .
- ^ Matteson, Donald S. (1986). «99% хирально селективный синтез через пинанол бориновые эфиры: феромоны насекомых, диолы и амино -алкоголь». Журнал Американского химического общества . 108 (4): 810–819. doi : 10.1021/ja00264a039 .
- ^ Пенг, Фэн (2007). «Простые, стабильные и универсальные двойные реагенты для стереоселективного приготовления скелетно разнообразных соединений». Журнал Американского химического общества . 129 (11): 3070–3071. doi : 10.1021/ja068985t . PMID 17315879 .
- ^ Matteson, Donald S. (2003). «Новые асимметричные синтезы с бориновыми эфирами и флуороборанами» (PDF) . Чистое приложение. Химический 75 (9): 1249–1253. doi : 10.1351/pac200375091249 . S2CID 15944330 .
- ^ Кианмер, Эбрагим; Яхьяи, Марьям; Tabatabai, Katayoun (2007). «Мягкое превращение арилбороновых кислот и их пинаколил -боронатных сложных эфиров в фенолы с использованием гидроксиламина». Тетраэдр буквы . 48 (15): 2713–2715. doi : 10.1016/j.tetlet.2007.02.069 .
- ^ Ишьяма, Тацуо; Мурата, Мики; Ахико, Така-Аки; Мияура, Норио (2000). "Бис (Пинаколатот) Дигорон " Органические синтезы 77 : 176 ; Собранные объемы , вып. 10, с. 115 .
- ^ Takagi, Jun (2002). «Катализируемая иридием реакция связывания C-H гетероароматических соединений с бис (пинаколато) дибуроном: региоселективный синтез гетероарилбонатов». Тетраэдр буквы . 43 (32): 5649–5651. doi : 10.1016/s0040-4039 (02) 01135-8 . HDL : 2115/56222 .
- ^ Исияма, Тацуо (2002). «Легкое, катализируемое иридием борилирование арен. Журнал Американского химического общества . 124 (3): 390–391. doi : 10.1021/ja0173019 . PMID 11792205 .
- ^ Исияма, Тацуо (2003). «Борилирование в комнатной температуре аренах и гетероарена с использованием стехиометрических количеств пинаколборина, катализируемого иридиевыми комплексами в инертном растворителе». Химическая связь (23): 2924–5. doi : 10.1039/b311103b . HDL : 2115/56377 . PMID 14680243 . S2CID 34802662 .
- ^ Мерфи, Жаклин М. (2007). «Малогация мета-дизамещенных 1,3-разъединенных с помощью иридий-катализируемого Арен Борилирование». Журнал Американского химического общества . 129 (50): 15434–15435. doi : 10.1021/ja076498n . PMID 18027947 .
- ^ Чжао, Цзянжан; Дэвидсон, Мэтью Г.; Махон, Мэри Ф.; Kociok-Köhn, Габриэле; Джеймс, Тони Д. (2004). «Энантиоселективный флуоресцентный датчик для сахарных кислот». J. Am. Химический Соц 126 (49): 16179–16186. doi : 10.1021/ja046289s . PMID 15584754 .
- ^ Джеймс, Тони Д.; Филлипс, Маркус Д.; Shinkai, Seiji (2006). Бороновые кислоты при распознавании сахаридов . doi : 10.1039/9781847557612 . ISBN 978-0-85404-537-2 .
- ^ Роуэн, Стюарт Дж .; Кантрилл, Стюарт Дж.; Двоюродные братья, Грэм Р.Л.; Сандерс, Джереми К.М.; Stoddart, J. Fraser (2002). «Динамическая ковалентная химия». Angewandte Chemie International Edition . 41 (6): 898–952. doi : 10.1002/1521-3773 (20020315) 41: 6 <898 :: Aid-Anie898> 3.0.co; 2-e . PMID 12491278 .
- ^ US 6850786 , фронт-марш Уэйна, «Датчик глазного аналита», выпущен 2005-02-01
![Реакция Сузуки {\ displaystyle {\ begin {matrix} {} \\ {\ ce {{r1-by2}+r2-x-> [{\ underset {\ text {catalyst}} {\ text {pd}}}] [{{{ \ text {base}}] r1-r2}} \\ {} \ end {matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35df36f38fec8abbc8e9d1d9f04e9b2687ae245)