2-пиридон
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
Пиридин-2(1H ) -он | |||
| Другие имена
2(1H ) -пиридинон
2(1H ) -Пиридон 1 H -Пиридин-2-он 2-пиридон 1,2-Дигидро-2-оксопиридин 1 H -2-Пиридон 2-оксопиридон 2-пиридинол 2-гидроксипиридин | |||
| Идентификаторы | |||
3D model ( JSmol )
|
| ||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.005.019 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 5 Н 5 Н О | |||
| Молярная масса | 95.101 g·mol −1 | ||
| Появление | Бесцветное кристаллическое вещество | ||
| Плотность | 1,39 г/см 3 | ||
| Температура плавления | 107,8 ° C (226,0 ° F; 380,9 К) | ||
| Точка кипения | 280 ° C (536 ° F; 553 К) разл. | ||
| Растворимость в других растворителях | Растворим в воде , метанол , ацетон | ||
| Кислотность ( pKa ) | 11.65 | ||
| УФ-видимое излучение (λ макс .) | 293 нм (ε 5900, раствор H 2 O) | ||
| Структура | |||
| орторомбический | |||
| плоский | |||
| 4,26 Д | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности
|
раздражающий | ||
| СГС Маркировка : | |||
 
| |||
| Опасность | |||
| Х301 , Х315 , Х319 , Х335 | |||
| P261 , P264 , P270 , P271 , P280 , P301+P310 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P330 , P332+P313 , P337+P313 , П362 , П403+П233 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 210 ° C (410 ° F; 483 К) | ||
| Родственные соединения | |||
Другие анионы
|
2-пиридинолат | ||
Другие катионы
|
2-гидроксипиридиний-ион | ||
Связанные функциональные группы
|
алкоголь , лактам , лактим , пиридин , кетон | ||
Родственные соединения
|
пиридин , тимин , цитозин , урацил , бензол | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
2-Пиридон представляет собой органическое соединение формулы C.
55Ч
4 NH(О) . Это бесцветное твердое вещество. Хорошо известно, что он образует димеры с водородными связями , и это также классический случай соединения, существующего в виде таутомеров .
Таутомерия
[ редактировать ]
Второй таутомер — 2-гидроксипиридин. Эта лактам- лактимная таутомерия также может проявляться во многих родственных соединениях. [ 1 ]
Таутомерия в твердом состоянии
[ редактировать ]Амидная кислородсодержащими группа может участвовать в образовании водородных связей с другими азот- и соединениями .
Преобладающей твердой формой является 2-пиридон. Это было подтверждено рентгеновской кристаллографией , которая показывает, что водород в твердом состоянии ближе к азоту, чем к кислороду (из-за низкой плотности электронов у водорода точное позиционирование затруднено), и ИК-спектроскопией , которая показывает что продольная частота C=O присутствует, а частоты OH отсутствуют. [ 2 ] [ 3 ] [ 4 ] [ 5 ]
Таутомерия в растворе
[ редактировать ]Таутомеризация изучена достаточно полно. Разница в энергии кажется очень маленькой. Неполярные растворители предпочитают 2-гидроксипиридин, тогда как полярные растворители, такие как спирты и вода, предпочитают 2-пиридон. [ 1 ] [ 6 ] [ 7 ]
Разница энергий двух таутомеров в газовой фазе, измеренная с помощью ИК-спектроскопии, составляет от 2,43 до 3,3 кДж / моль для твердого состояния и 8,95 кДж/моль и 8,83 кДж/моль для жидкого состояния. [ 8 ] [ 9 ] [ 10 ]
Механизм таутомеризации А
[ редактировать ]Одномолекулярная таутомеризация имеет запрещенное 1-3 супрафациальное переходное состояние и, следовательно, имеет высокий энергетический барьер для этой таутомеризации , который, по расчетам теоретических методов, составляет 125 или 210 кДж/моль. Прямая таутомеризация энергетически невыгодна. Существуют и другие возможные механизмы этой таутомеризации. [ 10 ]
Димеризация
[ редактировать ]2-Пиридон и 2-гидроксипиридин могут образовывать димеры с двумя водородными связями. [ 11 ]
Агрегация в твердом состоянии
[ редактировать ]В твердом состоянии димерная форма отсутствует; 2-пиридоны образуют спиральную структуру по водородным связям. Некоторые замещенные 2-пиридоны образуют димер в твердом состоянии, например 5-метил-3-карбонитрил-2-пиридон. Определение всех этих структур было сделано методом рентгеновской кристаллографии . В твердом состоянии водород расположен ближе к азоту, поэтому можно считать правильным называть бесцветные кристаллы в колбе 2-пиридоном. [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ]
Агрегация в растворе
[ редактировать ]В растворе присутствует димерная форма; степень димеризации сильно зависит от полярности растворителя. Полярные и протонные растворители взаимодействуют с водородными связями больше мономера , в результате чего образуется . Гидрофобные эффекты в неполярных растворителях приводят к преобладанию димера. Соотношение таутомерных форм также зависит от растворителя. Все возможные таутомеры и димеры могут присутствовать и образовывать равновесие, а точное измерение всех констант равновесия в системе чрезвычайно затруднено. [ 11 ] [ 12 ] [ 13 ] [ 14 ] [ 15 ] [ 16 ] [ 17 ] [ 18 ] [ 19 ] [ 20 ]
( ЯМР-спектроскопия — медленный метод, ИК-спектроскопия высокого разрешения в растворителе затруднена, широкое поглощение в УФ-спектроскопии затрудняет различение 3 и более очень похожих молекул ).
Некоторые публикации фокусируют внимание только на одной из двух возможных моделей и игнорируют влияние другой. Например, расчет разности энергий двух таутомеров в неполярном растворе приведет к неправильному результату, если большое количество вещества находится на стороне димера, находящегося в равновесии.
Механизм таутомеризации B
[ редактировать ]Прямая таутомеризация энергетически не выгодна, но димеризация с последующим двойным переносом протона и диссоциацией димера представляет собой автокаталитический путь от одного таутомера к другому. Протонные растворители также опосредуют перенос протонов во время таутомеризации.
Синтез
[ редактировать ]2-Пирон можно получить реакцией циклизации и превратить в 2-пиридон посредством реакции обмена с аммиаком :
Пиридин образует N -оксид с некоторыми окислителями, такими как перекись водорода . Этот пиридин- N -оксид подвергается реакции перегруппировки в 2-пиридон в уксусном ангидриде : [ 21 ] [ 22 ] [ 23 ]
В реакции конденсации Гуарески-Торпа цианацетамид реагирует с 1,3-дикетоном с образованием 2-пиридона . [ 12 ] [ 13 ] Реакция названа в честь Исилио Гуарески и Джослин Филд Торп . [ 14 ] [ 15 ]
Химические свойства
[ редактировать ]Каталитическая активность
[ редактировать ]2-Пиридон катализирует множество протонзависимых реакций, например аминолиз сложных эфиров. В некоторых случаях в качестве растворителя используют расплавленный 2-пиридон. 2-Пиридон оказывает большое влияние на реакцию активированных эфиров с аминами в неполярном растворителе , что объясняется его таутомеризацией и применением в качестве дитопного рецептора. Перенос протона от 2-пиридона и его таутомера исследовался методами изотопной метки , кинетикой и квантово-химическими методами. [ 16 ] [ 17 ] [ 24 ]
Координационная химия
[ редактировать ]2-Пиридон и некоторые производные служат лигандами в координационной химии, обычно в виде 1,3-мостикового лиганда, родственного карбоксилату . [ 18 ]
На природе
[ редактировать ]2-Пиридон не встречается в природе, но его производное было выделено в качестве кофактора в некоторых гидрогеназах . [ 19 ]
Экологическое поведение
[ редактировать ]2-Пиридон быстро разлагается микроорганизмами в почвенной среде, период полураспада составляет менее одной недели. [ 20 ] Ряд исследователей выделили организмы, способные расти на 2-пиридоне как единственном источнике углерода, азота и энергии. Наиболее изученным разрушителем 2-пиридона является грамположительная бактерия Arthrobacter Crystallopoietes . [ 25 ] член типа Actinomycetota , который включает многочисленные родственные организмы, которые, как было показано, разлагают пиридин или один или несколько алкил-, карбоксил- или гидроксизамещенных пиридинов. Деградация 2-пиридона обычно инициируется атакой монооксигеназы, в результате чего образуется диол, такой как 2,5-дигидроксипиридин, который метаболизируется по малеаматному пути. Деление кольца происходит под действием 2,5-дигидроксипиридинмонооксигеназы, которая также участвует в метаболизме никотиновой кислоты по малеаматному пути. В случае Arthrobacter Crystallopoietes по крайней мере часть пути деградации осуществляется через плазмиды. [ 26 ] Пиридиндиолы подвергаются химическому превращению в растворе с образованием интенсивно окрашенных пигментов. Подобные пигменты наблюдались при разложении хинолина . [ 27 ] также из-за трансформации метаболитов, однако желтые пигменты, о которых часто сообщается при разложении многих пиридиновых растворителей, таких как незамещенный пиридин или пиколин , обычно возникают в результате перепроизводства рибофлавина в присутствии этих растворителей. [ 28 ] Вообще говоря, деградация пиридонов, дигидроксипиридинов и пиридинкарбоновых кислот обычно опосредована оксигеназами, тогда как деградация пиридиновых растворителей часто не происходит и в некоторых случаях может включать начальную стадию восстановления. [ 26 ]
Аналитические данные
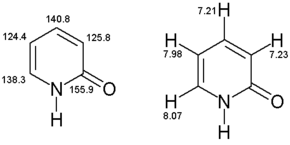
[ редактировать ]1 H-ЯМР
[ редактировать ]1 H-ЯМР (400 МГц, CD 3 OD): /ρ = 8,07 (дд, 3 Дж=2,5Гц, 4 J = 1,1 Гц, 1H, C-6), 7,98 (дд, 3 J = 4,0 Гц, 3 J = 2,0 Гц, 1H, C-3), 7,23 (дд, 3 Дж=2,5Гц, 3 J = 2,0 Гц, 1H, C-5), 7,21 (дд, 3 J = 4,0 Гц, 4 J = 1,0 Гц, 1H, С-4).
13 С-ЯМР
[ редактировать ](100,57 МГц, CD 3 ОД): ρ = 155,9 (С-2), 140,8 (С-4), 138,3 (С-6), 125,8 (С-3), 124,4 (С-5)
(MeOH): ν max (lg ε) = 226,2 (0,44), 297,6 (0,30).
(КБр): ν = 3440 см −1 –1 (уш, м), 3119 (м), 3072 (м), 2986 (м), 1682 (с), 1649 (вс), 1609 (вс), 1578 (вс), 1540 (с), 1456 (м), 1433 (м), 1364 (ж), 1243 (м), 1156 (м), 1098 (м), 983 (м), 926 (ж), 781 (с), 730 (ж), 612 (ж), 560 (ж), 554 (ж), 526 (м), 476 (м), 451 (ж).
ЭУ-МС (70 эВ): m/z (%) = 95 (100) [М + ], 67 (35) [М + - СО], 51 (4) [С 4 Н 3 + ].
- Если не указано иное, данные относятся к стандартной температуре и давлению .
- Общие сведения о достоверности данных .
Ссылки
[ редактировать ]- Кокс Р.Х., Ботнер-Бай А.А. (1969). «Спектры протонного магнитного резонанса таутомерно-замещенных пиридинов и сопряженных с ними кислот». Журнал физической химии . 73 (8): 2465. doi : 10.1021/j100842a001 .
- Д. В. Акснес (1972). «Эффекты заместителя и растворителя в спектрах протонного магнитного резонанса (ПМР) шести 2-замещенных пиридинов» (PDF) . Acta Chemica Scandinavica . 26 : 2255–2266. doi : 10.3891/acta.chem.scand.26-2255 .
- Брюгель В. (1962). «Спектры ядерного магнитного резонанса производных пиридина» . Журнал электрохимии, отчеты Общества физической химии Бунзена . 66 (2): 159–177. дои : 10.1002/bbpc.19620660211 . S2CID 98754100 .
- Робертс Дж.Д., Фон Оствальден П.В. (1971). «Ядерно-магнитно-резонансная спектроскопия. Протонные спектры 2-пиридонов». Журнал органической химии . 36 (24): 3792. doi : 10.1021/jo00823a029 .
См. также
[ редактировать ]- 2-Пирон
- 4-пиридон
- 5-метил-2-пиридон используется для производства пирфенидона .
Ссылки
[ редактировать ]- ^ Jump up to: а б с Форлани Л., Кристони Г., Бога К., Тодеско П.Е., Дель Веккьо Э., Сельва С., Монари М. (2002). «Повторное исследование таутомерии некоторых замещенных 2-гидроксипиридинов» . Аркивок . XI (11): 198–215. дои : 10.3998/ark.5550190.0003.b18 . hdl : 2027/spo.5550190.0003.b18 .
- ^ Jump up to: а б Ян Х.В., Крейвен Б.М. (1998). «Плотность заряда 2-пиридона». Акта Кристаллогр. Б. 54 (6): 912–920. дои : 10.1107/S0108768198006545 . ПМИД 9880899 . S2CID 9505447 .
- ^ Jump up to: а б Пенфолд БР (1953). «Распределение электронов в кристаллическом альфа-пиридоне» . Акта Кристаллогр . 6 (7): 591–600. Бибкод : 1953AcCry...6..591P . дои : 10.1107/S0365110X5300168X .
- ^ Jump up to: а б Омс У., Гут Х., Хеллер Э., Даннёль Х., Швейг А. (1984). «Сравнение наблюдаемой и расчетной электронной плотности 2-пиридона, C 5 H 5 NO, уточнения кристаллической структуры при 295 К и 120 К, экспериментальные и теоретические исследования плотности деформации». З. Кристаллогр . 169 : 185–200. дои : 10.1524/zkri.1984.169.14.185 . S2CID 97575334 .
- ^ Jump up to: а б Альмлёф Й., Квик А., Оловссон И. (1971). «Исследование водородной связи кристаллической структуры межмолекулярного комплекса 2-пиридон-6-хлор-2-гидроксипиридин». Акта Кристаллогр. Б. 27 (6): 1201–1208. дои : 10.1107/S0567740871003753 .
- ^ Ауэ Д.Х., Бетовски Л.Д., Дэвидсон В.Р., Бауэр М.Т., Бик П. (1979). «Основность амидов и имидатов в газовой фазе - оценка констант протомерного равновесия методом основности в газовой фазе». Журнал Американского химического общества . 101 (6): 1361–1368. дои : 10.1021/ja00500a001 .
- ^ Фрэнк Дж., Алан Р. Катрицки (1976). «Таутомерные пиридины. XV. Пиридон-гидроксипиридиновые равновесия в растворителях различной полярности». J Chem Soc Perkin Trans 2 (12): 1428–1431. дои : 10.1039/p29760001428 .
- ^ Браун Р.С., Це А., Ведерас Дж.К. (1980). «Фотоэлектроопределенные энергии связи ядра и предсказанная основность газовой фазы для системы 2-гидроксипиридин-2-пиридон». Журнал Американского химического общества . 102 (3): 1174–1176. дои : 10.1021/ja00523a050 .
- ^ Бик П. (1977). «Энергия и алкилирование таутомерных гетероциклических соединений - старые проблемы, новые ответы». Акк. хим. Рез. 10 (5): 186–192. дои : 10.1021/ar50113a006 .
- ^ Jump up to: а б Абдулла Х.И., Эль-Бермани М.Ф. (2001). «Инфракрасные исследования таутомерии в 2-гидроксипиридине, 2-тиопиридине и 2-аминопиридине». Spectrochimica Acta Часть A: Молекулярная и биомолекулярная спектроскопия . 57 (13): 2659–2671. Бибкод : 2001AcSpA..57.2659A . дои : 10.1016/S1386-1425(01)00455-3 . ПМИД 11765793 .
- ^ Jump up to: а б Хаммес Г.Г., Лиллфорд П.Дж. (1970). «Кинетическое и равновесное исследование димеризации водородной связи 2-пиридона в растворителе, связывающем водородные связи». Дж. Ам. хим. Соц. 92 (26): 7578–7585. дои : 10.1021/ja00729a012 .
- ^ Jump up to: а б Гилкрист, ТЛ (1997). Гетероциклическая химия ISBN 0-470-20481-8
- ^ Jump up to: а б Рыбаков В.Р., Буш А.А., Бабаев Е.Б., Асланов Л.А. (2004). «3-Циано-4,6-диметил-2-пиридон (Гуарески пиридон)». Acta Crystallogr E. 6 (2): о160–о161. Бибкод : 2004AcCrE..60O.160R . дои : 10.1107/S1600536803029295 .
- ^ Jump up to: а б И. Гуарески (1896). "Mem. Reale Accad. Sci. Torino II".
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Jump up to: а б Барон Х., Ремфри, ФГП, Торп, Дж. Ф. (1904). «CLXXV.-Образование и реакции иминосоединений. Часть I. Конденсация этилцианоацетата с его натриевым производным» . Дж. Хим. соц., пер . 85 : 1726–1761. дои : 10.1039/ct9048501726 . Архивировано из оригинала 14 сентября 2020 г. Проверено 5 июня 2020 г.
- ^ Jump up to: а б Фишер CB, Штайнингер Х., Стивенсон Д.С., Зипсе Х. (2005). «Катализ аминолиза 4-нитрофенилацетата 2-пиридоном». Журнал физической органической химии . 18 (9): 901–907. дои : 10.1002/poc.914 .
- ^ Jump up to: а б Л.-Х. Ван, Х. Зипсе (1996). «Бифункциональный катализ аминолиза эфиров - вычислительное и экспериментальное исследование» . Либигс Анна . 1996 (10): 1501–1509. дои : 10.1002/jlac.199619961003 . Архивировано из оригинала 01 сентября 2021 г. Проверено 1 сентября 2021 г.
- ^ Jump up to: а б Роусон Дж. М., Winpenny REP (1995). «Координационная химия 2-пиридонов и его производных». Обзоры координационной химии . 139 (139): 313–374. дои : 10.1016/0010-8545(94)01117-Т .
- ^ Jump up to: а б Шима, С.; Лион, Э.Дж.; Сордел-Клипперт, М.; Каусс, М.; Кант, Дж.; Тауэр, РК; Штайнбах, К.; Се, X.; Вердье Л. и Гризингер К., «Выяснение структуры: кофактор свободной гидрогеназы железо-серного кластера Hmd: структура продукта инактивации светом», Angew. хим. Межд. Ред., 2004, 43, 2547-2551.
- ^ Jump up to: а б Симс, Джеральд К., С. (1985). «Деградация производных пиридина в почве» . Журнал качества окружающей среды . 14 (4): 580–584. Бибкод : 1985JEnvQ..14..580S . дои : 10.2134/jeq1985.00472425001400040022x . Архивировано из оригинала 30 августа 2008 г.
- ^ «Реакция между пиридин-N-оксидом и ангидридом кислоты» [Реакция между пиридин-N-оксидом и ангидридом кислоты] . Якугаку Засши (на японском языке) 67 (3–4): 51–52. doi : 10.1248/yakushi1947. .67.3-4_51 .
- ^ Очиай Э (1953). «Недавние японские работы по химии пиридин-1-оксида и родственных соединений». Журнал органической химии . 18 (5): 534–551. дои : 10.1021/jo01133a010 .
- ^ Букельхайде V, Лен В.Л. (1961). «Перегруппировка замещенных пиридиновых N-оксидов уксусным ангидридом 1.2». Журнал органической химии . 26 (2): 428–430. дои : 10.1021/jo01061a037 .
- ^ Фишер CB, Полборн К., Штайнингер Х., Зипсе Х. (2004). «Синтез и твердотельные структуры алкилзамещенных 3-циано-2-пиридонов» (PDF) . Zeitschrift für Naturforschung . 59 (59б): 1121–1131. дои : 10.1515/znb-2004-1008 . S2CID 98273691 . Архивировано из оригинала (требуется подписка) 30 октября 2008 г. Проверено 7 ноября 2006 г.
- ^ Прапорщик JC, Риттенберг SC (1963). «Кристаллический пигмент, полученный из 2-гидроксипиридина Arthrobacter Crystallopoietes n.sp». Архив микробиологии . 47 (2): 137–153. дои : 10.1007/BF00422519 . ПМИД 14106078 . S2CID 6389661 .
- ^ Jump up to: а б Симс Г.К., О'Локлин Э., Кроуфорд Р. (1989). «Деградация пиридинов в окружающей среде» (PDF) . Критические обзоры CRC в области экологического контроля . 19 (4): 309–340. Бибкод : 1989CRvEC..19..309S . дои : 10.1080/10643388909388372 . Архивировано из оригинала (PDF) 27 мая 2010 г.
- ^ Олофлин Э., Кермейер С., Симс Г. (1996). «Выделение, характеристика и использование субстрата бактерии, разлагающей хинолин». Международная биопорча и биодеградация . 38 (2): 107–118. Бибкод : 1996IBiBi..38..107O . дои : 10.1016/S0964-8305(96)00032-7 .
- ^ Симс, Джеральд К., О (1992). «Продукция рибофлавина при выращивании Micrococcus luteus на пиридине» . Прикладная и экологическая микробиология . 58 (10): 3423–3425. Бибкод : 1992ApEnM..58.3423S . дои : 10.1128/АЕМ.58.10.3423-3425.1992 . ПМК 183117 . ПМИД 16348793 .
Дальнейшее чтение
[ редактировать ]Общий
[ редактировать ]- Энгдаль К., Альберг П. (1977). Журнал химических исследований : 340–341.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - Бенсауд О., Шеврие М., Дюбуа Дж. (1978). «Лактим-лактамное таутомерное равновесие 2-гидроксипиридинов. 1. Механизм связывания катионов, димеризации и взаимного превращения в апротонных растворителях. Спектроскопическое исследование и кинетическое исследование при скачке температуры». Дж. Ам. хим. Соц. 100 (22): 7055–7066. дои : 10.1021/ja00490a046 .
- Бенсауд О., Дрейфус Г., Додин Г., Дюбуа Дж. (1977). «Внутримолекулярный недиссоциативный перенос протона в водных растворах таутомерных гетероциклов: кинетическое исследование температурного скачка». Дж. Ам. хим. Соц. 99 (13): 4438–4446. дои : 10.1021/ja00455a037 .
- Бенсауд О., Шеврие М., Дюбуа Дж. (1978). «Влияние гидратации на таутомерное равновесие». Тетраэдр Летт. 19 (25): 2221–2224. дои : 10.1016/S0040-4039(01)86850-7 .
- Хаммес Г.Г., Парк AC (1969). «Кинетические и термодинамические исследования водородной связи». Дж. Ам. хим. Соц. 91 (4): 956–961. дои : 10.1021/ja01032a028 .
- Хаммес Г.Г., Спиви Х.О. (1966). «Кинетическое исследование димеризации водородной связи 2-пиридона». Дж. Ам. хим. Соц. 88 (8): 1621–1625. дои : 10.1021/ja00960a006 . ПМИД 5942979 .
- Бик П., Ковингтон Дж.Б., Смит С.Г. (1976). «Структурные исследования таутомерных систем: важность ассоциации 2-гидроксипиридин-2-пиридона и 2-меркаптопиридин-2-тиопиридона». Дж. Ам. хим. Соц. 98 (25): 8284–8286. дои : 10.1021/ja00441a079 .
- Бик П., Ковингтон Дж.Б., Уайт Дж.М. (1980). «Количественная модель воздействия растворителей на равновесия гидроксипиридин-пиридон и меркаптопиридин-тиопиридон: корреляция с эффектами реакционного поля и водородных связей». Дж. Орг. хим. 45 (8): 1347–1353. дои : 10.1021/jo01296a001 .
- Бик П., Ковингтон Дж.Б., Смит С.Г., Уайт Дж.М., Зейглер Дж.М. (1980). «Смещение протомерного равновесия путем самоассоциации: пары изомеров гидроксипиридин-пиридон и меркаптопиридин-тиопиридон». Дж. Орг. хим. 45 (8): 1354–1362. дои : 10.1021/jo01296a002 .
Таутомерия
[ редактировать ]- Фёгели У., фон Филипсборн В. (1973). «Исследование структуры N-метил-3-пиридона и 3-гидропиридина с помощью ЯМР-спектроскопии C-13 и H-1». Организация Магн Резон . 5 (12): 551–559. дои : 10.1002/mrc.1270051202 .
- Спекер Х., Гаврош Х. (1942). «Ультрафиолетовая абсорбция бензтриаксола, приридона и его солей». хим. Бер. (75): 1338–1348. дои : 10.1002/cber.19420751115 . </ref><ref> Лейс Д.Г., Карран, Британская Колумбия (1945). «Электрические моменты некоторых гамма-замещенных пиридинов». Журнал Американского химического общества . 67 (1): 79–81. дои : 10.1021/ja01217a028 .
- Альберт А., Филлипс Дж. Н. (1956). «Константы ионизации гетероциклических веществ, гидроксипроизводных азотистых шестичленных соединений». Дж. Хим. Соц. : 1294–1304. дои : 10.1039/jr9560001294 .
- Кокс Р.Х., Ботнер-Бай А.А. (1969). «Спектры протонного магнитного резонанса таутомерно-замещенных пиридинов и их сопряженных кислот». Дж. Физ. Хим . 73 (8): 2465–2468. дои : 10.1021/j100842a001 .
- Акснес Д.В., Криви, Криви Х., Самуэльсон О., Сьёстранд Э., Свенссон С. (1972). «Эффекты заместителя и растворителя в спектрах протонного магнитного резонанса (ПМР) 6 2-замещенных пиридинов» . Акта Хим. Скан . 26 (26): 2255–2266. doi : 10.3891/acta.chem.scand.26-2255 .