Реакция омологации
В органической химии , реакция гомологизации также известная как гомологизация , представляет собой любую химическую реакцию , которая превращает реагент в следующий член гомологического ряда . Гомологический ряд – это группа соединений, отличающихся постоянной единицей, обычно метиленом ( −CH 2 − ) группа. Реагенты проходят омологацию при увеличении числа повторяющихся структурных единиц в молекулах. Наиболее распространенные реакции гомологации увеличивают количество метилена ( −CH 2 − ) звенья насыщенной цепи внутри молекулы. [1] Например, реакция альдегидов или кетонов с диазометаном или метоксиметилентрифенилфосфином с образованием следующего гомолога в ряду.
Примеры реакций гомологации включают:
- Синтез Килиани-Фишера , при котором молекула альдозы удлиняется посредством трехэтапного процесса, состоящего из:
- Нуклеофильное присоединение цианида к карбонилу с образованием циангидрина.
- Гидролиз с образованием лактона
- Восстановление с образованием гомологичной альдозы
- Реакция Виттига альдегида с метоксиметилентрифенилфосфином , в результате которой образуется гомологичный альдегид.
- Реакция Арндта-Эйстерта представляет собой серию химических реакций, предназначенных для превращения карбоновой кислоты в высший гомолог карбоновой кислоты (т.е. содержащий один дополнительный атом углерода).
- Омологация эфира Ковальского , альтернатива синтезу Арндта-Эйстерта. Был использован для преобразования сложных эфиров β-аминоэфиров из сложных эфиров α-амино через промежуточный инолат . [2]
- Омологация Сейферта-Гилберта , при которой альдегид превращается в концевой алкин, а затем гидролизуется обратно в альдегид.
Некоторые реакции увеличивают длину цепи более чем на одну единицу. Например, реакцию ДеМайо можно считать реакцией двухуглеродной гомологизации.
Сокращение цепи
[ редактировать ]Аналогично длину цепи можно уменьшить:
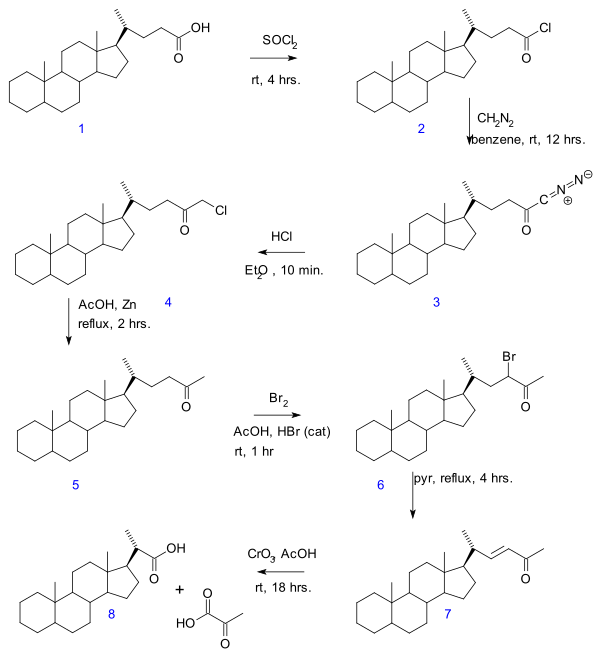
- При разложении Галлахера-Холландера (1946) пировиноградная кислота удаляется из линейной алифатической карбоновой кислоты , образуя новую кислоту с на 2 атома углерода меньше. [3] В оригинальной публикации речь идет о превращении желчной кислоты в серии реакций: хлорангидрида ( 2 образование ) с тионилхлоридом , диазокетона образование ( 3 ) с диазометаном , образование хлорметилкетона ( 4 ) с соляной кислотой , органическое восстановление хлора до метилкетона ( 5 ), галогенирование кетона до 6 , реакция отщепления пиридином 7 до енона и , наконец, окисление триоксидом хрома до биснорхолановой кислоты 8 .
- В реакции Хукера (1936) алкильная цепь в определенном нафтохиноне (феномен, впервые обнаруженный в соединении лапахола ) восстанавливается на одну метиленовую единицу в виде углекислого газа при каждом перманганата калия окислении . [4] [5]

- Механистически окисление вызывает расщепление кольца по алкеновой группе, экструзию углекислого газа при декарбоксилировании с последующим замыканием кольца.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Энциклопедия неорганической химии два : 10.1002/0470862106.id396
- ^ Д. Грей, К. Конселлон и Т. Галлахер (2004). «Омологация эфиров Ковальского. Применение к синтезу сложных эфиров β-амино». Дж. Орг. хим. 69 (14): 4849–4851. дои : 10.1021/jo049562h . ПМИД 15230615 .
- ^ Винсент П. Холландер и Т.Ф. ГаллахерЧАСТИЧНЫЙ СИНТЕЗ СОЕДИНЕНИЙ, СВЯЗАННЫХ С ГОРМОНАМИ КОРЫ НАДПОЧЕЧНИКОВ. VII. ДЕГРАДАЦИЯ БОКОВОЙ ЦЕПИ ХОЛАНОВОЙ КИСЛОТЫ Ж. Биол. хим. , март 1946 г .; 162:549 - 554 Ссылка
- ^ Об окислении производных 2-гидрокси-1,4-нафтохинона щелочным перманганатом калия Сэмюэл К. Хукер Дж. Ам. хим. Соц. 1936 год ; 58(7); 1174-1179. два : 10.1021/ja01298a030
- ^ Об окислении производных 2-гидрокси-1,4-нафтохинона щелочным перманганатом калия. Часть II. Соединения с ненасыщенными боковыми цепями Сэмюэл К. Хукер и Эл Стейермарк Дж. Ам. хим. Соц. 1936 год ; 58(7); стр. 1179 - 1181; два : 10.1021/ja01298a031