Реакция Сузуки
| Реакция Сузуки | |
|---|---|
| Назван в честь | Акира Сузуки |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Сузуки-муфта |
| RSC Идентификатор онтологии | RXNO: 0000140 |
Реакция Сузуки или сочетание Сузуки представляет собой органическую реакцию , в которой используется палладиевый комплексный катализатор для перекрестного связывания бороновой кислоты с галогенорганическим соединением . [1] [2] [3] Впервые он был опубликован в 1979 году Акирой Судзуки , и он разделил Нобелевскую премию по химии 2010 года с Ричардом Ф. Хеком и Эйичи Негиши за их вклад в открытие и развитие катализа благородных металлов в органическом синтезе . [4] Эту реакцию иногда совмещают с родственным борилированием Мияуры ; комбинация представляет собой реакцию Сузуки-Мияуры . Он широко используется для синтеза полиолефинов и , стиролов замещенных бифенилов .
Общая схема реакции Сузуки показана ниже, где одинарная связь углерод-углерод образуется путем сочетания галогенида (R 1 -X) с борорганическими соединениями (R 2 -BY 2 ) с использованием палладиевого катализатора и основания . Борорганические соединения обычно синтезируются путем гидроборирования или карбоборирования , что позволяет быстро создавать сложные молекулярные структуры.

Было опубликовано несколько обзоров, описывающих достижения и развитие реакции Сузуки. [5] [6] [7]
Механизм реакции
[ редактировать ]Механизм . реакции Сузуки лучше всего рассматривать с точки зрения палладиевого катализатора Каталитический цикл инициируется образованием активного Pd 0 каталитические виды, A . Он участвует в окислительном присоединении палладия к галогенидному реагенту 1 с образованием палладиевого промежуточного B. соединения Реакция ( метатезис ) с основанием дает промежуточное соединение C , которое посредством трансметаллирования [8] с боронатным комплексом D реакцией боронового реагента 2 с основанием) образуется переходная палладийорганическая форма E. ( полученным Стадия восстановительного элиминирования приводит к образованию желаемого продукта 3 и восстанавливает исходный палладиевый катализатор А, который завершает каталитический цикл .

Сцепление Сузуки происходит при наличии базы и роль базы долгое время не была до конца понятна. Сначала предполагалось, что основание образует триалкилборат (R 3 B-OR) в случае реакции триалкилборана (BR 3 ) и алкоксида ( − ИЛИ); этот вид можно считать более нуклеофильным , а затем более реакционноспособным по отношению к комплексу палладия, присутствующему на стадии трансметаллирования. [9] [10] [11] Дюк и его коллеги исследовали роль основания в механизме реакции сочетания Сузуки и обнаружили, что основание выполняет три роли: образование комплекса палладия [ArPd(OR)L 2 ), образование триалкилбората и ускорение стадия восстановительного элиминирования путем реакции алкоксида с комплексом палладия. [9]
Окислительное присоединение
[ редактировать ]В большинстве случаев окислительное присоединение является стадией, определяющей скорость каталитического цикла. [12] На этом этапе палладиевый катализатор окисляется из палладия (0) в палладий (II). Каталитически активная разновидность палладия A соединяется с арилгалогенидным субстратом 1 с образованием палладиевого органического B. комплекса Как видно на диаграмме ниже, стадия окислительного присоединения разрывает связь углерод - галоген , где палладий теперь связан как с галогеном (X), так и с R. 1 группа.

Окислительное присоединение протекает с сохранением стереохимии с винилгалогенидами , но дает инверсию стереохимии с аллильными и бензилгалогенидами . [13] В результате окислительного присоединения первоначально образуется цис -палладиевый комплекс, который быстро изомеризуется в транс-комплекс. [14]

Сочетание Сузуки происходит с сохранением конфигурации двойных связей как для борорганического реагента, так и для галогенида. [15] Однако конфигурация этой двойной связи, цис или транс, определяется цис - транс -изомеризацией палладиевого комплекса на стадии окислительного присоединения, где транс-палладиевый комплекс является преобладающей формой. Когда борорганическое соединение присоединяется к двойной связи и соединяется с алкенилгалогенидом, продукт представляет собой диен, как показано ниже.

Трансметаллация
[ редактировать ]Трансметаллирование — это металлоорганическая реакция, при которой лиганды передаются от одного вида к другому. В случае реакции Сузуки лиганды переносятся от борорганического соединения D к комплексу палладия(II) C , где основание, добавленное на предыдущей стадии, заменяется заместителем R 2 на борорганическом элементе с образованием нового палладия. (II) Е. комплекс Точный механизм трансметаллирования муфты Сузуки еще предстоит выяснить. Борорганические соединения не подвергаются трансметаллированию в отсутствие основания, поэтому широко распространено мнение, что роль основания заключается в активации борорганического соединения, а также в облегчении образования R. 1 -Пд я буду -ТОТ т Bu-промежуточное соединение ( C ) продукта окислительного присоединения R 1 -Пд я буду -Х( Б ). [12]

Редукционное устранение
[ редактировать ]Последней стадией является стадия восстановительного элиминирования, на которой комплекс палладия(II) ( Е ) удаляет продукт ( 3 ) и регенерирует палладий(0) катализатор ( А ). Используя мечение дейтерием , Ridgway et al. показали, что восстановительное элиминирование протекает с сохранением стереохимии. [16]

Лиганд играет важную роль в реакции Сузуки. Обычно в реакции Сузуки используется фосфиновый лиганд. Фосфиновый лиганд увеличивает электронную плотность в металлическом центре комплекса и, следовательно, помогает на стадии окислительного присоединения. Кроме того, объем замещения фосфинового лиганда помогает на стадии восстановительного элиминирования. Однако недавно в этом перекрестном сочетании стали использовать N -гетероциклические карбеновые лиганды из-за нестабильности фосфинового лиганда в условиях реакции Сузуки. [17] N -Гетероциклические карбены более богаты электронами и объемисты, чем фосфиновый лиганд. Таким образом, как стерический, так и электронный факторы N -гетероциклического карбенового лиганда способствуют стабилизации активного катализатора Pd(0). [18]
Преимущества
[ редактировать ]Преимущества реакции Сузуки перед другими подобными реакциями включают доступность обычных бороновых кислот, мягкие условия реакции и ее менее токсичную природу. Бороновые кислоты менее токсичны и более безопасны для окружающей среды, чем оловоорганические и цинкорганические соединения . Неорганические побочные продукты легко удалить из реакционной смеси. Кроме того, эта реакция предпочтительна, поскольку в ней используются относительно дешевые и легко приготавливаемые реагенты. Возможность использовать воду в качестве растворителя. [19] делает эту реакцию более экономичной, экологически чистой и практичной для использования с различными водорастворимыми реагентами. Для реакции Сузуки можно использовать самые разнообразные реагенты, например арил- или винилбороновые кислоты и арил- или винилгалогениды . Работа также расширила рамки реакции, включив в нее алкилбромиды. [20] В дополнение к тому, что в реакции сочетания Сузуки возможно использование галогенидов различных типов, реакция также работает с псевдогалогенидами , такими как трифлаты (OTf), в качестве заменителей галогенидов . Относительная реакционная способность партнера сочетания с галогенидом или псевдогалогенидом равна: R 2 –I > R 2 –OTf > R 2 –Br >> R 2 –Cl. сложные эфиры бороновой кислоты и трифторборатные соли Вместо бороновой кислоты можно использовать . Катализатор также может представлять собой катализатор на основе палладиевого наноматериала . [21] при использовании нового органофосфинового лиганда ( SPhos ) загрузка катализатора снижается до 0,001 мол.%. Сообщалось, что [22] Эти достижения и общая гибкость процесса сделали муфту Сузуки широко используемой для химического синтеза.
Приложения
[ редактировать ]Промышленное применение
[ редактировать ]Реакция сочетания Сузуки масштабируема и экономически эффективна для использования в синтезе промежуточных продуктов фармацевтических препаратов или продуктов тонкой химии . [23] Реакция Сузуки когда-то была ограничена высоким содержанием катализатора и ограниченной доступностью бороновых кислот . Также были найдены замены галогенидам, что также увеличило количество партнеров взаимодействия галогенида или псевдогалогенида. Масштабные реакции были проведены при синтезе ряда важных биологических соединений, таких как CI-1034, в котором использовались партнеры сочетания трифлат и бороновая кислота , которые проводились в масштабе 80 килограммов с выходом 95%. [24]
Другим примером является сочетание 3-пиридилборана и 1-бром-3-(метилсульфонил)бензола, в результате которого образуется промежуточное соединение, которое использовалось в синтезе потенциального агента центральной нервной системы. Реакция сочетания с образованием промежуточного продукта дала 278 килограммов с выходом 92,5%. [15] [23]
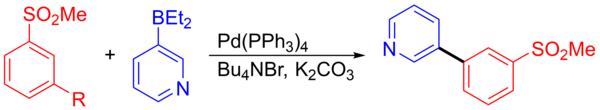
Значительные усилия были приложены к разработке гетерогенных катализаторов для реакции Suzuki CC, мотивированные повышением производительности промышленного процесса (устранение отделения катализатора от подложки), и недавно было показано, что одноатомный гетерогенный катализатор Pd превосходит по умолчанию однородный катализатор Pd(PPh 3 ) 4 . [25]
Синтетические приложения
[ редактировать ]Сочетание Сузуки часто используется при синтезе комплексных соединений. [26] [27] Соединение Сузуки использовалось на производном цитронеллаля для синтеза капарратриена , природного продукта, который очень активен против лейкемии: [28]

Вариации
[ редактировать ]Металлический катализатор
[ редактировать ]Были разработаны различные каталитические применения металлов, отличных от палладия (особенно никеля). [29] О первой реакции кросс-сочетания, катализируемой никелем, сообщили Персек и его коллеги в 1995 году с использованием арилмезилатов и бороновых кислот. [30] большее количество никелевого катализатора Несмотря на то, что для реакции потребовалось , около 5 мол.%, никель не такой дорогой и драгоценный металл, как палладий . Реакция сочетания Сузуки, катализируемая никелем, также позволила получить ряд соединений, которые не работали или работали хуже для системы, катализируемой палладием, чем для системы, катализируемой никелем. [29] Использование никелевых катализаторов позволило создать электрофилы, которые оказались сложными для оригинального сочетания Сузуки с использованием палладия, включая такие субстраты, как фенолы, ариловые эфиры, сложные эфиры, фосфаты и фториды. [29]

Исследования кросс-сочетания, катализируемого никелем, продолжились и расширили масштабы реакции после того, как были показаны эти первые примеры, и исследовательский интерес вырос. можно использовать более дешевый никелевый катализатор Мияура и Инада сообщили в 2000 году, что для кросс-сочетания , используя трифенилфосфин (PPh 3 ) вместо более дорогих лигандов, использовавшихся ранее. [31] Однако кросс-сочетание, катализируемое никелем, по-прежнему требовало высоких загрузок катализатора (3–10%), требовало избытка лиганда (1–5 эквивалентов) и оставалось чувствительным к воздуху и влаге. [29] Достижения Хана и его коллег попытались решить эту проблему путем разработки метода с использованием небольших количеств никелевого катализатора (<1 моль%) и без дополнительных эквивалентов лиганда. [32]

В 2011 году Ву и его коллеги также сообщили, что для кросс-сочетания арилхлоридов можно использовать высокоактивный никелевый катализатор, для которого требуется всего 0,01-0,1 мол.% никелевого катализатора. Они также показали, что катализатор можно перерабатывать до шести раз практически без потери каталитической активности. [33] Катализатор подлежал вторичной переработке, поскольку это был катализатор наночастиц фосфин-никеля (G 3 DenP-Ni), изготовленный из дендримеров .

Преимущества и недостатки применимы как к реакциям сочетания Сузуки, катализируемым палладием, так и никелем. Помимо каталитической системы Pd и Ni, используются дешевые и нетоксичные источники металлов, такие как железо и медь. [34] были использованы в реакции сочетания Сузуки. Исследовательская группа Бедфорда [35] и исследовательская группа Накамура [36] активно работали над разработкой методологии реакции сочетания Сузуки, катализируемой железом. Рутений - еще один источник металла, который использовался в реакции сочетания Сузуки. [37]
Амидная связь
[ редактировать ]Никелевый катализ позволяет образовывать связи CC из амидов. Несмотря на инертную природу амидов как синтонов, для получения CC-связей можно использовать следующую методологию. Процедура сочетания является мягкой и толерантной к множеству функциональных групп, включая: амины, кетоны, гетероциклы, группы с кислыми протонами. Этот метод также можно использовать для получения биоактивных молекул и контролируемого объединения гетероциклов посредством умелых последовательных перекрестных связей. Общий обзор схемы реакции приведен ниже. [38]

Синтез тубулин -связывающего соединения ( антипролиферативного агента) осуществляли с использованием триметоксибензамида и индолилпинакол - атоборон -связывающего партнера в граммовом масштабе. [38]

Органобораны
[ редактировать ]Арилбороновые кислоты широкий выбор арилбороновых кислот сравнительно дешевле, чем другие органобораны, и коммерчески доступен . Следовательно, он широко использовался в реакции Сузуки в качестве органоборанового партнера. Соли арилтрифторбората представляют собой еще один класс органоборанов, которые часто используются, поскольку они менее склонны к протодеборированию по сравнению с арилбороновыми кислотами . Их легко синтезировать и легко очистить. [39] Соли арилтрифторбората можно получить из бороновых кислот обработкой гидрофторидом калия , который затем можно использовать в реакции сочетания Сузуки. [40]

Варианты растворителя
[ редактировать ]Реакция сочетания Сузуки отличается от других реакций сочетания тем, что ее можно проводить в двухфазной среде органической воды. [41] только вода, [19] или отсутствие растворителя. [42] Это расширило возможности реакций сочетания, поскольку можно было использовать различные водорастворимые основания, каталитические системы и реагенты, не беспокоясь об их растворимости в органических растворителях. Использование воды в качестве системы растворителей также привлекательно из-за преимуществ с точки зрения экономики и безопасности. В системах растворителей для муфт Suzuki часто используются толуол , [43] ТХФ , [44] диоксан , [44] и ДМФ . [45] Наиболее часто используемые основания – K 2 CO 3 , [41] Кто ты Бу ? , [46] Cs2CO3 CO3, [47] К 3 ПО 4 , [48] НаОН , [49] и NET 3 . [50]
См. также
[ редактировать ]- Муфта Чан-Лам
- Черт возьми реакция
- Хияма муфта
- Ненавижу совокупление
- Муфта Негиши
- Реакция Петасиса
- Муфта Соногашира
- Реакция Стилле
- Список органических реакций
Ссылки
[ редактировать ]- ^ Мияура, Норио; Ямада, Кинджи; Сузуки, Акира (1979). «Новое стереоспецифическое кросс-сочетание катализируемой палладием реакции 1-алкенилборанов с 1-алкенил- или 1-алкинилгалогенидами» . Буквы тетраэдра . 20 (36): 3437–3440. дои : 10.1016/S0040-4039(01)95429-2 . hdl : 2115/44006 .
- ^ Мияура, Норио; Сузуки, Акира (1979). «Стереоселективный синтез арилированных (Е)-алкенов реакцией алк-1-енилборанов с арилгалогенидами в присутствии палладиевого катализатора». хим. Комм. (19): 866–867. дои : 10.1039/C39790000866 .
- ^ Мияура, Норио ; Сузуки, Акира (1995). «Катализируемые палладием реакции кросс-сочетания борорганических соединений». Химические обзоры . 95 (7): 2457–2483. CiteSeerX 10.1.1.735.7660 . дои : 10.1021/cr00039a007 . S2CID 53050782 .
- ^ Нобелевская премия.org. «Нобелевская премия по химии 2010» . Фонд Нобелевской премии . Проверено 25 октября 2013 г.
- ^ Сузуки, Акира (1991). «Синтетические исследования посредством реакции кросс-сочетания борорганических производных с органическими галогенидами» . Чистое приложение. Хим . 63 (3): 419–422. дои : 10.1351/pac199163030419 .
- ^ Мияура, Норио; Сузуки, Акира (1979). «Реакции кросс-сочетания борорганических соединений, катализируемые палладием» . Химические обзоры . 95 (7): 2457–2483. CiteSeerX 10.1.1.735.7660 . дои : 10.1021/cr00039a007 . S2CID 53050782 . (Обзор)
- ^ Сузуки, Акира (1999). «Последние достижения в реакциях кросс-сочетания борорганических производных с органическими электрофилами, 1995–1998 годы» . Журнал металлоорганической химии . 576 (1–2): 147–168. дои : 10.1016/S0022-328X(98)01055-9 .
- ^ Матос, К.; Содерквист, Дж. А. (1998). «Алкилбораны в соединении Сузуки-Мияура: стереохимические и механистические исследования». Дж. Орг. хим. 63 (3): 461–470. дои : 10.1021/jo971681s . ПМИД 11672034 .
- ^ Перейти обратно: а б Аматоре, Кристиан; Ютанд, Анни; Ле Дюк, Гаэтан (18 февраля 2011 г.). «Кинетические данные по трансметаллированию/восстановительному элиминированию в реакциях Сузуки-Мияуры, катализируемых палладием: неожиданная тройная роль ионов гидроксида, используемых в качестве основания». Химия: Европейский журнал . 17 (8): 2492–2503. дои : 10.1002/chem.201001911 . ПМИД 21319240 .
- ^ Смит, Джордж Б.; Дезени, Джордж К.; Хьюз, Дэвид Л.; Кинг, Энтони О.; Верховен, Томас Р. (1 декабря 1994 г.). «Механистические исследования реакции кросс-сочетания Сузуки». Журнал органической химии . 59 (26): 8151–8156. дои : 10.1021/jo00105a036 .
- ^ Матос, Карл; Содерквист, Джон А. (1 февраля 1998 г.). «Алкилбораны в соединении Сузуки-Мияура: стереохимические и механистические исследования». Журнал органической химии . 63 (3): 461–470. дои : 10.1021/jo971681s . ПМИД 11672034 .
- ^ Перейти обратно: а б Курти, Ласло (2005). Стратегическое применение названных реакций в органическом синтезе . Эльзевир Академик Пресс. ISBN 978-0124297852 .
- ^ Стилле, Джон К.; Лау, Крейслер С.Ю. (1977). «Механизмы окислительного присоединения органических галогенидов к комплексам переходных металлов 8-й группы». Отчеты о химических исследованиях . 10 (12): 434–442. дои : 10.1021/ar50120a002 .
- ^ Касадо, Артуро Л.; Эспине, Пабло (1998). «О конфигурации, возникающей в результате окислительного присоединения RX к Pd(PPh3)4, и механизме цис-транс-изомеризации комплексов \PdRX(PPh3)2] (R = арил, X = галогенид)†». Металлоорганические соединения . 17 (5): 954–959. дои : 10.1021/om9709502 .
- ^ Перейти обратно: а б Продвинутая органическая химия . Спрингер. 2007. С. 739–747 .
- ^ Риджуэй, Брайан Х.; Верпель, К.А. (1998). «Трансметаллирование алкилборанов в палладий в реакции сочетания Сузуки протекает с сохранением стереохимии». Журнал органической химии . 63 (3): 458–460. дои : 10.1021/jo970803d . ПМИД 11672033 .
- ^ «Наука о синтезе: Лучшие методы. Лучшие результаты – Thieme Chemistry» . science-of-synthesis.thieme.com . Проверено 14 апреля 2021 г.
- ^ Хопкинсон, Мэтью Н.; Рихтер, Кристиан; Шедлер, Майкл; Глориус, Фрэнк (июнь 2014 г.). «Обзор N-гетероциклических карбенов» . Природа . 510 (7506): 485–496. Бибкод : 2014Natur.510..485H . дои : 10.1038/nature13384 . ISSN 1476-4687 . ПМИД 24965649 . S2CID 672379 .
- ^ Перейти обратно: а б Казальнуово, Альберт Л.; Калабрезе (1990). «Алкилирование, катализируемое палладием, в водных средах». Дж. Ам. хим. Соц . 112 (11): 4324–4330. дои : 10.1021/ja00167a032 .
- ^ Кирхгоф, Ян Х.; Нетертон, Мэтью Р.; Хиллз, Айвори Д.; Фу, Грегори К. (2002). «Боровые кислоты: новые партнеры сочетания в реакциях Сузуки алкилбромидов при комнатной температуре. Кристаллографическая характеристика аддукта окислительного присоединения, полученного в исключительно мягких условиях». Журнал Американского химического общества . 124 (46): 13662–3. дои : 10.1021/ja0283899 . ПМИД 12431081 .
- ^ Отака, Ацуши (2013). «Пригодные для вторичной переработки нанометаллические катализаторы на полимерной основе в воде». Химическая запись . 13 (3): 274–285. дои : 10.1002/tcr.201300001 . ПМИД 23568378 .
- ^ Мартин, Р.; Бухвальд, СЛ (2008). «Катализируемые палладием реакции кросс-сочетания Сузуки-Мияуры с использованием диалкилбиарилфосфиновых лигандов» . Отчеты о химических исследованиях . 41 (11): 1461–1473. дои : 10.1021/ar800036s . ПМЦ 2645945 . ПМИД 18620434 .
- ^ Перейти обратно: а б Руи, А. Морин (6 сентября 2004 г.). «Тонкая химия». С&ЕН .
- ^ Джекс1, Томас Э.; Бельмонт, Дэниел Т.; Бриггс, Кристофер А.; Хорн, Николь М.; Кантер, Джеральд Д.; Каррик, Грег Л.; Крикке, Джеймс Дж.; Маккейб, Ричард Дж.; Мустакис; Наннинга, Томас Н. (1 марта 2004 г.). «Разработка масштабируемого процесса для CI-1034, антагониста эндотелина». Исследования и разработки органических процессов . 8 (2): 201–212. дои : 10.1021/op034104g .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Чен, Цзупенг; Воробьева Евгения; Митчелл, Шэрон; Фако, Эдвин; Ортуньо, Мануэль А.; Лопес, Нурия ; Коллинз, Шон М.; Мидгли, Пол А.; Ричард, Сильвия; Мерзкий, Джанвито; Перес-Рамирес, Хавьер (2018). «Гетерогенный одноатомный палладиевый катализатор, превосходящий гомогенные системы для сцепления Сузуки» (PDF) . Природные нанотехнологии . 13 (8): 702–707. Бибкод : 2018NatNa..13..702C . дои : 10.1038/ s41565-018-0167-2 hdl : 2072/359786 . ПМИД 29941887 . S2CID 49415437 .
- ^ Балог, Аарон; Мэн, Дунфан; Каменецка, Тед; Бертинато, Питер; Су, Дай-Ши; Соренсен, Эрик Дж.; Данишефски, Сэмюэл Дж. (1996). «Тотальный синтез (–)-эпотилона А». Angewandte Chemie International Edition на английском языке . 35 (2324): 2801–2803. дои : 10.1002/anie.199628011 .
- ^ Лю, Цзюньцзя; Лотеста, Стивен Д.; Соренсен, Эрик Дж. (2011). «Краткий синтез молекулярной структуры плевромутилина» . Химические коммуникации . 47 (5): 1500–2. дои : 10.1039/C0CC04077K . ПМК 3156455 . ПМИД 21079876 .
- ^ Вивиан, младший; Петерсон, Эмили А.; Стефан, Мари Л. (1999). «Целесообразное полное синтезирование (+/-)-капарратриена». Буквы тетраэдра . 40 (27): 4947–4949. дои : 10.1016/S0040-4039(99)00865-5 .
- ^ Перейти обратно: а б с д Хан, Фу-Ше (1 января 2013 г.). «Реакции кросс-сочетания Сузуки-Мияуры, катализируемые переходными металлами: замечательный прогресс от палладиевых катализаторов к никелевым». Обзоры химического общества . 42 (12): 5270–98. дои : 10.1039/c3cs35521g . ПМИД 23460083 .
- ^ Персек, Вирджил; Бэ, Джин Ён; Хилл, Дейл (1995). «Арилмезилаты в реакциях гомосочетания и кросс-сочетания, катализируемых металлами. 2. Никель-катализируемое перекрестное сочетание арилареленсульфонатов и арилмезилатов типа Сузуки с арилбороновыми кислотами». Журнал органической химии . 60 (4): 1060–1065. дои : 10.1021/jo00109a044 .
- ^ Инада, Каору; Норио Мияура (2000). «Синтез биарилов посредством реакции кросс-сочетания арилбороновых кислот с арилхлоридами, катализируемой комплексами NiCl2/трифенилфосфин». Тетраэдр . 56 (44): 8657–8660. дои : 10.1016/S0040-4020(00)00814-0 .
- ^ Чжао, Ю-Лонг; Ли, Ты; Ли, Шуй-Мин; Чжоу, И-Го; Сунь, Фэн-И; Гао, Лянь-Сюнь; Хан, Фу-Ше (1 июня 2011 г.). «Очень практичный и надежный никелевый катализатор для соединения Сузуки-Мияуры арилгалогенидов». Расширенный синтез и катализ . 353 (9): 1543–1550. дои : 10.1002/adsc.201100101 .
- ^ Ву, Лей; Лин, Цзе; Ву, Цзун-Цюань (1 июня 2011 г.). «Высокоактивный и пригодный для вторичной переработки катализатор: стабилизированные фосфиновым дендримером наночастицы никеля для реакции сочетания Сузуки». Расширенный синтез и катализ . 353 (9): 1452–1456. дои : 10.1002/adsc.201100134 .
- ^ Ян, Коннектикут; Чжан, Чжэнь-Ци; Лю, Ю-Чен; Лю, Лей (2011). «Реакция перекрестного сочетания борорганических соединений, катализируемая медью, с первичными алкилгалогенидами и псевдогалогенидами». Энджью. хим. Межд. Эд . 50 (17): 3904–3907. дои : 10.1002/anie.201008007 . ПМИД 21455914 .
- ^ Бредфорд, РБ; Холл, Марк А.; Ходжес, Джордж Р.; Хьюве, Майкл; Уилкинсон, Марк К. (2009). «Простые смешанные Fe-Zn катализаторы для реакции Сузуки тетраарилборатов с бензилгалогенидами и 2-галогенпиридинами». хим. Коммун. (42): 6430–6432. дои : 10.1039/B915945B . ПМИД 19841799 . S2CID 40428708 .
- ^ Накамура, М; Хашимото, Тору; Катриараччи, Калум КАДС; Дзэнмё, Такеши; Шейк, Хирофуми; Накамура, Масахару (2012). «Алкил-алкильная муфта Сузуки-Мияура, катализируемая железом». Солнце. хим. Межд. Эд . 51 (35): 8834–883. дои : 10.1002/anie.201202797 . ПМИД 22848024 .
- ^ На, Й; Пак, Соён; Хан, Су Бонг; Хан, Хун; Ко, Санвон; Чанг, Сукбок (2004). «Олефинирование типа Хека, катализируемое рутением, и реакции сочетания Сузуки: исследования природы каталитических частиц». Дж. Ам. хим. Соц . 126 (1): 250–258. дои : 10.1021/ja038742q . ПМИД 14709090 .
- ^ Перейти обратно: а б Вейрес, Николас А.; Бейкер, Эмма Л.; Гарг, Нил К. (2015). «Сочетание амидов Сузуки-Мияуры, катализируемое никелем». Природная химия . 8 (1): 75–79. Бибкод : 2016NatCh...8...75W . дои : 10.1038/nchem.2388 . ПМИД 26673267 .
- ^ Моландер, Гэри А.; Биолатто, Бетина (2003). «Катализируемые палладием реакции кросс-сочетания Сузуки-Мияуры арил- и гетероарилтрифторборатов калия». Дж. Орг. Хим . 68 (11): 4302–4314. дои : 10.1021/jo0342368 . ПМИД 12762730 .
- ^ Бейтс, Родерик (2012). Органический синтез с использованием переходных металлов . Уайли. ISBN 978-1119978930 .
- ^ Перейти обратно: а б Долливер, Дебра; Бхаттараи, Биджай Т.; Панди, Арджун; Ланье, Меган Л.; Борделон, Эмбер С.; Адхикари, Сарджу; Динсер, Джордан А.; Флауэрс, Патрик Ф.; Уиллс, Вероника С.; Шнайдер, Кэролайн Л.; Шонесси, Кевин Х.; Мур, Джейн Н.; Рейдерс, Стивен М.; Сноуден, Тимоти С.; МакКим, Арти С.; Фрончек, Фрэнк Р. (2013). «Стереоспецифические реакции Сузуки, Соногаширы и Негиши сочетания N-алкоксиимидоил йодидов и бромидов». Дж. Орг. Химия 78 (8): 3676–3687. дои : 10.1021/jo400179u . ПМИД 23534335 .
- ^ Asachenko, Andrey; Sorochkina, Kristina; Dzhevakov, Pavel; Topchiy, Maxim; Nechaev, Mikhail (2013). "Suzuki–Miyaura Cross-Coupling under Solvent-Free Conditions". Adv. Synth. Catal . 355 (18): 3553–3557. doi : 10.1002/adsc.201300741 .
- ^ Пан, Чандуо; Лю, Чжан; Ву, Хуаюе; Дин, Цзиньчан; Ченг, Цзян (2008). «Реакция кросс-сочетания Сузуки без лигандов, катализируемая палладием». Катализные коммуникации . 9 (4): 321–323. дои : 10.1016/j.catcom.2007.06.022 .
- ^ Перейти обратно: а б Литтке, Адам Ф.; Фу (2000). «Универсальные катализаторы кросс-сочетания Сузуки арилбороновых кислот с арил- и винилгалогенидами и трифлатами в мягких условиях». Дж. Ам. хим. Соц . 122 (17): 4020–4028. дои : 10.1021/ja0002058 .
- ^ Ху, Мин-Ганг; Вэй, Сун; Цзянь, Ай-Ай (2007). «Высокоэффективная Pd/C-катализируемая реакция сочетания Сузуки п-(не)замещенного фенилгалогенида с (п-замещенным фенил)бороновой кислотой». Китайский химический журнал . 25 (8): 1183–1186. дои : 10.1002/cjoc.200790220 .
- ^ Сайто, Б; Фу (2007). «Алкил-алкилкросс-сочетания Сузуки неактивированных вторичных алкилгалогенидов при комнатной температуре» . Дж. Ам. хим. Соц . 129 (31): 9602–9603. дои : 10.1021/ja074008l . ПМК 2569998 . ПМИД 17628067 .
- ^ Кингстон, СП; Веркаде, Джон Г. (2007). «Синтез и характеристика R2PNP (iBuNCH2CH2)3N: новый объемистый богатый электронами фосфин для эффективных реакций кросс-сочетания Сузуки-Мияура с помощью палладия». Дж. Орг. Хим . 72 (8): 2816–2822. дои : 10.1021/jo062452l . ПМИД 17378611 .
- ^ Бэйли, К; Чжан, Лисинь; Сяо, Цзяньлян (2004). «Ферроценилмонофосфиновые лиганды: синтез и применение в реакции Сузуки-Мияура арилхлоридов». Дж. Орг. Хим . 69 (22): 7779–7782. дои : 10.1021/jo048963u . ПМИД 15498017 .
- ^ Хан, Дж; Лю, Ю; Го, Р. (2009). «Простой синтез высокостабильных наночастиц золота и их неожиданно превосходная каталитическая активность в реакции кросс-сочетания Сузуки-Мияуры в воде». Дж. Ам. хим. Соц . 131 (6): 2060–2061. дои : 10.1021/ja808935n . ПМИД 19170490 .
- ^ Липшуц, Б.Х.; Петерсен, вторник Б.; Абела, Александр Р. (2008). «Муфты Сузуки-Мияура при комнатной температуре в воде, усиленной неионогенными амфифилами †». Орг. Летт . 10 (7): 1333–1336. дои : 10.1021/ol702714y . ПМИД 18335944 .