Палладийорганическая химия
Палладийорганическая химия — раздел металлоорганической химии , изучающий органические соединения палладия и их реакции. часто используется в качестве катализатора при восстановлении алкенов и алкинов водородом Палладий . Этот процесс включает в себя образование ковалентной связи палладий-углерод . Палладий также играет важную роль в реакциях сочетания углерод-углерод , что продемонстрировано в тандемных реакциях . [1]
Хронология палладийорганической химии
[ редактировать ]- 1873 г. - А. Н. Зайцев сообщает о восстановлении бензофенона над палладием водородом.
- 1894 г. — Филлипс сообщает, что хлорид палладия(II) восстанавливается до металлического палладия при контакте с этиленом . [2]
- 1907 г. — автоклавная внедренная Владимиром Ипатьевым технология позволяет проводить гидрирование под высоким давлением.
- 1956 г. - В процессе Вакера этилен и кислород реагируют с образованием ацетальдегида с катализатором PdCl 2 /CuCl 2.
- 1957 г. - Малатеста и Анголетта сообщили о тетракис(трифенилфосфин)палладии(0).
- 1972 — Реакция Хека — реакция сочетания галогенида с олефином. В этом участвуют интермедиаты Pd(0).
- 1973 — Асимметричное аллильное алкилирование Троста — нуклеофильное замещение .
- 1975 — Сочетание Соногаширы — реакция сочетания концевых алкинов с арил- или винилгалогенидами.
- 1994 - Катализируемое Pd аминирование Бухвальда-Хартвига для реакций образования связи CN.

Палладий(II)
[ редактировать ]Алкеновые комплексы
[ редактировать ]В отличие от Ni(II), но подобно Pt(II), галогениды Pd(II) образуют разнообразные алкеновые комплексы. Ярким примером является дихлор(1,5-циклооктадиен)палладий . В этом комплексе диен легко замещается, что делает его предпочтительным предшественником катализаторов. В промышленно важном процессе Вакера этилен превращается в ацетальдегид путем нуклеофильной атаки гидроксида на промежуточное соединение Pd (II)-этилен с последующим образованием комплекса винилового спирта. Фуллереновые лиганды также связываются с палладием(II).

Ацетат палладия (II) и родственные соединения являются распространенными реагентами, поскольку карбоксилаты представляют собой хорошие уходящие группы с основными свойствами. Например, было продемонстрировано, что трифторацетат палладия эффективен при декарбоксилировании ароматических соединений : [3]
Аллильные комплексы
[ редактировать ]Знаковым комплексом в этой серии является димер хлорида аллилпалладия (APC). Аллильные соединения с подходящими уходящими группами реагируют с солями палладия (II) с образованием пи-аллильных комплексов, имеющих гаптичность 3. Эти промежуточные соединения также реагируют с нуклеофилами, например, с карбанионами, полученными из малонатных эфиров. [4] или с аминами при аллильном аминировании [5] как показано ниже [6]
Промежуточные соединения аллилпалладия также участвуют в асимметричном аллильном алкилировании Троста и перегруппировке Кэрролла , а также в оксо-варианте окисления Саэгуза .
Сигма-связанные комплексы палладий-углерод
[ редактировать ]Различные органические группы могут связываться с палладием и образовывать устойчивые сигма-связанные комплексы. Устойчивость связей по энергии диссоциации имеет тенденцию: Pd-Алкинил > Pd-Винил ≈ Pd-Арил > Pd-Алкил, а длина связи металл-углерод изменяется в противоположном направлении: Pd-Алкинил < Pd-Винил. ≈ Pd-Арил < Pd-Алкил. [7]
Соединения палладия(0)
[ редактировать ]Нулевовалентные соединения Pd(0) включают трис(дибензилиденацетон)дипалладий(0) и тетракис(трифенилфосфин)палладий(0) . Эти комплексы реагируют с галогенуглеродом RX путем окислительного присоединения к интермедиатам R-Pd-X с ковалентными связями Pd-C. Эта химия составляет основу большого класса органических реакций, называемых реакциями сочетания (см. Реакции сочетания, катализируемые палладием ). Примером может служить реакция Соногаширы :
Органопалладий(IV)
[ редактировать ]Первое палладий(IV)органическое соединение было описано в 1986 году. Этот комплекс представляет собой Me 3 Pd(IV)(I)bpy (bpy = бидентатный 2,2'-бипиридиновый лиганд). [8] Синтезирован методом окислительного присоединения йодистого метила к Me 2 Pd(II)bpy.
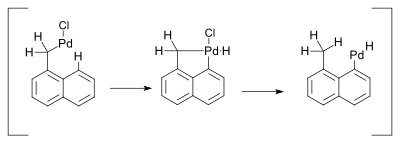
Соединения палладия обязаны своей реакционной способностью легкости взаимного превращения между промежуточными соединениями Pd (0) и палладия (II). Однако нет убедительных доказательств участия превращений Pd(II) в Pd(IV) в металлоорганических реакциях, опосредованных палладием. [9] Одна реакция, использующая такой механизм, была описана в 2000 году и касалась реакции Хека . Эта реакция сопровождалась 1,5-водородным сдвигом в присутствии аминов: [10]
Предполагалось, что гидридный сдвиг происходит через металлоцикл Pd(IV) :
В родственной работе промежуточным продуктом, связанным с гидридным сдвигом, остается Pd(II): [11]
а в другой работе (новый синтез индолов с двумя миграциями Pd) равновесия между различными палладациклами: постулируются [12] [13]
а в некоторых внутримолекулярных соединениях синтетическая ценность была продемонстрирована независимо от степени окисления: [14]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Справочник по палладийорганической химии для органического синтеза Эй-Негиши Джон Вили (2002) ISBN 0-471-31506-0
- ^ Филлипс, ФК; Являюсь. хим. Дж. 1894, 16, 255.
- ^ Джошуа С. Дикштейн; Кэрол А. Малруни; Эрин М. О'Брайен; Барбара Дж. Морган и Мариса Козловски (2007). «Развитие каталитической реакции ароматического декарбоксилирования». Орг. Летт. 9 (13): 2441–2444. дои : 10.1021/ol070749f . ПМИД 17542594 .
- ^ Джейн. Бэквалл и Ян О. Вогберг (1993). «Стереоселективные 1,4-функционализации сопряженных диенов: цис- и транс-1-ацетокси-4-(дикарбометоксиметил)-2-циклогексен» . Органические синтезы ; Сборник томов , т. 8, с. 5 .
- ^ Игорь Дубовик; Иэн Д. Г. Уотсон и Андрей К. Юдин (2007). «В поисках протонного виновника аллильного аминирования, катализируемого палладием». Дж. Ам. хим. Соц. 129 (46): 14172–14173. дои : 10.1021/ja076659n . ПМИД 17960935 .
- ^ Реагенты: триэтилфосфитный лиганд, DBU (сообщается, что он поглощает протоны амина, которые в противном случае вызвали бы изомеризацию) в ТГФ.
- ^ V. P. Ananikov et al., Organometallics, 2005, 24, 715 два : 10.1021/om0490841
- ^ Питер К. Байерс; Аллан Дж. Кэнти; Брайан В. Скелтон; Аллан Х. Уайт (1986). «Окислительное присоединение лодомметана к [PdMe2(bpy)] и рентгеновская структура палладийорганического продукта fac-[PdMe3(bpy)l](bpy = 2,2-бипиридил)». хим. Коммун. (23): 1722–1724. дои : 10.1039/C39860001722 .
- ^ Антонио Дж. Мота и Ален Дедье (2007). «Пространственная внутримолекулярная перегруппировка палладия в замещенных арильных комплексах: теоретическое исследование процесса миграции арила в алкилпалладий». Дж. Орг. хим. 72 (25): 9669–9678. дои : 10.1021/jo701701s . ПМИД 18001098 .
- ^ Ляньшэн Ван; И Пан; Синь Цзян; Хунвэнь Ху (2000). «Катализируемая палладием реакция α-хлорметилнафталина с олефинами». Буквы тетраэдра . 41 (5): 725–727. дои : 10.1016/S0040-4039(99)02154-1 .
- ^ Активация CH и миграция палладия внутри биарилов в условиях реакции Хека. Гюнтер Кариг, Мария-Тереза Мун, Ноппорн Тасана и организация Тимоти Галлахера. Летт., Том. 4, № 18, 2002 г. 3116 дои : 10.1021/ol026426v
- ^ Синтез замещенных карбазолов путем миграции винила в арилпалладий с участием процессов активации Domino CH Цзянь Чжао и Ричард К. Ларок Org. Летт. , Том. 7, № 4, 701 2005 г. два : 10.1021/ol0474655
- ^ Реагенты: дифенилацетилен , ацетат палладия , бис(дифенилфосфино)метан (dppm) и цезиевая соль пивалиновой кислоты (CsPiv).
- ^ Миграция и циклизация алкила, катализируемого Pd, в арил: эффективный синтез конденсированных полициклов посредством множественной активации CH Циньхуа Хуанг, Алессия Фацио, Гуансю Дай, Марино А. Кампо и Ричард К. Ларок Дж. Ам. хим. Соц. 2004 , 126, 7460-7461 два : 10.1021/ja047980y