Аминирование Бухвальда-Хартвига
| Аминирование Бухвальда-Хартвига | |
|---|---|
| Назван в честь | Стивен Л. Бухвальд Джон Ф. Хартвиг |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Реакция Бухвальда-Хартвига |
| RSC Идентификатор онтологии | RXNO: 0000192 |
В органической химии аминирование Бухвальда -Хартвига представляет собой химическую реакцию синтеза связей углерод-азот катализируемых палладием реакций сочетания аминов посредством с арилгалогенидами . [1] Хотя о реакциях C–N, катализируемых Pd, сообщалось еще в 1983 году, следует упомянуть Стивена Л. Бухвальда и Джона Ф. Хартвига , чьи публикации в период с 1994 года по конец 2000-х годов установили масштабы трансформации. Синтетическая полезность реакции обусловлена прежде всего недостатками типичных методов ( нуклеофильного замещения , восстановительного аминирования и др.) синтеза ароматических соединений. C-N Связи , причем большинство методов страдают от ограниченного объема субстрата и толерантности к функциональным группам . [2] Развитие реакции Бухвальда-Хартвига позволило осуществить легкий синтез ариламинов, заменив в некоторой степени более жесткие методы ( реакция Гольдберга , нуклеофильное ароматическое замещение и др.), существенно расширив при этом репертуар возможных методов. C-N . Образование связей [ нужна ссылка ]
В ходе его разработки было разработано несколько «поколений» каталитических систем, причем каждая система обеспечивает больший простор с точки зрения партнеров сочетания и более мягких условий, позволяя связывать практически любой амин с широким спектром партнеров арильного сочетания. [ нужна ссылка ] Из-за повсеместного распространения арил-C-N-связей в фармацевтических препаратах и натуральных продуктах эта реакция получила широкое использование в синтетической органической химии, с применением во многих полных синтезах и промышленном приготовлении многочисленных фармацевтических препаратов.
История
[ редактировать ]Первый пример катализируемой палладием реакции кросс-сочетания C–N был опубликован в 1983 году Мигитой и его сотрудниками и описал реакцию между несколькими арилбромидами и N,N-диэтиламинотрибутиловым оловом с использованием 1 мол% PdCl 2 [P(o- толил) 3 ] 2 . Хотя было протестировано несколько арилбромидов, только электронно нейтральные , стерически необремененные субстраты дали хорошие выходы. [3]
 | ( Уравнение 2 ) |
В 1984 году Дейл Л. Богер и Джеймс С. Панек сообщили о примере Pd(0)-опосредованного образования связи C–N в контексте их работы по синтезу лавендамицина, в котором использовался стехиометрический Pd(PPh 3 ) 4 . Попытки сделать реакцию каталитической не увенчались успехом. [4]
 | ( Уравнение 3 ) |
Эти отчеты практически не цитировались в течение десятилетия. В феврале 1994 года Хартвиг сообщил о систематическом исследовании соединений палладия, включенных в оригинальную статью Мигиты, и пришел к выводу, что d 10 комплекс Pd[P(o-Tolyl) 3 ] 2 Активным катализатором являлся . Был предложен каталитический цикл, включающий окислительное присоединение арилбромида. [5]
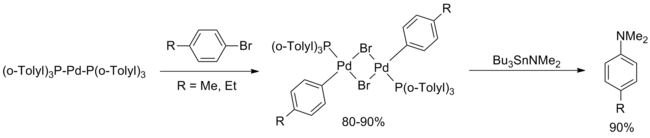 | ( Уравнение 4 ) |
В мае 1994 года Бухвальд опубликовал расширение статьи Мигиты, предлагающее два основных улучшения по сравнению с исходной статьей. Во-первых, переаминирование Bu 3 SnNEt 2 с последующей продувкой аргоном для удаления летучего диэтиламина позволило распространить методологию на различные вторичные амины (как циклические, так и ациклические) и первичные анилины . Во-вторых, выход богатых электронами и бедных электронами аренов был улучшен за счет незначительных модификаций процедуры реакции (более высокая загрузка катализатора, более высокая температура, более длительное время реакции), хотя в эту публикацию не были включены орто -замещенные арильные группы. [6]
 | ( Уравнение 5 ) |

В 1995 году последовательные исследования в каждой лаборатории показали, что связывание можно проводить со свободными аминами в присутствии объемистого основания ( NaOtBu в публикации Бухвальда, LiHMDS в публикации Хартвига), что позволяет осуществить связывание без оловоорганических соединений . Хотя эти улучшенные условия происходили более быстрыми темпами, объем субстратов был почти полностью ограничен вторичными аминами из-за конкурентного гидродегалогенирования бромаренов. [7] [8] (См. Механизм ниже)
 | ( Уравнение 6 ) |
Эти результаты установили так называемое «первое поколение» каталитических систем Бухвальда-Хартвига. В последующие годы были разработаны более сложные фосфиновые лиганды , которые позволили расширить спектр аминов и арильных групп. Арилиодиды . , хлориды и трифлаты в конечном итоге стали подходящими субстратами, и были разработаны реакции, протекающие с более слабыми основаниями при комнатной температуре Эти достижения подробно описаны в разделе «Область применения» ниже, а распространение на более сложные системы остается активной областью исследований.
Механизм
[ редактировать ]палладием . Было продемонстрировано, что механизм этой реакции протекает через стадии, аналогичные тем, которые известны для реакций сочетания CC, катализируемых Этапы включают окислительное присоединение арилгалогенида к частицам Pd(0), добавление амина к комплексу окислительного присоединения, депротонирование с последующим восстановительным элиминированием . Непродуктивная побочная реакция может конкурировать с восстановительным элиминированием, при котором амид подвергается отщеплению бета-гидрида с образованием гидродегалогенированного арена и иминного продукта. [9]
На протяжении всего развития реакции группа стремилась идентифицировать промежуточные продукты реакции посредством фундаментальных механистических исследований. Эти исследования выявили различные пути реакции в зависимости от того, используются ли в реакции монодентатные или хелатные фосфиновые лиганды, и был выявлен ряд нюансов влияния (особенно в отношении диалкилбиарилфосфиновых лигандов, разработанных Бухвальдом).
Каталитический цикл протекает следующим образом: [10] [11] [12] [13]
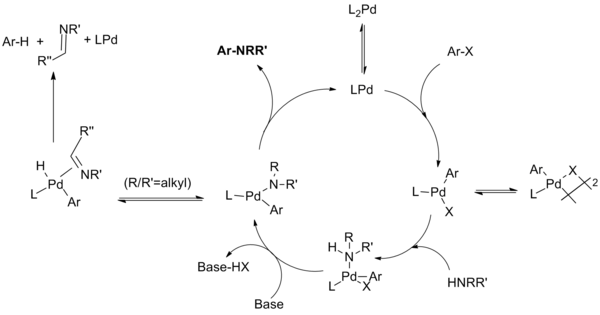 | ( Уравнение 7 ) |
Считается, что для монодентатных лигандных систем монофосфиновая разновидность палладия (0) образует разновидность палладия (II), которая находится в равновесии с димером μ-галогена. Стабильность этого димера снижается в порядке X = I > Br > Cl и считается ответственной за медленную реакцию арилйодидов с каталитической системой первого поколения. Лигирование амина с последующим депротонированием основанием дает амид палладия. (Было показано, что хелатные системы проходят эти две стадии в обратном порядке: образование комплексов оснований предшествует образованию амида.) Это ключевое промежуточное соединение восстанавливается путем восстановительного удаления с образованием продукта и регенерацией катализатора. Однако может произойти побочная реакция, при которой удаление β-гидрида с последующим восстановительным удалением приводит к образованию гидродегалогенированного арена и соответствующего имина. Не показаны дополнительные равновесия, при которых различные промежуточные соединения координируются с дополнительными фосфиновыми лигандами на различных стадиях каталитического цикла.
Для хелатирующих лигандов монофосфиновые формы палладия не образуются; Pd происходят окислительное присоединение, образование амидов и восстановительное отщепление Из комплексов L 2 . Группа Хартвига обнаружила, что «восстановительное элиминирование может происходить либо из четырехкоординационного бисфосфинового, либо из трехкоординационного монофосфинарилпалладиевого амидокомплекса. Элиминирование из трехкоординационных соединений происходит быстрее. Во-вторых, элиминирование β-водорода происходит из трехкоординационного промежуточного соединения. Следовательно, удаление β-водорода происходит медленно из комплексов арилпалладия, содержащих хелатирующие фосфины, в то время как восстановительное удаление все еще может происходить из этих четырехкоординатных видов». [14]
Приложение
[ редактировать ]Из-за повсеместного распространения арил-C-N-связей в фармацевтических препаратах и натуральных продуктах эта реакция получила широкое использование в синтетической органической химии, с применением во многих полных синтезах и промышленном приготовлении многочисленных фармацевтических препаратов. [22] Промышленное применение включает α-арилирование карбонильных соединений (таких как кетоны, сложные эфиры, амиды, альдегиды) и нитрилов. [23]
Объем
[ редактировать ]Хотя область применения аминирования Бухвальда-Хартвига была расширена и теперь включает широкий спектр партнеров по связыванию арила и амина, условия, необходимые для любых конкретных реагентов, по-прежнему во многом зависят от субстрата. Были разработаны различные лигандные системы, каждая из которых имеет разные возможности и ограничения, а выбор условий требует учета стерических и электронных свойств обоих партнеров. Ниже подробно описаны субстраты и условия для основных поколений лигандных систем. (Сюда не включены N-гетероциклические карбеновые лиганды и лиганды с широкими углами прикусывания, такие как Ксанфос и Спанфос, которые также значительно разработаны.) [9]
Каталитическая система первого поколения
[ редактировать ]Было обнаружено, что каталитическая система первого поколения (Pd[P(o-Tolyl) 3 ] 2 ) эффективна для связывания как циклических, так и ациклических вторичных аминов, несущих как алкильную, так и арильную функциональность (но не диариламинов), с различными арилбромидами. . В общем, в этих условиях не было возможности связать первичные амины из-за конкурентного гидродегалогенирования арена. [7] [8]
Арилиодиды оказались подходящими субстратами для внутримолекулярного варианта этой реакции. [8] и, что важно, можно было связать межмолекулярно только в том случае, если вместо толуола в качестве растворителя использовался диоксан, хотя и со скромными выходами. [24]
Бидентатные фосфиновые лиганды
[ редактировать ]Разработка дифенилфосфинобинаптила (BINAP) и дифенилфосфиноферроцена (DPPF) в качестве лигандов для аминирования Бухвальда-Хартвига обеспечила первое надежное расширение первичных аминов и позволило эффективно сочетать арилиодиды и трифлаты. (Считается, что бидентатные лиганды предотвращают образование димера йодида палладия после окислительного присоединения, ускоряя реакцию.) Эти лиганды обычно производят связанные продукты с более высокими скоростями и лучшими выходами, чем катализаторы первого поколения. Первоначальные сообщения об этих лигандах в качестве катализаторов были несколько неожиданными, учитывая механистические доказательства того, что монолигированные комплексы служат активными катализаторами в системе первого поколения. Фактически, первые примеры из обеих лабораторий были опубликованы в одном выпуске JACS . [25] [26] [27]
 | ( Уравнение 8 ) |
этих Считается, что хелатирование лигандов подавляет удаление β-гидрида, предотвращая образование открытого координационного сайта. Фактически было обнаружено, что α-хиральные амины не рацемизируются при использовании хелатирующих лигандов, в отличие от каталитической системы первого поколения. [28]
 | ( Уравнение 9 ) |
Стерически затрудненные лиганды
[ редактировать ]Было показано, что объемистые три- и диалкилфосфиновые лиганды являются чрезвычайно активными катализаторами, позволяющими связывать широкий спектр аминов (первичных, вторичных, электроноакцепторных, гетероциклических и т. д.) с арилхлоридами, бромидами, иодидами и трифлатами. . Кроме того, разработаны реакции с использованием гидроксидных , карбонатных и фосфатных оснований вместо традиционных алкоксидных и силиламидных оснований. Группа Бухвальда разработала широкий спектр диалкилбиарилфосфиновых лигандов , а группа Хартвига сосредоточилась на производных ферроцена и триалкилфосфиновых лигандах. [29] [30] [31] [32] [33] [34]
 | ( уравнение 10 ) |
Резкое увеличение активности, наблюдаемое для этих лигандов, объясняется их склонностью стерически благоприятствовать монолигированным формам палладия на всех стадиях каталитического цикла, резко увеличивая скорость окислительного присоединения, образования амидов и восстановительного элиминирования. Некоторые из этих лигандов, по-видимому, также повышают скорость восстановительного элиминирования по сравнению с элиминированием β-гидрида за счет электронодонорного взаимодействия арен-палладий. [19] [20]
Даже электроноакцепторные амины и гетероциклические субстраты могут быть связаны в этих условиях, несмотря на их тенденцию дезактивировать палладиевый катализатор. [35] [36]
 | ( Уравнение 11 ) |
Аммиачный эквивалент
[ редактировать ]Аммиак остается одним из наиболее сложных партнеров реакции аминирования Бухвальда-Хартвига, проблема, связанная с его прочным связыванием с комплексами палладия. Для преодоления этой проблемы было разработано несколько стратегий, основанных на реагентах, которые служат эквивалентами аммиака. Использование бензофенонимина или силиламида может преодолеть это ограничение с последующим гидролизом с получением первичного анилина . [37] [38] [39]
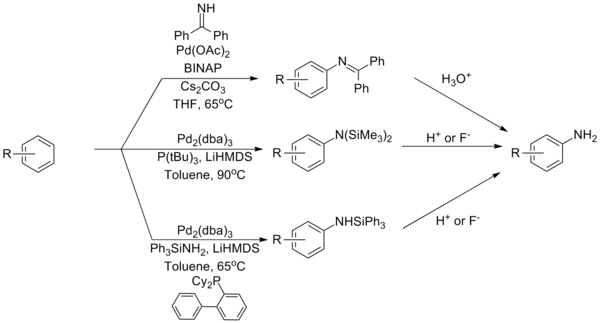 | ( Уравнение 12 ) |
Каталитическая система, которая может напрямую связывать аммиак с помощью лиганда типа Йозифоса. [40]
Вариации связей C–N: связи C–O, C–S и C–C.
[ редактировать ]В условиях, аналогичных условиям аминирования, спирты могут сочетаться с арилгалогенидами с образованием соответствующих ариловых эфиров . Это служит удобной заменой более жестких аналогов этого процесса, таких как конденсация Ульмана . [41] [42]
 | ( Уравнение 13 ) |
Тиолы и тиофенолы могут быть связаны с арилгалогенидами в условиях типа Бухвальда-Хартвига с получением соответствующих арилтиоэфиров. Кроме того, меркаптоэфиры использовались в качестве H 2 S-эквивалентов для получения тиофенола из соответствующего арилгалогенида. [43]
Еноляты и другие подобные углеродные нуклеофилы также могут соединяться с образованием α-арилкетонов, малонатов, нитрилов и т. д. Объем этого преобразования аналогичным образом зависит от лиганда, и был разработан ряд систем. [44] Было разработано несколько энантиоселективных методов этого процесса. [45] [46]
 | ( Уравнение 14 ) |
несколько вариантов реакции с использованием комплексов меди и никеля вместо палладия. Разработано также [18]
Ссылки
[ редактировать ]- ^ Фореро-Кортес, Паола А.; Хайдл, Александр М. (2 июля 2019 г.). «25-летие аминирования Бухвальда-Хартвига: развитие, применение и перспективы». Исследования и разработки органических процессов . 23 (8): 1478–1483. дои : 10.1021/acs.oprd.9b00161 . S2CID 198366762 .
- ^ Вейганд, Конрад (1972). Хильгетаг, Г.; Мартини, А. (ред.). Препаративная органическая химия Вейганда / Хильгетага (4-е изд.). Нью-Йорк: John Wiley & Sons, Inc. п. 461. ИСБН 0471937495 .
- ^ Косуги, М.; Камеяма, М.; Мигита, Т. (1983), «Катализируемое палладием ароматическое аминирование арилбромидов н, н-ди-этиламино-трибутилоловом», Chemistry Letters , 12 (6): 927–928, doi : 10.1246/cl.1983.927
- ^ Богер, Д.Л.; Панек, Дж. С. (1984), «Палладий (0)-опосредованный синтез бета-карболина: получение кольцевой системы CDE лавендамицина», Tetrahedron Letters , 25 (30): 3175–3178, doi : 10.1016/S0040-4039 (01)91001-9
- ^ Пол, Ф.; Патт, Дж.; Хартвиг, Дж. Ф. (1994), «Катализируемое палладием образование связей углерод-азот. Промежуточные продукты реакции и усовершенствования катализаторов в гетерокросс-сочетании арилгалогенидов и амидов олова», J. Am. хим. Соц. , 116 (13): 5969–5970, doi : 10.1021/ja00092a058
- ^ Гурам А.С.; Бухвальд, С.Л. (1994), "Катализируемые палладием ароматические аминирования с генерируемыми in situ аминостаннами", J. Am. хим. Соц. , 116 (17): 7901–7902, doi : 10.1021/ja00096a059
- ^ Jump up to: а б Луи, Дж.; Хартвиг, Дж. Ф. (1995), «Катализируемый палладием синтез ариламинов из арилгалогенидов. Механистические исследования приводят к связыванию в отсутствие оловянных реагентов», Tetrahedron Letters , 36 (21): 3609–3612, doi : 10.1016/0040-4039 (95)00605-С
- ^ Jump up to: а б с Гурам А.С.; Реннельс, РА; Бухвальд, С.Л. (1995), «Простой каталитический метод превращения арилбромидов в ариламины», Angewandte Chemie International Edition , 34 (12): 1348–1350, номер документа : 10.1002/anie.199513481.
- ^ Jump up to: а б с Муси, Арканзас; Бухвальд, С.Л. (2002), «Практические палладиевые катализаторы для образования связей C–N и C–O», Темы в Curr. хим. , Темы современной химии, 219 : 131–209, doi : 10.1007/3-540-45313-x_5 , ISBN 978-3-540-42175-7
- ^ Водитель, МС; Хартвиг, Дж. Ф. (1997), "Восстановительное удаление ариламинов из фосфиновых комплексов палладия (II), образующих углерод-азотные связи", J. Am. хим. Соц. , 119 (35): 8232–8245, doi : 10.1021/ja971057x
- ^ Хартвиг, Дж. Ф.; Ричардс, С.; Бараньано, Д.; Пол, Ф. (1996), «Влияние на относительные скорости восстановительного элиминирования амидов, образующих связи C-N, и элиминирования β-водорода из амидов. Тематическое исследование истоков конкурирующего восстановления при катализируемом палладием аминировании арилгалогенидов» , Дж. Ам. хим. Соц. , 118 (15): 3626–3633, doi : 10.1021/ja954121o
- ^ Водитель, МС; Хартвиг, Дж. Ф. (1995), «Редкий низковалентный алкиламидный комплекс, дифениламидный комплекс и их восстановительное удаление аминов трехкоординатными промежуточными соединениями», J. Am. хим. Соц. , 117 (16): 4708–4709, doi : 10.1021/ja00121a030
- ^ Виденхофер, РА; Бухвальд, С.Л. (1996), «Влияние галогенидов и аминов на равновесное образование трис(о-толил)фосфинмоно(аминных) комплексов палладия из димеров арилгалогенидов палладия», Organometallics , 15 (12): 2755–2763, doi : 10.1021/om9509608
- ^ Jump up to: а б Хартвиг, Дж. Ф. (1999), "Подходы к открытию катализаторов. Образование новых связей углерод-гетероатом и углерод-углерод", Pure Appl. хим. , 71 (8): 1416–1423, doi : 10.1351/pac199971081417 , S2CID 34700080
- ^ Хартвиг, Дж. Ф. (1997), «Катализируемое палладием аминирование арилгалогенидов: механизм и рациональный дизайн катализатора», Synlett , 1997 (4): 329–340, doi : 10.1055/s-1997-789 , S2CID 196704196
- ^ Хартвиг, Дж. Ф. (1998), "Восстановительное удаление аминов, простых эфиров и сульфидов с образованием связей между углеродом и гетероатомом", Acc. хим. Рез. , 31 : 852–860, doi : 10.1021/ar970282g
- ^ Вулф, JP; Вагау, С.; Марку, Ж.Ф.; Бухвальд, С.Л. (1998), "Рациональная разработка практических катализаторов для образования ароматических связей углерод-азот", Acc. хим. Рез. , 31 : 805–818, doi : 10.1021/ar9600650
- ^ Jump up to: а б Хартвиг, Дж. Ф. (1998), «Синтез ариламинов и ариловых эфиров из арилгалогенидов и трифлатов, катализируемый переходными металлами: область применения и механизм», Angew. хим. Межд. Эд. , 37 (15): 2046–2067, doi : 10.1002/(sici)1521-3773(19980817)37:15<2046::aid-anie2046>3.0.co;2-l , PMID 29711045
- ^ Jump up to: а б Хартвиг, Дж. Ф. (2008), «Эволюция катализатора четвертого поколения для аминирования и тиоэтерификации арилгалогенидов», Acc. хим. Рез. , 41 (11): 1534–1544, doi : 10.1021/ar800098p , PMC 2819174 , PMID 18681463
- ^ Jump up to: а б Сарри, Д.С.; Бухвальд, С.Л. (2008), «Биарилфосфановые лиганды в катализируемом палладием аминировании», Angew. хим. Межд. Эд. , 47 (34): 6338–6361, doi : 10.1002/anie.200800497 , PMC 3517088 , PMID 18663711
- ^ Сарри, Д.С.; Бухвальд, С.Л. (2011), «Диалкилбиарилфосфины в Pd-катализируемом аминировании: руководство пользователя», Chem. наук. , 2 (1): 27–50, doi : 10.1039/c0sc00331j , PMC 3306613 , PMID 22432049
- ^ [15] [16] [14] [9] [17] [18] [19] [20] [21]
- ^ Томас Дж. Колакот. Нобелевская премия по химии 2010 года: перекрестное соединение, катализируемое палладием. Архивировано 2 июня 2020 г. в Wayback Machine Platinum Metals Rev., 2011, 55, (2) doi: 10.1595/147106711X558301.
- ^ Вулф, JP; Бухвальд, С.Л. (1996), "Катализируемое палладием аминирование арилйодидов", J. Org. хим. , 61 (3): 1133–1135, дои : 10.1021/jo951844h
- ^ Водитель, МС; Хартвиг, Дж. Ф. (1996), «Катализатор второго поколения для аминирования арилгалогенидов: смешанные вторичные амины из арилгалогенидов и первичные амины, катализируемые (DPPF)PdCl2», J. Am. хим. Соц. , 118 (30): 7217–7218, doi : 10.1021/ja960937t
- ^ Вулф, JP; Вагау, С.; Бухвальд, С.Л. (1996), "Улучшенная каталитическая система для образования ароматических связей углерод-азот: возможное участие бис(фосфин)палладиевых комплексов в качестве ключевых промежуточных продуктов", J. Am. хим. Соц. , 118 : 7215–7216, doi : 10.1021/ja9608306
- ^ Луи, Дж.; Водитель, МС; Хаманн, Британская Колумбия; Хартвиг, Дж. Ф. (1997), "Катализируемое палладием аминирование арилтрифлатов и важность скорости добавления трифлата", J. Org. хим. , 62 (5): 1268–1273, дои : 10.1021/jo961930x
- ^ Вагау, С.; Реннельс, РА; Бухвальд, С.Л. (1997), "Катализируемое палладием сочетание оптически активных аминов с арилбромидами", J. Am. хим. Соц. , 119 (36): 8451–8458, doi : 10.1021/ja971583o
- ^ Старый, ДВ; Вулф, JP; Бухвальд, С.Л. (1998), "Высокоактивный катализатор для реакций кросс-сочетания, катализируемых палладием: соединения Сузуки при комнатной температуре и аминирование неактивированных арилхлоридов", J. Am. хим. Соц. , 120 (37): 9722–9723, doi : 10.1021/ja982250+
- ^ Вулф, JP; Бухвальд, С.Л. (1999), «Высокоактивный катализатор для аминирования при комнатной температуре и связывания арилхлоридов Сузуки», Angew. хим. Межд. Эд. , 38 (16): 2413–2416, doi : 10.1002/(sici)1521-3773(19990816)38:16<2413::aid-anie2413>3.0.co;2-h , PMID 10458806
- ^ Хаманн, Британская Колумбия; Хартвиг, Дж. Ф. (1998), «Стерически затрудненные хелатирующие алкилфосфины обеспечивают значительное ускорение скорости катализируемого палладием аминирования арилйодидов, бромидов и хлоридов и первого аминирования арилтозилатов», J. Am. хим. Соц. , 120 (29): 7369–7370, doi : 10.1021/ja981318i
- ^ Вулф, JP; Томори, Х.; Садиги, JP; Инь, Дж.; Бухвальд, С.Л. (2000), «Простая и эффективная каталитическая система для катализируемого палладием аминирования арилхлоридов, бромидов и трифлатов» (PDF) , J. Org. хим. , 65 (4): 1158–1174, doi : 10.1021/jo991699y , PMID 10814067
- ^ Стамбули, Япония; Кувано, Р.; Хартвиг, Дж. Ф. (2002), «Беспрецедентные скорости активации арилхлоридов и бромидов: взаимодействие с аминами и бороновыми кислотами за считанные минуты при комнатной температуре», Angew. хим. Межд. Эд. , 41 (24): 4746–4748, doi : 10.1002/anie.200290036 , PMID 12481346
- ^ Хуанг, X.; Андерсон, КВ; Зим, Д.; Цзян, Л.; Клапарс, А.; Бухвальд, С.Л. (2003), «Расширение процессов образования связей C–N, катализируемых палладием: первое амидирование арилсульфонатов, водное аминирование и комплементарность с реакциями, катализируемыми медью», J. Am. хим. Соц. , 125 (22): 6653–6655, doi : 10.1021/ja035483w , PMID 12769573
- ^ Андерсон, КВ; Тундел, RE; Икава, Т.; Альтман, РА; Бухвальд, С.Л. (2006), «Монодентатные фосфины обеспечивают высокоактивные катализаторы для Pd-катализируемых реакций образования связей C–N гетероароматических галогенидов/аминов и (H)N-гетероциклов», Angew. хим. Межд. Эд. , 45 (39): 6523–6527, doi : 10.1002/anie.200601612 , PMID 16955526
- ^ Икава, Т.; Бардер, Т.Э.; Биско, MR; Бухвальд, С.Л. (2007), «Pd-катализируемые амидирования арилхлоридов с использованием монодентатных биарилфосфиновых лигандов: кинетическое, вычислительное и синтетическое исследование», J. Am. хим. Соц. , 129 (43): 13001–13007, doi : 10.1021/ja0717414 , PMID 17918833
- ^ Вулф, JP; Ахман, Дж.; Садиги, JP; Сингер, РА; Бухвальд, С.Л. (1997), "Аммиачный эквивалент для катализируемого палладием аминирования арилгалогенидов и трифлатов", Tetrahedron Lett. , 38 (36): 6367–6370, doi : 10.1016/S0040-4039(97)01465-2
- ^ Ли, С.; Йоргенсен, М.; Хартвиг, Дж. Ф. (2001), «Катализируемый палладием синтез ариламинов из арилгалогенидов и бис(триметилсилил)амида лития в качестве аммиачного эквивалента», Org. Летт. , 3 (17): 2729–2732, doi : 10.1021/ol016333y , PMID 11506620
- ^ Хуанг, X.; Бухвальд, С.Л. (2001), «Новые эквиваленты аммиака для катализируемого Pd аминирования арилгалогенидов», Org. Летт. , 3 (21): 3417–3419, doi : 10.1021/ol0166808 , PMID 11594848
- ^ Во, ГД; Хартвиг, Дж. Ф. (2009), «Катализируемое палладием сочетание аммиака с арилхлоридами, бромидами, йодидами и сульфонатами: общий метод получения первичных ариламинов», J. Am. хим. Соц. , 131 (31): 11049–11061, doi : 10.1021/ja903049z , PMC 2823124 , PMID 19591470
- ^ Манн, Г.; Инкарвито, К.; Рейнгольд, Алабама; Хартвиг, Дж. Ф. (1999), «Катализируемое палладием соединение C–O с участием неактивированных арилгалогенидов. Стерически индуцированное восстановительное отщепление для образования связи CO в диариловых эфирах», J. Am. хим. Соц. , 121 : 3224–3225, doi : 10.1021/ja984321a
- ^ Торрака, Кентукки; Хуанг, X.; Пэрриш, Калифорния; Бухвальд, С.Л. (2001), "Эффективный межмолекулярный палладий-катализируемый синтез ариловых эфиров", J. Am. хим. Соц. , 123 (43): 10770–10771, doi : 10.1021/ja016863p , PMID 11674023
- ^ Хесгаард Джепсен, вторник (2011 г.). «Синтез функционализированных дибензотиофенов - эффективный трехэтапный подход, основанный на Pd-катализируемом образовании связей C – C и CS». Европейский журнал органической химии . 2011 : 53–57. дои : 10.1002/ejoc.201001393 .
- ^ Калкин, Д.А.; Хартвиг, Дж. Ф. (2003), «Катализируемое палладием р-арилирование карбонильных соединений и нитрилов», Acc. хим. Рез. , 36 (4): 234–245, doi : 10.1021/ar0201106 , PMID 12693921
- ^ Хамада, Т.; Шеффи, А.; Ахман, Дж.; Бухвальд, С.Л. (2002), «Улучшенный катализатор асимметричного арилирования енолятов кетонов», J. Am. хим. Соц. , 124 (7): 1261–1268, doi : 10.1021/ja011122+ , PMID 11841295
- ^ Ляо, X.; Венг, З.; Хартвиг, Дж. Ф. (2008), «Энантиоселективное р-арилирование кетонов с помощью арилтрифлатов, катализируемое дифторфосфорными комплексами палладия и никеля», J. Am. хим. Соц. , 130 (1): 195–200, doi : 10.1021/ja074453g , PMC 2551326 , PMID 18076166
Внешние ссылки
[ редактировать ]- Связь Бухвальда-Хартвига - новейшая литература
- Химия Бухвальда-Хартвига Ян Мангион Встреча группы Макмиллана 30 июля 2002 г. Ссылка
- Реакция Бухвальда-Хартвига Катализаторы из драгоценных металлов от Acros Organics для реакций сочетания в органическом синтезе Ссылка

