Уравнение Тафта
| заместитель | EЕсть | с* |
|---|---|---|
| -ЧАС | 1.24 | 0.49 |
| –CH–CH3 | 0 | 0 |
| -СН 2 СН 3 | –0.07 | –0.1 |
| –СН(СН 3 ) 2 | –0.47 | –0.19 |
| –С(СН 3 ) 3 | –1.54 | –0.3 |
| –СН 2 Ф. | –0.38 | 0.22 |
| –Ф. | –2.55 | 0.6 |
Уравнение Тафта представляет собой линейное соотношение свободной энергии (LFER), используемое в физической органической химии при изучении механизмов реакций и при разработке количественных зависимостей структура-активность органических соединений . Он был разработан Робертом Тафтом в 1952 году. [2] [3] [4] как модификация уравнения Гаммета . [5] В то время как уравнение Хэммета объясняет, как поля , индуктивности и резонанса влияют на скорость реакции, уравнение Тафта также описывает стерические эффекты заместителя эффекты . Уравнение Тафта записывается как:
где – отношение скорости реакции замещения по сравнению с реакцией сравнения, ρ* – коэффициент чувствительности реакции к полярным эффектам , σ* – константа полярного заместителя, описывающая полевые и индуктивные эффекты заместителя, δ – коэффициент чувствительности реакции на стерические эффекты, E s – константа стерического заместителя.
Константы полярных заместителей, σ*
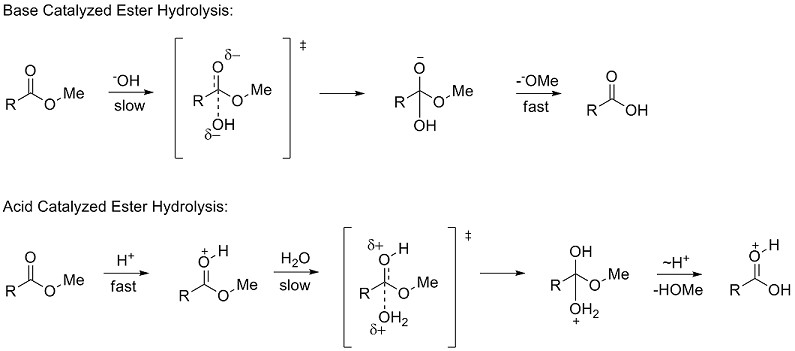
[ редактировать ]Константы полярного заместителя описывают, как заместитель будет влиять на реакцию посредством полярных (индуктивных, полевых и резонансных) эффектов. Чтобы определить σ * Тафт изучал гидролиз метиловых ( RCOOMe эфиров ). Использование скоростей гидролиза эфиров для изучения полярных эффектов было впервые предложено Ингольдом в 1930 году. [6] Гидролиз сложных эфиров может происходить по механизмам, катализируемым кислотами и основаниями , оба из которых протекают через тетраэдрическое промежуточное соединение . В механизме, катализируемом основанием, реагент переходит от нейтрального вещества к отрицательно заряженному промежуточному соединению на стадии, определяющей скорость (медленную) , тогда как в механизме, катализируемом кислотой, положительно заряженный реагент переходит к положительно заряженному промежуточному соединению.
Из-за сходства тетраэдрических интермедиатов Тафт предположил, что в идентичных условиях любые стерические факторы должны быть почти одинаковыми для двух механизмов и, следовательно, не будут влиять на соотношение скоростей. Однако из-за разницы в накоплении заряда на стадиях определения скорости было высказано предположение, что полярные эффекты будут влиять только на скорость реакции, катализируемой основанием, поскольку образуется новый заряд. Он определил константу полярного заместителя σ* как:
где log(k s /k CH 3 ) B — отношение скорости реакции, катализируемой основанием, по сравнению с эталонной реакцией, log(k s /k CH 3 ) A — отношение скорости реакции, катализируемой кислотой, по сравнению со скоростью реакции, катализируемой кислотой, по сравнению с эталонной реакцией. эталонная реакция, а ρ* — константа реакции, описывающая чувствительность реакционной серии. Для серии реакций определения ρ* принимали равным 1, а R = метил определяли как эталонную реакцию (σ* = ноль). Коэффициент 1/2,48 включен для того, чтобы сделать σ* близким по величине к значениям σ Хэммета .
Константы стерических заместителей, E s
[ редактировать ]Хотя кислотно-катализируемый и щелочно-катализируемый гидролиз сложных эфиров дает переходные состояния для стадий, определяющих скорость, которые имеют разную плотность заряда , их структуры различаются только двумя атомами водорода . Таким образом, Тафт предположил, что стерические эффекты будут одинаково влиять на оба механизма реакции. В связи с этим константу стерического заместителя E s определяли исключительно на основе реакции, катализируемой кислотой, поскольку она не включала полярные эффекты. E s определялся как:
где k s – скорость изучаемой реакции и – скорость эталонной реакции (R = метил). δ — константа реакции, которая описывает восприимчивость серии реакций к стерическим эффектам. Для серии реакций определения δ было установлено равным 1, а E s для эталонной реакции было установлено равным нулю. Это уравнение объединяется с уравнением для σ*, чтобы получить полное уравнение Тафта.
Из сравнения значений E s для метила, этила , изопропила и трет-бутила видно, что значение увеличивается с увеличением стерического объема. Однако, поскольку контекст будет влиять на стерические взаимодействия [7] некоторые значения E s могут быть больше или меньше ожидаемых. Например, значение фенила намного больше, чем значение трет -бутила. При сравнении этих групп с использованием другого показателя стерического объема, значений осевой деформации , трет -бутильная группа оказывается больше. [8]
Другие стерические параметры LFER
[ редактировать ]В дополнение к стерическому параметру Тафта E s были определены другие стерические параметры, независимые от кинетических данных. Чартон определил значения v , полученные из радиусов Ван-дер-Ваальса . [9] [10] Используя молекулярную механику , Мейерс определил V а значения, полученные из объема той части заместителя, которая находится в пределах 0,3 нм от реакционного центра. [11]
Факторы чувствительности
[ редактировать ]Коэффициент полярной чувствительности, ρ*
[ редактировать ]Подобно значениям ρ для графиков Хэммета, коэффициент полярной чувствительности ρ* для графиков Тафта будет описывать восприимчивость серии реакций к полярным эффектам. Когда стерические эффекты заместителей не оказывают существенного влияния на скорость реакции, уравнение Тафта упрощается до формы уравнения Гаммета:
Коэффициент полярной чувствительности ρ* можно получить, построив график отношения измеренных скоростей реакции ( k s ) по сравнению с эталонной реакцией ( ) от значений σ* заместителей. Этот график даст прямую линию с наклоном, равным ρ*. Аналогично значению ρ Хэммета:
- Если ρ* > 1, реакция накапливает отрицательный заряд в переходном состоянии и ускоряется электроноакцепторными группами .
- Если 1 > ρ* > 0, накапливается отрицательный заряд и реакция слабо чувствительна к полярным эффектам.
- Если ρ* = 0, на реакцию не влияют полярные эффекты.
- Если 0 > ρ* > −1, накапливается положительный заряд и реакция слабо чувствительна к полярным эффектам.
- Если −1 > ρ*, реакция накапливает положительный заряд и ускоряется электронодонорными группами .
Коэффициент стерической чувствительности, δ
[ редактировать ]Подобно коэффициенту полярной чувствительности, фактор стерической чувствительности δ для новой серии реакций будет описывать, в какой степени на скорость реакции влияют стерические эффекты. Когда на серию реакций не оказывают существенного влияния полярные эффекты, уравнение Тафта сводится к:
График зависимости скоростей от величины E s заместителя будет представлять собой прямую линию с наклоном, равным δ. Подобно значению ρ по Гаммету, величина δ будет отражать, в какой степени на реакцию влияют стерические эффекты:
- Очень крутой наклон будет соответствовать высокой стерической чувствительности, тогда как пологий наклон будет соответствовать незначительной чувствительности или ее отсутствию.
Поскольку значения E s большие и отрицательные для более объемных заместителей, отсюда следует, что:
- Если δ положительное значение, увеличение стерического объема снижает скорость реакции, и стерические эффекты в переходном состоянии больше.
- Если δ отрицательно, увеличение стерического объема увеличивает скорость реакции, а стерические эффекты в переходном состоянии уменьшаются.
Реакции под влиянием полярных и стерических эффектов
[ редактировать ]Когда на скорость реакции влияют как стерические, так и полярные эффекты, уравнение Тафта можно решить как для ρ*, так и для δ, используя стандартные методы наименьших квадратов для определения бивариантной плоскости регрессии . Тафт описал применение этого метода для решения уравнения Тафта в статье 1957 года. [12]
Графики Тафта в QSAR
[ редактировать ]Уравнение Тафта часто используется в биологической химии и медицинской химии для разработки количественных связей структура-активность (QSAR). В недавнем примере Сандри и его коллеги [13] использовали графики Тафта при изучении полярных эффектов при аминолизе β -лактамов . Они изучили связывание β-лактамов с полимером поли(этиленимина) , который действует как простой имитатор человеческого сывороточного альбумина (HSA). Считается, что образование ковалентной связи между пенициллинами и ЧСА в результате аминолиза с остатками лизина связано с аллергией на пенициллин . В рамках своих механистических исследований Сандри и его коллеги построили график зависимости скорости аминолиза от расчетных значений σ* для 6 пенициллинов и не обнаружили никакой корреляции, что позволяет предположить, что на скорость влияют и другие эффекты, помимо полярных и стерических эффектов.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Эрик Анслин, Э.; Догерти, Д.А. Современная физико-органическая химия ; Университетские научные книги, 2006, стр. 455.
- ^ Тафт, Роберт В. (июнь 1952 г.). «Линейные зависимости свободной энергии от скорости этерификации и гидролиза алифатических и ортозамещенных бензоатных эфиров» . Журнал Американского химического общества . 74 (11): 2729–2732. дои : 10.1021/ja01131a010 . ISSN 0002-7863 .
- ^ Тафт, Роберт В. (1 июня 1952 г.). «Константы полярных и стерических заместителей для алифатических и о-бензоатных групп по скорости этерификации и гидролиза сложных эфиров1» . Журнал Американского химического общества . 74 (12): 3120–3128. дои : 10.1021/ja01132a049 . ISSN 0002-7863 .
- ^ Тафт, Роберт В. (1 сентября 1953 г.). «Линейные стерические энергетические отношения» . Журнал Американского химического общества . 75 (18): 4538–4539. дои : 10.1021/ja01114a044 . ISSN 0002-7863 .
- ^ Хэммет, Луи П. (1 января 1937 г.). «Влияние структуры на реакции органических соединений. Производные бензола» . Журнал Американского химического общества . 59 (1): 96–103. дои : 10.1021/ja01280a022 . ISSN 0002-7863 .
- ^ Эйнли, Артур Дональд; Челленджер, Фредерик (1 января 1930 г.). «CCLXXX. — Исследования связи бор-углерод. Часть I. Окисление и нитрование фенилборной кислоты» . Журнал Химического общества (возобновленный) : 2171–2180. дои : 10.1039/JR9300002171 . ISSN 0368-1769 .
- ^ Макклелланд, Роберт А.; Стенкен, Стин. (1 августа 1988 г.). «Радиационно-химическое производство, время жизни и соотношение структура-активность альфа-диалкоксиалкилкарбокатионов в водных растворах: важность сольватации для реакционной способности катионов» . Журнал Американского химического общества . 110 (17): 5860–5866. дои : 10.1021/ja00225a042 . ISSN 0002-7863 .
- ^ Анслин, Эрик В., 1960- (2006). Современная физическая органическая химия . Догерти, Деннис А., 1952-. Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 1-891389-31-9 . OCLC 55600610 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Чартон, Марвин (1 марта 1975 г.). «Стерические эффекты. I. Этерификация и кислотно-катализируемый гидролиз сложных эфиров» . Журнал Американского химического общества . 97 (6): 1552–1556. дои : 10.1021/ja00839a047 . ISSN 0002-7863 .
- ^ Чартон, Марвин. (1 июня 1976 г.). «Стерические эффекты. 7. Дополнительные константы V» . Журнал органической химии . 41 (12): 2217–2220. дои : 10.1021/jo00874a035 . ISSN 0022-3263 .
- ^ Мейер, Аматзя Ю. (1 января 1986 г.). «Молекулярная механика и форма молекул. Часть 4. Размер, форма и стерические параметры» . Журнал Химического общества, Perkin Transactions 2 (10): 1567–1572. дои : 10.1039/P29860001567 . ISSN 1364-5471 .
- ^ Павелич, Уильям А.; Тафт, Роберт В. (1 сентября 1957 г.). «Оценка индуктивного и стерического воздействия на реакционную способность. Скорость метанолиза l-ментиловых эфиров в метаноле, катализируемая метоксидом1» . Журнал Американского химического общества . 79 (18): 4935–4940. дои : 10.1021/ja01575a029 . ISSN 0002-7863 .
- ^ Арчелли, Антонио; Порзи, Джанни; Ринальди, Самуэле; Сандри, Моника (2008). «Эффект электростатических взаимодействий при аминолизе некоторых β-лактамов в присутствии поли(этиленимина): структурно-реактивность» . Журнал физической органической химии . 21 (2): 163–172. дои : 10.1002/poc.1301 . ISSN 1099-1395 .


![{\displaystyle \sigma ^{*}=\left({\frac {1}{2,48\rho ^{*}}}\right){\Bigg [}\log \left({\frac {k_{s} }{k_{{\ce {CH3}}}}}\right)_{B}-\log \left({\frac {k_{s}}{k_{{\ce {CH3}}}}}\ правильно)_{A}{\Bigg ]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ea2670a97aa75d22723d4617539ca85ee094bf9)



