Участие соседней группы
В органической химии участие соседних групп ( NGP , также известное как анхимерная помощь ) было определено Международным союзом теоретической и прикладной химии (IUPAC) как взаимодействие реакционного центра с неподеленной парой электронов . в атоме или электронами присутствует в сигма- или пи-связи, содержащейся внутри исходной молекулы, но не сопряженной с реакционным центром. [1] [1] [2] [3] Когда NGP работает, скорости реакции увеличение является нормальным. Также возможно, что стереохимия реакции будет аномальной (или неожиданной) по сравнению с нормальной реакцией. Хотя соседние группы могут влиять на многие реакции в органической химии ( например, реакция диена , такого как 1,3-циклогексадиен, с малеиновым ангидридом обычно дает эндо-изомер из-за вторичного эффекта {перекрытие π-орбиталей карбонильной группы с переходное состояние в реакции Дильса-Альдера }) эта страница ограничена эффектами соседних групп, наблюдаемыми в реакциях карбокатионов и S N 2 .
NGP по неподеленным парам гетероатомов
[ редактировать ]В этом типе реакции замещения одна группа субстрата первоначально участвует в реакции и тем самым влияет на реакцию. Благодаря NGP скорость реакции увеличивается во много раз. [ нужны разъяснения ] реакция сернистого или азотистого иприта с нуклеофилом , скорость реакции для сернистого иприта и нуклеофила намного выше, чем для первичного или вторичного алкилхлорида Классическим примером NGP является без гетероатома . [ нужна ссылка ]

Ph-S-CH 2 -CH 2 -Cl реагирует с водой в 650 раз быстрее, чем СН 3 -СН 2 -СН 2 -Cl . [ нужна ссылка ]
NGP по алкену
[ редактировать ]π-орбитали алкена могут стабилизировать переходное состояние , помогая делокализовать положительный заряд карбокатиона . Например, ненасыщенный тозилат будет реагировать быстрее (10 11 раз быстрее для водного сольволиза) с нуклеофилом, чем насыщенный тозилат.
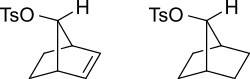
Карбокатионный промежуточный продукт будет стабилизирован за счет резонанса , когда положительный заряд распространяется на несколько атомов. На схеме ниже это показано.
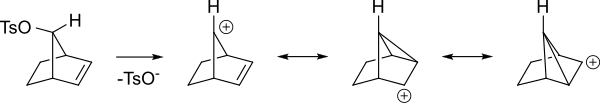
Вот другой взгляд на те же промежуточные продукты.

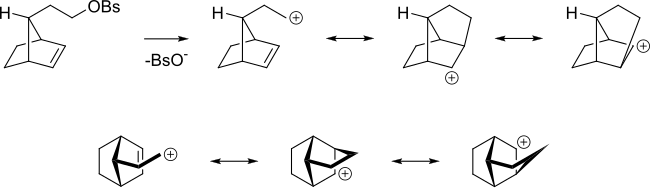
Даже если алкен находится дальше от реагирующего центра, он все равно может действовать таким образом. Например, в следующем алкилбензолсульфонате алкен способен делокализовать карбокатион.
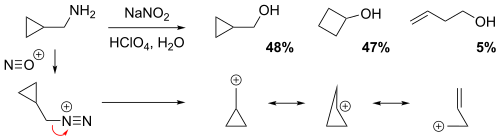
NGP циклопропановой, циклобутановой или гомоаллильной группой
[ редактировать ]Реакция циклопропилметамина с нитритом натрия в разбавленном водном растворе хлорной кислоты дала смесь 48% циклопропилметилового спирта, 47% циклобутанола и 5% гомоаллилового спирта (бут-3-ен-1-ола). [4] С неклассической точки зрения положительный заряд делокализуется по всей промежуточной карбокатионной структуре посредством резонанса, что приводит к образованию частичных (электронодефицитных) связей. Очевидно, относительно низкий выход гомоаллильного спирта означает, что гомоаллильная структура вносит наименьший резонансный вклад.
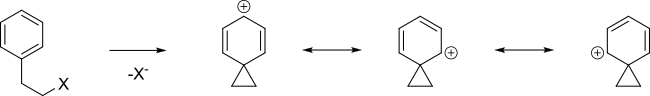
NGP по ароматическому кольцу
[ редактировать ]кольцо Ароматическое может способствовать образованию карбокатионного промежуточного соединения, называемого ионом фенония, путем делокализации положительного заряда.
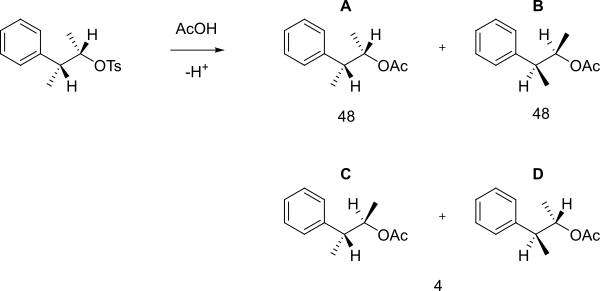
Когда следующий тозилат реагирует с уксусной кислотой при сольволизе , вместо простой реакции S N 2 с образованием B получается смесь A, B (которые являются энантиомерами) и C+D в соотношении 48:48:4. [2] [3] .
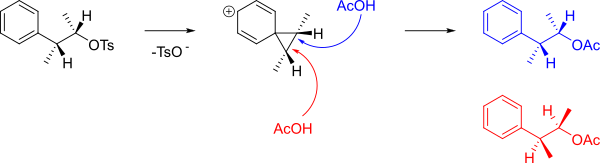
Механизм образования A и B показан ниже.
NGP за счет алифатических связей CC или CH
[ редактировать ]Алифатические связи CC или CH могут привести к делокализации заряда, если эти связи расположены близко и антиперипланарно по отношению к уходящей группе. Соответствующие интермедиаты относят к неклассическим ионам , 2-норборнильная наиболее известным случаем является система.
Внешние ссылки
[ редактировать ]Ссылки
[ редактировать ]- ^ де Рой, Дж. Ф.; Вилле-Хазелегер, Г.; Бургеры, премьер-министр; ван Бум, Дж. Х. (1979). «Участие соседней группы в разблокировке фосфотриэфиров нуклеиновых кислот» . Исследования нуклеиновых кислот . 6 (6): 2237–2259. дои : 10.1093/нар/6.6.2237 . ПМЦ 327848 . ПМИД 461188 .
- ^ Сталфорд, Сюзанна А.; Килнер, Колин А.; Лич, Эндрю Г.; Тернбулл, В. Брюс (7 декабря 2009 г.). «Участие соседних групп против добавления к ионам оксакарбения: исследования по синтезу микобактериальных олигосахаридов». Органическая и биомолекулярная химия . 7 (23). Королевское химическое общество : 4842–4852. дои : 10.1039/B914417J . ПМИД 19907773 .
- ^ Боуден, Кейт (1 января 1993 г.). «Участие соседних карбонильных групп в гидролизе сложного эфира» . В Бетелле, Д. (ред.). Успехи физико-органической химии Том 28 . Достижения физико-органической химии. Том. 28. Академик Пресс, ScienceDirect . стр. 171–206. дои : 10.1016/S0065-3160(08)60182-3 . ISBN 9780120335282 . Проверено 17 декабря 2019 г.
- ^ Робертс, доктор медицинских наук; Мазур, Р.Х. (1951). «Соединения с малым кольцом. IV. Реакции взаимного превращения циклобутильных, циклопропилкарбинильных и аллилкарбинильных производных». Журнал Американского химического общества . 73 (6): 2509–2520. дои : 10.1021/ja01150a029 .
- ^ Передовая органическая химия , стр. 314, Джерри Марч (4-е изд.), Wiley-Interscience.
- ^ Исследования по стереохимии . I. Стереоспецифическая перегруппировка Вагнера-Меервейна изомеров 3 -фенил-2-бутанола Дональд Дж. Крам Дж. Ам. хим. Соц. ; 1949 год ; 71(12); 3863-3870. Абстрактный
- ^ Исследования по стереохимии. V. Ионные пары сульфоната фенония как промежуточные соединения во внутримолекулярных перегруппировках и реакциях сольволиза, которые происходят в системе 3-фенил-2-бутанола Дональд Дж. Крам Дж. Ам. хим. Соц. ; 1952 год ; 74(9); 2129-2137 Аннотация .