Реакция Генри
Эта статья может быть слишком технической для понимания большинства читателей . ( Май 2019 г. ) |
| Реакция Генри | |
|---|---|
| Назван в честь | Луи Генри |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Генри-реакция |
| RSC Идентификатор онтологии | RXNO: 0000086 |
Реакция Генри — классическая реакция образования углерод-углеродных связей в органической химии . Открытый в 1895 году бельгийским химиком Луи Анри (1834–1913), он представляет собой комбинацию нитроалкана и альдегида или кетона в присутствии основания с образованием β-нитроспиртов. [1] [2] [3] Этот тип реакции также называют нитроальдольной реакцией (нитроалкан, альдегид и спирт). Она почти аналогична альдольной реакции , открытой 23 годами ранее, при которой два карбонильных соединения соединяются с образованием β-гидроксикарбонильных соединений, известных как «альдолы» (альдегид и спирт). [2] [4] Реакция Генри является полезным методом в области органической химии из-за синтетической полезности соответствующих продуктов, поскольку их можно легко преобразовать в другие полезные синтетические промежуточные продукты. Эти преобразования включают последующую дегидратацию с образованием нитроалкенов , окисление вторичного спирта с получением α-нитрокетонов или восстановление нитрогруппы с получением β-аминоспиртов.

Многие из этих применений были проиллюстрированы синтезом различных фармацевтических препаратов, включая β-блокатор ( S )-пропранолол , [5] [6] ингибитор протеазы ВИЧ ампренавир (Vertex 478) и построение углеводной субъединицы антибиотиков антрациклинового класса, L-акозамина . [6] Синтетическую схему синтеза L-акозамина можно найти в разделе «Примеры» этой статьи.
Механизм
[ редактировать ]Реакция Генри начинается с депротонирования нитроалкана по α-углеродному положению с образованием нитроната . РКа большинства нитроалканов составляет примерно 17. [7] [8] Хотя эта структура является нуклеофильной как по депротонированному углероду, так и по окси-анионам нитрогруппы, [9] наблюдаемый результат заключается в том, что углерод атакует карбонильное соединение. Образующийся β-нитроалкоксид протонируется сопряженной кислотой основания, которое первоначально депротонировало нитроалкильную структуру, давая в качестве продукта соответствующий β-нитроспирт.

Важно отметить, что все стадии реакции Генри обратимы. Это происходит из-за отсутствия четкого этапа реакции образования продукта. Именно по этой причине исследования были направлены на модификации, которые доведут реакцию до завершения. [2] [3] Более подробную информацию об этом можно найти в разделе модификации этой статьи.
Стереохимический курс
[ редактировать ]На рисунке ниже показана одна из общепринятых моделей стереоселекции без каких-либо изменений реакции Генри. В этой модели стереоселективность определяется размером R-групп в модели (например, углеродной цепи), а также переходным состоянием, которое минимизирует диполь за счет ориентации нитрогруппы и карбонильного кислорода друг против друга (на противоположных сторонах). молекулы). Группы R играют роль в переходном состоянии реакции Генри: чем больше группы R на каждом из субстратов, тем больше они будут стремиться отклоняться друг от друга (обычно называемые стерическими эффектами ). [3] [10]
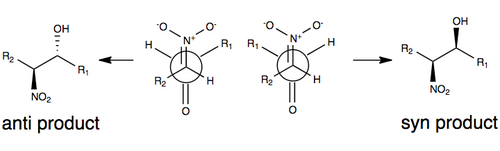
Из-за обратимости реакции и тенденции к легкой эпимеризации нитрозамещенного атома углерода (среди ряда факторов) реакция Генри обычно приводит к образованию смеси энантиомеров или диастереомеров . Именно по этой причине объяснения стереоселективности без какой-либо модификации реакции остаются скудными. [3] В последние годы фокус исследований сместился в сторону модификации реакции Генри для решения этой синтетической проблемы.
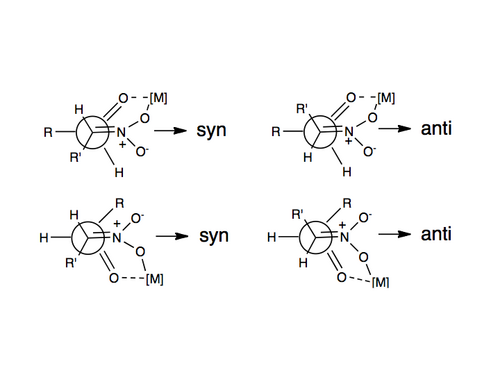
О первом примере энантиоселективной реакции нитроальдола сообщалось в 1992 году с использованием катализаторов Шибасаки . [11] Одним из наиболее часто используемых методов индукции энантио- или диастереоселективности в реакции Генри является использование хиральных металлических катализаторов, в которых нитрогруппа и карбонильный кислород координируются с металлом, связанным с хиральной органической молекулой. Некоторые используемые металлы включают цинк, кобальт, медь, магний и хром. [12] Изображение этой координации проиллюстрировано выше.
Общие характеристики
[ редактировать ]Одна из многих особенностей реакции Генри, которая делает ее синтетически привлекательной, заключается в том, что для запуска реакции используется только каталитическое количество основания. Кроме того, можно использовать различные основания, включая ионные основания, такие как гидроксиды, алкоксиды, карбонаты щелочных металлов, и источники фторид-аниона (например, TBAF) или неионные органические аминные основания, включая TMG, DBU, DBN и PAP. Важно отметить, что используемые основание и растворитель не оказывают большого влияния на общий результат реакции. [2]
Ограничения
[ редактировать ]Одним из основных недостатков реакции Генри является возможность возникновения побочных реакций. Помимо присущей реакции обратимости (или «ретро-Генри»), которая может предотвратить протекание реакции, β-нитроспирт также может подвергаться дегидратации. самоконденсации, катализируемой основаниями ( реакция Канниццаро Для стерически затрудненных субстратов также возможно возникновение ). Общая схема реакции Канниццаро изображена ниже. [2]

Модификации
[ редактировать ]В реакцию Генри был внесен ряд модификаций. Из них некоторые из наиболее важных включают использование условий высокого давления, а иногда и отсутствия растворителей, для улучшения хемо- и региоселективности. [2] и хиральные металлические катализаторы для индукции энантио- или диастереоселективности. [12] Реакция аза-Генри также используется для получения нитроаминов и может быть надежным синтетическим путем синтеза вицинальных диаминов. [13]
Возможно, одной из наиболее синтетически полезных модификаций реакции Генри является использование органокатализатора . [2] [12] [14] Каталитический цикл показан ниже.

Бенджамин Лист отметил, что, хотя это и широкое объяснение, его краткий обзор показывает, что это правдоподобное механистическое объяснение почти всех реакций, в которых участвуют органокатализаторы. Пример реакции этого типа проиллюстрирован в разделе «Примеры» этой статьи.
Помимо ранее упомянутых модификаций реакции Генри, существует множество других. Это включает в себя преобразование нереакционноспособных алкилнитросоединений в соответствующие им дианионы, которые будут быстрее реагировать с карбонильными субстратами, реакции можно ускорить, используя PAP в качестве основания, использование реакционной способности альдегидов с α,α-дважды депротонированными нитроалканами для получения нитронаталкоксидов, которые дают нитронаталкоксиды, которые дают в основном син-нитроспирты после протонирования, и, наконец, образование нитронат-анионов, в которых один атом кислорода в нитрогруппе защищен силилом, с образованием анти-β-нитроспиртов в присутствии источника фторид-аниона при реакции с альдегидом. [2] [3]
Примеры
[ редактировать ]- Промышленное применение
- В 1999 году Мензель и его коллеги разработали синтетический путь получения L - акозамина , углеводной субъединицы антибиотиков антрациклинового класса: [6] [15]
- Промышленное применение
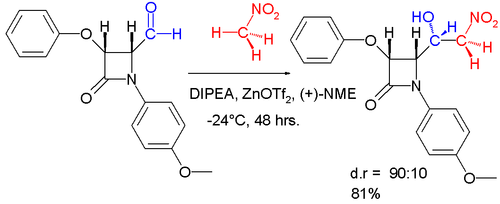
- Продукт энантиоселективного асимметричном альдольного присоединения может быть получен в синтезе реакцией бензальдегида с нитрометаном и каталитической системой, состоящей из трифлата цинка в качестве кислоты Льюиса , диизопропилэтиламина (ДИПЭА) и N -метилэфедрина (NME) в качестве и в качестве хирального лиганда . [16] Диастереоселективный вариант этой реакции изображен ниже. [17]
- Тотальный синтез
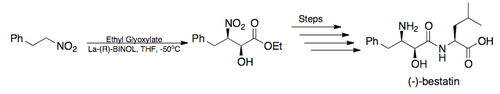
- В 2005 году Баруа и его коллеги завершили полный синтез мощного ингибитора аминопептидазы, (-)-бестатина, с общим выходом 26%, используя асимметричную реакцию Генри Шибасаки в качестве ключевого этапа. (показано ниже) [6] [18]
- Органокатализ
- В 2006 году Химстра и его коллеги исследовали использование производных хинина в качестве асимметричных катализаторов реакции между ароматическими альдегидами и нитрометаном. Благодаря использованию определенных производных они смогли вызвать прямую энантиоселекцию за счет использования подходящего катализатора. [19]
- Биокатализ
- В 2006 году Пуркартхофер и др. обнаружили, что ( S )-гидроксинитриллиаза гевеи бразильской катализирует образование ( S )-β-нитроспиртов. [20] В 2011 году Фухшуку и Асано показали, что ( R )-селективная гидроксинитриллиаза из Arabidopsis thaliana может катализировать синтез ( R )-β-нитроспиртов из нитрометана и ароматических альдегидов. [21]
Ссылки
[ редактировать ]- ^ Генри, Луи (1895). «Синтетическое образование нитрованных спиртов» . Отчеты . 120 : 1265–1268.
- ^ Jump up to: а б с д и ж г час Курти, Л.; Чако, Б. (2005). Стратегическое применение названных реакций в органическом синтезе . Берлингтон, Массачусетс: Elsevier Academic Press. стр. 202–203. ISBN 978-0-12-369483-6 .
- ^ Jump up to: а б с д и Ноборо, Оно (2001). Нитрогруппа в органическом синтезе . Нью-Йорк, штат Нью-Йорк: Wiley-VCH. стр. 30–69. ISBN 978-0-471-31611-4 .
- ^ Вюрц, Массачусетс (1872 г.). «Об альдегид-спирте» . Бык. Грязный. хим. о. 17 : 436–442.
- ^ Сасаи Х., Сузуки Т., Ито Н., Арай С., Шибасаки М. (1993). «Каталитическая асимметричная реакция нитроальдола: эффективный синтез (s) пропранолола с использованием бинафтолового комплекса лантена». Буквы тетраэдра . 34 (52): 855–858. дои : 10.1016/0040-4039(93)89031-К .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б с д Луццио, Ф.А. (2001). «Реакция Генри: недавние примеры». Тетраэдр . 57 (22): 915–945. дои : 10.1002/chin.200122233 .
- ^ Райх, Ганс. «Таблица Bordwell pKa: «Нитроалканы» » . Химический факультет Университета Висконсина . Проверено 17 января 2016 г.
- ^ Мэтьюз, Уолтер; и др. (1975). «Равновесные кислотности угольных кислот. VI. Установление абсолютной шкалы кислотностей в растворе диметилсульфоксида». Журнал Американского химического общества . 97 (24): 7006. doi : 10.1021/ja00857a010 .
- ^ Берсон, Малькольм (1961). «Алкилирование C по сравнению с O в случае стабильного катиона». Дж. Ам. хим. Соц . 83 (9): 2136–2138. дои : 10.1021/ja01470a022 .
- ^ Бегона Л., Аррьета А., Морао И., Коссио Ф.П. (1997). «Модели Ab Initio реакции нитроальдола (Генри)». хим. Евро. Дж. 3 (1): 20–28. дои : 10.1002/chem.19970030105 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Сасаи, Хироаки; Сузуки, Такеюки; Арай, Сигэру; Арай, Такаёси; Сибасаки, Масакацу (1 мая 1992 г.). «Основы алкоксидов редкоземельных металлов. Использование в каталитических реакциях образования углерод-углеродных связей и каталитических асимметричных нитроальдольных реакциях». Журнал Американского химического общества . 114 (11): 4418–4420. дои : 10.1021/ja00037a068 .
- ^ Jump up to: а б с Лист и др. описал этот процесс как органокатализатор, функционирующий как кислота или основание Льюиса или кислота или основание Бренстеда.
- ^ Вестерманн, Б. (2003). «Асимметричные каталитические реакции аза-Генри, приводящие к 1,2-диаминам и 1,2-диаминокарбоновым кислотам». Энджью. хим. Межд. Эд. англ. 42 (2): 151–153. дои : 10.1002/anie.200390071 . ПМИД 12532343 .
- ^ Сияд Дж., Лист Б. (2005). «Асимметричный органокатализ». Орг. Биомол. хим. 3 (5): 719–724. дои : 10.1039/b415217b . ПМИД 15731852 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Мензель А., Орляйн Р., Гриссер Х., Венер В., Ягер В. (1999). «Краткий синтез L -акозамина на основе добавления нитроальдола (реакция Генри). Анализ ключевого этапа, касающегося влияния растворителя и температуры». Синтез . 9 (45): 1691–1702. дои : 10.1002/chin.199945325 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Паломо, Клаудио; Ойарбиде, Микель; Ласо, Антонио (2005). «Энантиоселективные реакции Генри в условиях двойного кислотно-аминного катализа Льюиса с использованием хиральных аминоспиртовых лигандов». Ангеванде Хеми . 44 (25): 3881–3884. дои : 10.1002/anie.200463075 . ПМИД 15892142 .
- ^ Алькаиде, Бенито; Альмендрос, Педро; Луна, Ампаро; Пас де Арриба, М.; Розарио Торреск, М. (2007). «Органокатализируемая диастереоселективная реакция Генри энантиочистых 4-оксоазетидин-2-карбальдегидов» (PDF) . Аркивок . 2007 (iv): 285–296. дои : 10.3998/ark.5550190.0008.425 .
- ^ Гогои Н., Борува Дж., Баруа, Северная Каролина (2005). «Полный синтез (–)-бестатина с использованием асимметричной реакции Генри Шибасаки». Буквы тетраэдра . 46 (44): 7581–7582. дои : 10.1016/j.tetlet.2005.08.153 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Марчелли Т., ван дер Хаас Р., ван Маарсевин Дж. Х., Химстра Х. (2006). «Асимметричная органокаталитическая реакция Генри». Энджью. хим. Межд. Эд. 45 (6): 929–931. дои : 10.1002/anie.200503724 . ПМИД 16429453 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Пуркартхофер Т., Грубер К., Грубер-Хаджави М., Вайх К., Скранц В., Минк Д. и Грингл Х. (2006). «Биокаталитическая реакция Генри — гидроксинитриллиаза из гевеи бразильской также катализирует реакции нитроальдола». Ангеванде Хеми . 45 (21): 3454–3456. дои : 10.1002/anie.200504230 . ПМИД 16634109 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Фушуку К., Асано Ю. (2011). «Синтез ( R )-β-нитроспиртов, катализируемый R -селективной гидроксинитриллиазой Arabidopsis thaliana в водно-органической двухфазной системе». Дж. Биотехнология. 153 (3–4): 153–159. doi : 10.1016/j.jbiotec.2011.03.011 . ПМИД 21439333 .
Внешние ссылки
[ редактировать ] СМИ, связанные с реакцией Генри, на Викискладе?
СМИ, связанные с реакцией Генри, на Викискладе?