олефинирование по Петерсону
| олефинирование по Петерсону | |
|---|---|
| Назван в честь | Дональд Джон Петерсон |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | петерсон-олефинирование |
| RSC Идентификатор онтологии | RXNO: 0000080 |
Олефинирование Петерсона (также называемое реакцией Петерсона ) представляет собой химическую реакцию α-силилкарбанионов ( 1 на диаграмме ниже) с кетонами (или альдегидами ) с образованием β-гидроксисилана ( 2 ), который распадается с образованием алкенов ( 3 ). [1]
Опубликовано несколько обзоров. [2] [3] [4] [5] [6]
Механизм реакции
[ редактировать ]Одной из привлекательных особенностей олефинирования по Петерсону является то, что его можно использовать для получения цис- или транс-алкенов из одного и того же β-гидроксисилана. Обработка β-гидроксисилана кислотой даст один алкен, а обработка того же β-гидроксисилана основанием даст алкен противоположной стереохимии.
Базовое устранение
[ редактировать ]Действие основания на β-гидроксисилан ( 1 ) приводит к согласованному син- элиминированию ( 2 ) или ( 3 ) с образованием желаемого алкена. пятикоординатного силикатного промежуточного соединения ( 3 ), но доказательств на сегодняшний день не существует. Предполагается наличие [ когда? ]
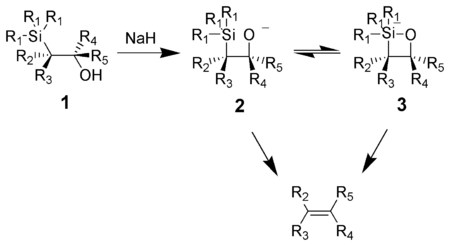
Алкоксиды калия быстро удаляются, тогда как алкоксиды натрия обычно требуют нагревания. Алкоксиды магния удаляются только в экстремальных условиях. Порядок реакционной способности алкоксидов K > Na >> Mg соответствует более высокой электронной плотности кислорода , что приводит к увеличению нуклеофильности алкоксидов.
Кислотное устранение
[ редактировать ]Обработка β-гидроксисилана ( 1 ) кислотой приводит к протонированию и антиэлиминированию с образованием желаемого алкена.

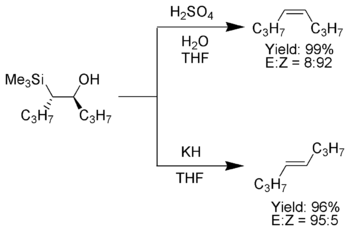
Алкильные заместители
[ редактировать ]Когда α-силилкарбанион содержит только алкильные , водородные или электронодонорные заместители , можно контролировать стереохимический результат олефинирования Петерсона. [7] потому что при низкой температуре элиминирование происходит медленно и можно выделить промежуточный β-гидроксисилан.
После выделения диастереомерные β-гидроксисиланы разделяют. Один диастереомер обрабатывают кислотой, а другой — основанием, превращая таким образом материал в алкен с необходимой стереохимией. [4]
Электроноакцепторные заместители
[ редактировать ]Когда α-силильный карбанион содержит электроноакцепторные заместители, олефинирование Петерсона непосредственно образует алкен. Промежуточный β-гидроксисилан не может быть выделен, поскольку он удаляется in situ . В этих случаях постулируется основной путь элиминации.
Функциональная групповая толерантность
[ редактировать ]В отличие от реакции Виттига , олефинации типа Петерсона толерантны к нитрилам . [8]
Вариации
[ редактировать ]Условия кислотного элиминирования иногда невозможны, поскольку кислота также способствует изомеризации двойной связи . Кроме того, удаление с помощью гидрида натрия или калия может оказаться невозможным из-за несовместимости функциональных групп . Чан и др. обнаружили, что ацилирование промежуточного силилкарбинола либо ацетилхлоридом , либо тионилхлоридом дает β-силиловый эфир , который самопроизвольно удаляется при 25 ° C, давая желаемый алкен. [9] Кори и его коллеги разработали метод (иногда называемый олефинированием Кори-Петерсона). [10] ) с использованием силилированного имина для получения α,β-ненасыщенного альдегида из карбонильного соединения за одну стадию. [11] Пример его использования в полном синтезе см.: Полный синтез таксола Куваджима.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ DJ Петерсон (1968). «Реакция карбонильного олефинирования с использованием силилзамещенных металлорганических соединений». Дж. Орг. хим. 33 (2): 780–784. дои : 10.1021/jo01266a061 .
- ^ Биркофер, Л.; Штиль, О. Топ. Курс. хим. 1980 , 88 , 58. (Обзор)
- ^ Агер, DJ Synthesis 1984 , 384–398. (Обзор)
- ^ Перейти обратно: а б Агер, DJ Org. Реагировать. 1990 , 38 , 1. два : 10.1002/0471264180.or038.01
- ^ Т.Х. Чан (1977). «Синтез алкенов через β-функционализированные кремнийорганические соединения». Акк. хим. Рез. 10 (12): 442–448. дои : 10.1021/ar50120a003 .
- ^ Новые разработки в реакции олефинирования Петерсона Л. Фрэнсис ван Стаден, Дэвид Грейвесток и Дэвид Дж. Агер Chem. Соц. Ред., 2002, 31, 195-200. дои : 10.1039/A908402I
- ^ Барретт, годовое общее собрание акционеров; Флайгар, Дж.А.; Хилл, Дж. М.; Уоллес, Э.М. (1998). «Стереоселективный синтез алкенов с помощью 1-хлор-1-[(диметил)фенилсилил]алканов и α-(диметил)фенилсилилкетонов: 6-метил-6-додецен» . Органические синтезы ; Сборник томов , т. 9, с. 580 .
- ^ Ланари, Даниэла; Алонци, Маттео; Ферлин, Франческо; Санторо, Стефано; Ваккаро, Луиджи (3 июня 2016 г.). «Каталитический петерсоновский синтез алкенилнитрилов». Органические письма . 18 (11): 2680–2683. doi : 10.1021/acs.orglett.6b01121 . ISSN 1523-7060 . ПМИД 27187788 .
- ^ Т.Х. Чан и Э. Чанг (1974). «Синтез алкенов от карбонильных соединений и карбанионов альфа до кремния. III. Полный отчет и синтез полового феромона непарного шелкопряда». Дж. Орг. хим. 39 (22): 3264–3268. дои : 10.1021/jo00936a020 . ПМИД 4473100 .
- ^ С. Цзэн; Ф. Цзэн и Э. Негиши (2004). «Эффективный и селективный синтез 6,7-дегидростипиамида посредством Zr-катализируемого асимметричного карбоалюминирования и Pd-катализируемого кросс-сочетания цинкорганических соединений». Орг. Летт. 6 (19): 3245–3248. дои : 10.1021/ol048905v . ПМИД 15355023 .
- ^ Э. Дж. Кори; Д. Эндерс и М. Г. Бок (1976). «Простой и очень эффективный путь к α-β-ненасыщенным альдегидам». Буквы тетраэдра . 17 (1): 7–10. дои : 10.1016/S0040-4039(00)71308-6 .
