Реакция Шапиро
| Реакция Шапиро | |
|---|---|
| Назван в честь | Роберт Х. Шапиро |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | шапиро-реакция |
| RSC Идентификатор онтологии | RXNO: 0000125 |
Реакция Шапиро или разложение тозилгидразона — это органическая реакция , в которой кетон или альдегид превращаются в алкен через промежуточный гидразон в присутствии 2 эквивалентов литийорганического реагента . [1] [2] [3] Реакция была открыта Робертом Х. Шапиро в 1967 году. [4] Реакцию Шапиро использовали при полном синтезе таксола Николау . [5] Эта реакция очень похожа на реакцию Бэмфорда-Стивенса , которая также включает основное разложение тозилгидразонов.

Механизм реакции и направленность
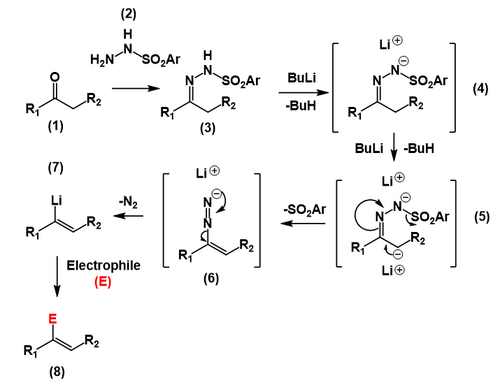
[ редактировать ]В прелюдии к настоящей реакции Шапиро кетон или альдегид (1) взаимодействует с п -толуолсульфонилгидразидом. [6] (2) с образованием п -толуолсульфонилгидразона (или тозилгидразона ), который представляет собой гидразон (3) . Два эквивалента сильного основания, такого как н -бутиллитий, отрывают протон от гидразона (4) , а затем менее кислый протон α к углероду гидразона (5) , образуя карбанион . Затем карбанион подвергается реакции элиминирования, углерод-углерод в результате которой образуется двойная связь и выбрасывается тозильный анион, образуя диазония анион (6) . Этот анион диазония затем теряется в виде молекулярного азота , в результате чего образуются разновидности виниллития (7) , которые затем могут вступать в реакцию с различными электрофилами , включая простую нейтрализацию водой или кислотой (8) .
Направленность реакции контролируется стереохимией гидразона, при этом депротонирование происходит цис-по отношению к тозиламидной группе. Это происходит за счет координации атомом азота. [7]

Объем
[ редактировать ]Положение алкена в продукте определяется местом депротонирования литийорганическим основанием. Как правило, кинетически предпочтительный, менее замещенный сайт дифференциально замещенных тозилгидразонов селективно депротонируется, что приводит к образованию менее замещенного промежуточного виниллития . виниллития существует множество вторичных реакций Хотя для функциональной группы , в реакции Шапиро, в частности, вода добавляется , что приводит к протонированию алкена . [8] Другие реакции соединений виниллития включают реакции алкилирования, например, с алкилгалогенидами . [9]

Важно отметить, что реакция Шапиро не может быть использована для синтеза 1-литиоалкенов (и полученных в результате функционализированных производных), поскольку сульфонилгидразоны, полученные из альдегидов, подвергаются исключительному присоединению литийорганического основания к углероду двойной связи C–N. [10]
Каталитическая реакция Шапиро
[ редактировать ]Традиционные реакции Шапиро требуют стехиометрических (иногда избыточных) количеств основания для получения алкениллитиевых реагентов. Чтобы решить эту проблему, Ямамото и его коллеги разработали эффективный стереоселективный и региоселективный путь получения алкенов, используя комбинацию кетон-фенилазиридинилгидразонов в качестве эквивалентов аренсульфонилгидразона с каталитическим количеством амидов лития.Требуемый фенилазиридинилгидразон был получен конденсацией ундекан-6-она с 1-амино-2-фенилазиридином. Обработка фенилазиридинилгидразона 0,3 эквивалентами LDA в эфире привела к образованию алкена, показанного ниже, с соотношением цис : транс 99,4:0,6. Соотношение определяли методом капиллярной ГЖХ после преобразования в соответствующие эпоксиды с помощью mCPBA. Загрузка катализатора может быть снижена до 0,05 эквивалента в случае реакции в масштабе 30 ммоль.
Высокая стереоселективность достигается за счет преимущественного отделения альфа-метиленового гидросинсина до фенилазиридина, а также объясняется внутренним хелатированием литированного промежуточного соединения. [11]

Комбинированная реакция Шапиро-Сузуки в одном горшке in situ.
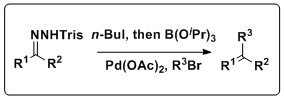
[ редактировать ]Реакцию Шапиро также можно объединить с реакцией Сузуки для получения различных олефиновых продуктов. Кей и его коллеги разработали методологию, которая объединяет эти реакции в одном процессе, который не требует выделения бороновой кислоты , что является недостатком традиционного соединения Suzuki. Эта реакция имеет широкую сферу применения, допуская множество трисилгидразонов и арилгалогенидов, а также несколько растворителей и источников Pd. [12]
Применение реакции Шапиро в полном синтезе
[ редактировать ]Реакция Шапиро использовалась для получения олефинов и получения сложных натуральных продуктов. К. Мори с сотрудниками стремились определить абсолютную конфигурацию группы фитокассанов класса натуральных продуктов, называемых фитоалексинами . Это было достигнуто путем получения встречающегося в природе (–)-фитокассан D из ( R ) -кетона Виланда-Мишера . На пути к (–)-фитокассану D трициклический кетон подвергали воздействию условий реакции Шапиро с получением циклического алкенового продукта. [13]

См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Шапиро, Р.Х. ; Липтон, МФ; Колонко, К.Дж.; Басвелл, РЛ; Капуано, Луизиана (1975). «Тозилгидразоны и алкиллитиевые реагенты: больше о региоспецифичности реакции и улавливании трех промежуточных продуктов». Тетраэдр Летт. 16 (22–23): 1811–1814. дои : 10.1016/S0040-4039(00)75263-4 .
- ^ Шапиро, Роберт Х. (1976). «Алкены из тозилгидразонов». Орг. Реагировать. 23 (3): 405–507. дои : 10.1002/0471264180.или 023.03 . ISBN 978-0471264187 .
- ^ Адлингтон, Роберт М.; Баррет, Энтони GM (1983). «Недавние применения реакции Шапиро». Акк. хим. Рез. 16 (2): 55–59. дои : 10.1021/ar00086a004 .
- ^ Шапиро, Роберт Х .; Хит, Марша Дж. (1967). «Тозилгидразоны. V. Реакция тозилгидразонов с алкиллитиевыми реагентами. Синтез новых олефинов». Дж. Ам. хим. Соц. 89 (22): 5734–5735. дои : 10.1021/ja00998a601 .
- ^ Николау, Кириакос К .; Соренсен, Эрик Дж. (1996). Классика тотального синтеза: цели, стратегии, методы . Уайли . ISBN 9783527292318 .
- ^ Фридман, Лестер; Литтл, Роберт Л.; Райхле, Уолтер Р. (1960). « п -толуолсульфонилгидразид» . Органические синтезы . 40:93 ; Сборник томов , т. 5, с. 1055 .
- ^ Лу, Пинг. Промежуточная органическая химия - реакции и механизмы [ Промежуточная органическая химия - реакции и механизмы ] (на китайском языке) (2-е изд., ISBN ). 978-7-04-058063-1 .
- ^ Шапиро, Р.Х. ; Дункан, Дж. Х. (1971). «2-борнен (1,7,7-триметилбицикло[2.2.1]гепт-2-ен)» . Органические синтезы . 51 : 66. дои : 10.15227/orgsyn.051.0066 ; Сборник томов , т. 6 .
- ^ Чемберлин, А. Ричард; Лиотта, Эллен Л.; Бонд, Ф. Томас (1983). «Получение и реакции алкениллитиевых реагентов: 2-бутилборнен» . Органические синтезы . 61 : 141. дои : 10.15227/orgsyn.061.0141 ; Сборник томов , т. 7, с. 77 .
- ^ Чемберлин, А. Ричард; Блум, Стивен Х. (1990). «Литиоалкены из аренсульфонилгидразонов». Орг. Реагировать. 39 (1): 1–83. дои : 10.1002/0471264180.или039.01 .
- ^ Маруока, Кейджи; Оиси, Масатака; Ямамото, Хисаши (1991). «Каталитическая реакция Шапиро». Дж. Ам. хим. Соц. 118 (9): 2289–2290. дои : 10.1021/ja951422p .
- ^ Пассафаро, Марко С.; Кей, Брайан А. (1996). в одном горшке in situ « Комбинированная реакция Шапиро-Сузуки ». Тетраэдр Летт. 37 (4): 429–432. дои : 10.1016/0040-4039(95)02210-4 .
- ^ Ядзима, Арата; Мори, Кендзи (2000). «Синтез и абсолютная конфигурация (–)-фитокассана D, дитерпенового фитоалексина, выделенного из растения риса Oryza sativa ». Евро. Дж. Орг. хим. 2000 (24): 4079–4091. doi : 10.1002/1099-0690(200012)2000:24<4079::AID-EJOC4079>3.0.CO;2-R .