Каскадная реакция

Каскадная реакция , также известная как реакция домино или тандемная реакция , представляет собой химический процесс, который включает как минимум две последовательные реакции, причем каждая последующая реакция происходит только благодаря химической функциональности, образовавшейся на предыдущем этапе. [1] В каскадных реакциях выделение промежуточных продуктов не требуется, так как каждая реакция, составляющая последовательность, происходит спонтанно. В самом строгом определении этого термина условия реакции не меняются на последовательных стадиях каскада, и после начальной стадии не добавляются новые реагенты. [1] [2] Напротив, процедуры в одном реакторе аналогичным образом позволяют проводить по крайней мере две реакции последовательно без какого-либо выделения промежуточных продуктов, но не исключают добавления новых реагентов или изменения условий после первой реакции. Таким образом, любая каскадная реакция также является однореакторной процедурой, а обратное неверно. [1] Хотя каскадные реакции часто состоят исключительно из внутримолекулярных превращений, они могут протекать и межмолекулярно, и в этом случае они также подпадают под категорию многокомпонентных реакций . [3]
Основные преимущества каскадных последовательностей включают высокую экономию атомов и сокращение отходов, образующихся в результате нескольких химических процессов, а также времени и труда, необходимых для их проведения. [1] [3] [4] Эффективность и полезность каскадной реакции можно измерить с точки зрения количества связей, образующихся в общей последовательности, степени увеличения структурной сложности в результате процесса и ее применимости к более широким классам субстратов. [2] [5]
Самым ранним примером каскадной реакции, возможно, является синтез тропинона, о котором сообщил Робинсон в 1917 году . [6] С тех пор использование каскадных реакций получило широкое распространение в области полного синтеза. Аналогичным образом, развитие каскадной органической методологии также значительно выросло. Этот возросший интерес к каскадным последовательностям отражен в многочисленных соответствующих обзорных статьях, опубликованных за последние пару десятилетий. [1] [2] [3] [4] [5] [7] [8] [9] [10] Растущей областью внимания является развитие асимметричного катализа каскадных процессов с использованием хиральных органокатализаторов или хиральных комплексов переходных металлов. [3] [7] [10] [11]
Классификация каскадных реакций иногда затруднена из-за разнообразия многих стадий превращения. К.С. Николау называет каскады нуклеофильными/электрофильными, радикальными, перициклическими или катализируемыми переходными металлами, в зависимости от механизма участвующих стадий. В тех случаях, когда в каскад включены два или более классов реакций, различие становится довольно произвольным, и процесс маркируется в соответствии с тем, что можно смело считать «основной темой». [4] Чтобы подчеркнуть замечательную синтетическую полезность каскадных реакций, большинство приведенных ниже примеров взято из полного синтеза сложных молекул.
Нуклеофильные/электрофильные каскады
[ редактировать ]Нуклеофильные/электрофильные каскады определяются как каскадные последовательности, в которых ключевым этапом является нуклеофильная или электрофильная атака. [4]
Пример такого каскада можно увидеть в коротком энантиоселективном синтезе антибиотика широкого спектра действия (-)-хлорамфеникола, о котором сообщили Rao et al. (Схема 1). [3] [12] Здесь хиральный эпоксидный спирт 1 сначала обрабатывали дихлорацетонитрилом в присутствии NaH. Полученный промежуточный продукт 2 затем подвергался каскадной реакции, опосредованной BF 3 ·Et 2 O. Внутримолекулярное раскрытие эпоксидного кольца дало интермедиат 3 , который после гидролиза in situ , облегченного избытком BF 3 ·Et 2 O, дал (–)-хлорамфеникол ( 4 ) с общим выходом 71%. [3] [12]

Нуклеофильный каскад был также использован при полном синтезе природного продукта пенталенена (схема 2). [4] [13] В этой методике квадратный эфир 5 обрабатывали (5-метилциклопент-1-ен-1-ил)литием и пропиниллитием . Две нуклеофильные атаки происходили преимущественно при транс- присоединении с образованием промежуточного соединения 6 , которое самопроизвольно претерпело 4π-конротационное электроциклическое раскрытие циклобутенового кольца. Полученные конъюгированные частицы 7 уравновешиваются конформером 8 , который легче подвергается 8π-конротаторной электроциклизации с образованием высоконапряженного интермедиата 9 . Потенциал высвобождения штамма, направленного на протонирование 9, так что вид 10 был получен выборочно. Каскад завершился внутримолекулярной альдольной конденсацией, в результате которой был получен продукт 11 с общим выходом 76%. Дальнейшая разработка позволила получить целевой (±)-пенталенен ( 12 ). [4] [13]

Органокаталитические каскады
[ редактировать ]Подкатегория нуклеофильных/электрофильных последовательностей состоит из органокаталитических каскадов, в которых ключевая нуклеофильная атака осуществляется за счет органокатализа.
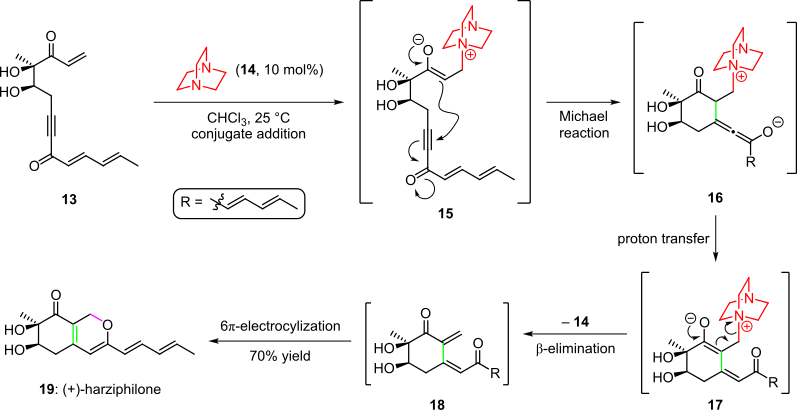
Органокаталитический каскад был использован при полном синтезе природного продукта гарзифилона, о чем сообщили Sorensen et al. в 2004 г. (схема 3). [4] [14] Здесь обработка енонового исходного материала 13 органокатализатором 14 дала промежуточное соединение 15 посредством добавления конъюгата. Последующая циклизация путем внутримолекулярного присоединения енолята по Михаэлю к тройной связи системы дала разновидность 16 , которая давала промежуточное соединение 17 после переноса протона и таутомеризации. Каскад завершился удалением органокатализатора и спонтанным замыканием 6π-электроциклического кольца полученного цис -диенона 18 в (+)-гарзифилон ( 19 ) с общим выходом 70%. [4] [14]
О выдающемся тройном органокаталитическом каскаде сообщили Raabe et al. в 2006 году. Линейные альдегиды ( 20 ), нитроалкены ( 21 ) и α , β -ненасыщенные альдегиды ( 22 ) могут быть конденсированы вместе органокаталитически с получением тетразамещенных циклогексанкарбальдегидов ( 24 ) с диастереоселективностью от умеренной до превосходной и полным энантиоконтролем (схема 4). . Трансформация опосредована легкодоступным органокатализатором, производным пролина 23 . [15]

Было предложено, чтобы трансформация происходила через последовательность присоединения Михаэля/присоединения Михаэля/альдольной конденсации.(Схема 5). [15] На первом этапе присоединение альдегида 20 к нитроалкену 21 по Михаэлю происходит посредством енаминового катализа, в результате чего образуется нитроалкан 25 . Конденсация α , β -ненасыщенного альдегида 22 с органокатализатором затем облегчает конъюгатное присоединение 25 с образованием промежуточного енамина 26 ,который склонен подвергаться внутримолекулярной альдольной конденсации с образованием иминия 27 . Органокатализатор 23 регенерируется гидролизом вместе с продуктом 24 , замыкая тройной каскадный цикл. [15]

Радикальные каскады
[ редактировать ]Радикальные каскады — это те, в которых ключевым этапом является радикальная реакция. Высокая реакционная способность свободных радикаловвиды делают радикальные синтетические подходы явно подходящими для каскадных реакций. [4]
Одним из наиболее широко признанных примеров синтетической полезности радикальных каскадов является циклизация.последовательность, использованная при полном синтезе (±)-гирсутена в 1985 г. (схема 6). [4] [16] Здесь алкилйодид 28 был превращен в первичное радикальное промежуточное соединение 29 , которое подверглось 5- экзо -триг-циклизации с образованием реакционноспособных частиц 30 . Последующая 5- exo- dig радикальная циклизация привела к промежуточному соединению 31 , которое после гашения дало целевой (±)-гирсутен ( 32 ) с общим выходом 80%. [4] [16]

Каскадно-радикальный процесс был использован и в одном из тотальных синтезов (–)-морфина (схема 7). [4] [17] [18] Арилбромид 33 был превращен в соответствующую радикальную группу 34 обработкой гидридом три -н -бутилолова. Затем произошла 5- экзо -триг-циклизация с стереоселективным образованием промежуточного соединения 35 в силу стереохимии эфирной связи. На следующем этапе каскада геометрические ограничения 35 запрещают кинетически предпочтительный 5- экзо путь циклизации -триг; вместо этого вторичные бензильные радикалы 36 были получены с помощьюгеометрически разрешенная 6- эндо -триг-циклизация. Последующее удаление фенилсульфинильного радикала далопродукт 37 с общим выходом 30%, который в дальнейшем был преобразован в (–)-морфин ( 38 ). [4] [17] [18]

Перициклические каскады
[ редактировать ]Перициклические реакции, возможно, наиболее широко встречающийся вид процесса каскадных превращений, включают в себяциклоприсоединения, электроциклические реакции и сигматропные перегруппировки. [4] Хотя некоторые из вышеупомянутых случаев нуклеофильных/электрофильных и радикальных каскадов включают перициклические процессы, этот раздел содержит только каскадные последовательности, которые состоят исключительно из перициклических реакций или в которых такая реакция, возможно, представляет собой ключевую стадию.
Типичным примером перициклического каскада является каскад эндиандровой кислоты, о котором сообщили Николау и др. в 1982 г. (схема 8). [4] [19] Здесь высоконенасыщенная система 39 сначала была гидрирована до сопряженных тетраеновых разновидностей 40 , которые при нагревании претерпели 8π-конвертирующее электроциклическое замыкание кольца, давая циклическое промежуточное соединение 41 . Вторая спонтанная электроциклизация, на этот раз 6π-дисротаторное замыкание кольца, превратила 41 в бициклические соединения 42 , геометрия и стереохимия которых благоприятствовали последующей внутримолекулярной реакции Дильса-Альдера. метиловый эфир эндиандровой кислоты B ( 43 ) с общим выходом 23%. Таким образом, получали [4] [19]

Перициклическая последовательность, включающая внутримолекулярные реакции гетероциклоприсоединения, была использована для полного синтеза встречающегося в природе алкалоида (–)-виндорозина (схема 9). [4] [20] Быстрый доступ кЦель была достигнута из раствора 1,3,4-оксадиазола 44 в триизопропилбензоле, подвергнутого воздействию высоких температур и пониженного давления. Сначала гетеро-реакция Дильса-Альдера с обратным электронным спросом.произошло, чтобы дать промежуточное 45 . Термодинамически благоприятная потеря азота приводит к появлению 1,3-дипольсодержащих частиц 46 . Спонтанное внутримолекулярное [3+2]-циклоприсоединение 1,3-диполя и индола.затем система образовала эндо -продукт 47 с общим выходом 78%. Дальнейшая разработка дала целевой натуральный продукт 48 . [4] [20]

Полный синтез (-)-коломбиазина А, о котором сообщила в 2005 г. группа Харроувена, включал электроциклический каскад (схема 10). [4] [21] Под воздействием тепла микроволновым излучением производное квадрата 49 претерпело электроциклическое раскрытие циклобутенового кольца с последующим замыканием 6π-электроциклического кольца, что привело к образованию бициклического промежуточного соединения 51 . Его таутомеризация дала ароматические соединения 52 , которые при воздействии воздуха окислялись до продукта 53 с общим выходом 80%. Целевой (–)-коломбиазин А ( 54 ) затем получали из 53 посредством реакции Дильса-Альдера при нагревании с последующим расщеплением трет -бутила.защитная группа. [4] [21]

Некоторые [2,2]парациклофаны также могут быть получены с помощью перициклических каскадов, как сообщила группа Хопфа в 1981 г. (схема 11). [1] [22] В этой последовательности реакция Дильса-Альдера между 1,2,4,5-гексатетраеном 55 и диенофил 56 сначала образовал высокореакционноспособный интермедиат 57 , который впоследствии димеризовалсяс образованием [2,2]парациклофана 58 . [1] [22]
![Схема 11. Перициклическая последовательность синтеза [2,2]парациклофана.](http://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Scheme_11_-_peri_-_pcyclophane.svg/681px-Scheme_11_-_peri_-_pcyclophane.svg.png)
Каскады, катализируемые переходными металлами
[ редактировать ]Каскадные последовательности, катализируемые переходными металлами, сочетают в себе новизну и мощь металлоорганической химии.с синтетической полезностью и экономичностью каскадных реакций, обеспечивая еще более экологически и экономически желательный подход к органическому синтезу. [4]
Например, родиевый катализ был использован для превращения ациклических монотерпенов типа 59 в продукты 4 H -хромена в каскаде гидроформилирования (схема 12). [8] [23] Во-первых, селективное катализируемое родием гидроформилирование менее стерически затрудненной олефиновой связи в 59 привело к образованию ненасыщенного альдегида 60 , который в тех же условиях затем был превращен в интермедиат 61 посредством карбонильно-еновой реакции. За вторым катализируемым родием гидроформилированием до соединения 62 следовала конденсация с образованием продуктов 4 H -хромена типа 63 с общим выходом 40%. [8] [23]

Родиевый катализ также использовался для инициирования каскада циклизации/циклоприсоединения в синтезе тиглиана, о котором сообщила группа Даубена (схема 13). [2] [24] Обработка диазоимида 64 димером ацетата родия(II) привела к образованию карбеноида, который дает реакционноспособный илид 65 после внутримолекулярной циклизации с соседней карбонильной группой . Затем спонтанно происходит внутримолекулярное [3+2] циклоприсоединение, приводящее к образованию целевого тиглиана 66 . [2] [24]

формальное внутримолекулярное [4+2]-циклоприсоединение 1,6-енинов типа 67, опосредованное катализом золота (схема 14). Другим примером каскада, катализируемого переходными металлами, является [25] [26] Различные 1,6-еныны реагируют в мягких условиях в присутствии комплексов Au(I) 68a – b с образованием трициклических продуктов 69 с выходами от умеренных до превосходных. [25] [26]
![Схема 14. Катализируемое золотом формальное внутримолекулярное [4+2]-циклоприсоединение 1,6-енинов.](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2b/Scheme_14_-_metal_-_gold_enyne.svg/481px-Scheme_14_-_metal_-_gold_enyne.svg.png)
Было предложено протекать это формальное циклоприсоединение посредством каскадного процесса, показанного на схеме 15. [25] [26] Комплексообразование 1,6-енина 67 с катионной формой катализатора дает промежуточное соединение 70 , в котором активированная тройная связь подвергается атаке олефиновой функциональной группы с образованием замещенного циклопропана 71 . Электрофильное раскрытие трехчленного кольца образует катионные частицы 72 , которые подвергаются реакции типа Фриделя Крафтса и затем реароматизируются с образованием трициклического продукта 69 . [25] [26] Благодаря характеру взаимодействия комплексов золота с ненасыщенными системами этот процесс также можно рассматривать как электрофильный каскад.
![Схема 15. Предполагаемый каскадный процесс формального внутримолекулярного [4+2]-циклоприсоединения 1,6-енинов.](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Scheme_15_-_metal_-_gold_enyne_mech.svg/751px-Scheme_15_-_metal_-_gold_enyne_mech.svg.png)
Примером катализируемых палладием каскадов является асимметричная полиеновая циклизация Хека, используемая при получении (+)-ксестохинона из трифлатного субстрата 75 (схема 16). [4] [27] Окислительное присоединение арил-трифлатной связи к комплексу палладия(0) в присутствии хирального дифосфинового лиганда ( S )-бинап приводит к образованию хирального комплекса палладия(II) 77 . За этой стадией следует диссоциация трифлат-аниона, ассоциация соседнего олефина и 1,2-внедрение нафтильной группы в олефин с образованием промежуточного продукта 79 . Затем происходит второе мигрирующее внедрение в оставшуюся олефиновую группу с последующим β -элиминированием, в результате чего образуется продукт 81 с общим выходом 82% и умеренной энантиоселективностью. На этом этапе также регенерируется палладиевый катализатор (0), что позволяет повторно инициировать каскад. [4] [27]

Многоступенчатые тандемные реакции
[ редактировать ]Многостадийные тандемные реакции (или каскадные реакции) представляют собой последовательность химических превращений (обычно более двух стадий), которые происходят последовательно и превращают исходное вещество в сложный продукт. [28] Этот тип органических реакций предназначен для создания сложных структур, встречающихся при природных продуктов полном синтезе .
При тотальном синтезе спирокетального ионофорного антибиотика рутиенноцина 1 (рис. 1) центральный спирокетальный скелет был построен с помощью многостадийной тандемной реакции (рис. 2). [29] Фрагмент A и фрагмент B были соединены за одну стадию с образованием ключевого промежуточного продукта G, который можно было в дальнейшем перерабатывать с получением конечного продукта рутиенноцина.

В этой тандемной реакции произошли четыре химических превращения. Во-первых, обработка фрагмента A н-бутиллитием привела к образованию углеродного аниона, который атаковал алкилиодидную часть фрагмента B с образованием промежуточного соединения C (стадия 1). Затем производное 3,4-дигидропирана D образовывалось посредством реакции отщепления промежуточного соединения C (стадия 2). Защитную группу 1,3- диольного фрагмента в промежуточном продукте D удалили кислотной обработкой с получением диольного продукта E (стадия 3). Спирокетальный продукт G был получен посредством реакции внутримолекулярного образования кеталя . Эта многостадийная тандемная реакция значительно упростила построение этой сложной спирокетальной структуры и облегчила путь к полному синтезу рутиенноцина.

Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час Титце, LF; Бейфусс, У. Энджью. хим. Межд. Эд. 1993 , 32 , 131–163.
- ^ Перейти обратно: а б с д и ж Падва, А.; Бур, С.К. Тетраэдр 2007 , 63 , 5341–5378.
- ^ Перейти обратно: а б с д и ж г Пеллиссье, Х. Тетраэдр 2006 , 62 , 1619–1665.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но Николау, КЦ; Эдмондс, диджей; Балджер, П.Г. Энджью. хим. Межд. Эд. 2006 , 45 , 7134–7186.
- ^ Перейти обратно: а б Титце, LF Chem. Замри. 1996 , 96 , 115–136.
- ^ Робинсон, RJ Chem. Соц. Пер. 1917 , 111 , 762.
- ^ Перейти обратно: а б Пеллиссье, Х. Тетраэдр 2006 , 62 , 2143–2173.
- ^ Перейти обратно: а б с д Василке, JC; Обри, С.Дж.; Бейкер, RT; Базан, GC Chem. Ред. 2005 г. , 105 , 1001–1020.
- ^ Чепмен, К.; Фрост, К. Синтез (Штутг). 2007 , 2007 , 1–21.
- ^ Перейти обратно: а б Эндерс, Д.; Грондал, К.; Хюттль, MRM Angew. хим. Межд. Эд. 2007 , 46 , 1570–1581.
- ^ Grondal, C.; Jeanty, M.; Enders, D. Nat. Chem. 2010 , 2 , 167–178.
- ^ Перейти обратно: а б Бхаскар, Г.; Сатиш Кумар, В.;Венкатешвара Рао, Б. Тетраэдр: Асимметрия 2004 , 15 , 1279–1283.
- ^ Перейти обратно: а б Пакетт, Луизиана; Гэн, Ф. Орг. Летт. 2002 , 4 , 4547–4549.
- ^ Перейти обратно: а б Старк, Л.М.; Пекари, К.; Соренсен, EJ Proc. Натл. акад. наук. США 2004 , 101 , 12064–12066.
- ^ Перейти обратно: а б с д и Эндерс, Д.; Хюттль, MRM; Грондал, К.; Раабе, Г. Природа 2006 , 441 , 861–863.
- ^ Перейти обратно: а б Карран, ДП; Чен, М.-Х. Тетраэдр Летт . 1985 , 26 , 4991–4994.
- ^ Перейти обратно: а б Parker, K. A.; Fokas, D. J. Am. Chem. Soc. 1992 , 114 , 9688–9689 .
- ^ Перейти обратно: а б Parker, K. A.; Fokas, D. J. Org. Chem . 2006 , 71 , 449–455 .
- ^ Перейти обратно: а б Николау, КЦ; Петасис, Н.А.; Зипкин Р.Э.; Уэниши, JJ Am. хим. Соц. 1982 , 104 , 5555–5557.
- ^ Перейти обратно: а б Эллиотт, солдат; Велчицкий, Дж.; Исикава, Х.; Ли, Ю.; Богер, Д.Л. Энджью. хим. Межд. Эд. 2006 , 45 , 620–622.
- ^ Перейти обратно: а б Харроувен, округ Колумбия; Паско, Д.Д.; Демуртас, Д.; Борн, Х.О. Энджью. хим. Межд. Эд. 2005 , 44 , 1221–1222.
- ^ Перейти обратно: а б Хопф, Х.; Бом, И.; Кляйншрот, J. Org. Синтез. 1981 , 60 , 41.
- ^ Перейти обратно: а б Роггенбак, Р.; Эйлбрахт, П. Тетраэдр Летт . 1999 , 40 , 7455–7456 .
- ^ Перейти обратно: а б Даубен, В.Г.; Дингес, Дж.; Смит, TC J. Org. хим. 1993 , 58 , 7635–7637.
- ^ Перейти обратно: а б с д и ж Хименес-Нуньес, Э.; Эчаваррен, AM Chem. Замри. 2008 , 108 , 3326.
- ^ Перейти обратно: а б с д Ньето-Оберхубер, Дж.; Лопес, С.; Эчаваррен, AM J. Am. хим. Соц. 2005 , 127 , 6178–6179.
- ^ Перейти обратно: а б Мэддафорд, СП; Андерсен, Н.Г.; Кристофоли, Вашингтон; Кей, B.A.J. Am. хим. Соц. 1996 , 118 ,10766–10773.
- ^ Николау, KC; Эдмондс, Дэвид Дж.; Балджер, Пол Дж. Энджью. хим. Межд. Эд. 2006, 45, 7134-7186.
- ^ Дьес-Мартин, Д. Котеча, NR; Ли, СВ; Мантегани, С.; Менендес, Джей Джей; Орган, HM; Уайт, А.Д., Тетраэдр, 1992, 48, 1899–7938.
Внешние ссылки
[ редактировать ]- Химические узлы в периодической таблице видео (Ноттингемский университет)