Tropinone
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 8-Метил-8-азабицикло[3.2.1]октан-3-он | |
| Другие имена 3-Tropinone | |
| Идентификаторы | |
3D model ( JSmol ) | |
| КЭБ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.007.756 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 8 Ч 13 НЕТ | |
| Молярная масса | 139.195 g/mol |
| Появление | Коричневый твердый |
| Температура плавления | 42,5 ° C (108,5 ° F; 315,6 К) |
| Точка кипения | (разлагается) |
| Опасности | |
| СГС Маркировка : | |
  [1] [1] | |
| Опасность | |
| Х302 , Х314 [1] | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Тропинон – алкалоид , синтезированный в 1917 году Робертом Робинсоном как синтетический предшественник атропина , дефицитного товара во время Первой мировой войны . [2] [3] Тропинон и алкалоиды кокаин и атропин имеют одинаковую структуру ядра тропана . Соответствующая ему сопряженная кислота с pH 7,3 основных видов известна как тропиниумон. [4]
Синтез
[ редактировать ]Первый синтез тропинона был осуществлен Рихардом Вильштеттером в 1901 году. Он начался с, казалось бы, родственного циклогептанона , но потребовалось много шагов для введения азотистого мостика; общий выход по пути синтеза составляет всего 0,75%. [5] Вильштеттер ранее синтезировал кокаин из тропинона, что было первым синтезом и выяснением структуры кокаина. [6]

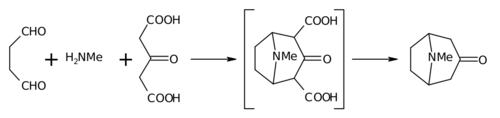
Реакция Робинсона «двойного Манниха».
[ редактировать ]Синтез Робинсона 1917 года считается классикой тотального синтеза. [8] благодаря своей простоте и биомиметическому подходу. Тропинон представляет собой бициклическую молекулу , но реактивы, используемые при его получении, довольно простые: сукцинальдегид , метиламин и ацетондикарбоновая кислота (или даже ацетон ). Синтез является хорошим примером биомиметической реакции или синтеза биогенетического типа, поскольку в биосинтезе используются одни и те же строительные блоки. Он также демонстрирует тандемную реакцию при синтезе в одном реакторе . При этом выход синтеза составил 17% и при последующих усовершенствованиях превысил 90%. [5]
Эту реакцию по очевидным причинам называют внутримолекулярной «двойной реакцией Манниха ». В этом отношении он не уникален, поскольку другие также пытались использовать его в синтезе пиперидина. [9] [10]
Вместо ацетона ацетондикарбоновая кислота известна как « синтетический эквивалент ». Группы 1,3-дикарбоновой кислоты являются так называемыми « активирующими группами », облегчающими реакции образования кольца. Соль кальция используется в качестве « буфера », поскольку утверждается, что более высокие выходы возможны, если реакцию проводить при « физиологическом pH ».
Механизм реакции
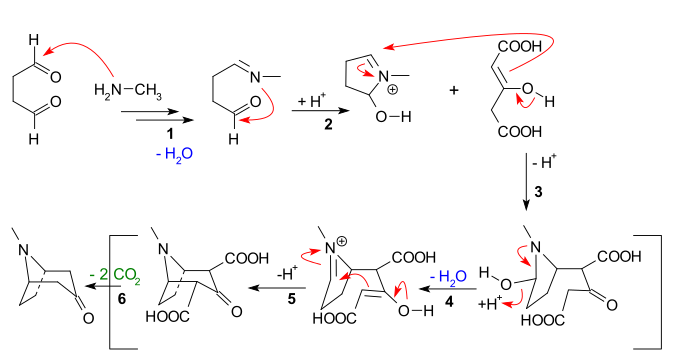
[ редактировать ]Основные особенности, очевидные из приведенной ниже последовательности реакций, следующие:
- Нуклеофильное присоединение метиламина сукцинальдегиду к . с последующей потерей воды с образованием имина
- Внутримолекулярное присоединение имина ко второму альдегидному звену и замыкание первого кольца.
- Межмолекулярная реакция Манниха енолята дикарбоксилата ацетона
- Образование нового енолята и образование нового имина с потерей воды для
- Вторая внутримолекулярная реакция Манниха и замыкание второго кольца
- Потеря 2 карбоксильных групп из-за тропинона.
Некоторые авторы действительно пытались сохранить одну из групп CO 2 H. [11]
CO 2 R-тропинон имеет 4 стереоизомера, хотя соответствующий алкиловый эфир экгонидина имеет только пару энантиомеров.
Из циклогептанона
[ редактировать ](суберона) IBX Дегидрирование (окисление) циклогептанона до 2,6-циклогептадиенона [1192-93-4] с последующей реакцией с амином является универсальным способом образования тропинонов. [12] [13] Вызванный механизм четко очерчен как двойная реакция Михаэля (т.е. сопряженное присоединение).
Биохимический метод
[ редактировать ]Этот раздел пуст. Вы можете помочь, добавив к нему . ( апрель 2022 г. ) |
Снижение тропинона
[ редактировать ]Восстановление тропинона опосредуется НАДФН -зависимыми ферментами редуктазой, которые были охарактеризованы у многих видов растений. [15] Все эти виды растений содержат два типа ферментов редуктазы: тропинонредуктазу I и тропинонредуктазу II. TRI производит тропин, а TRII производит псевдотропин. Из-за различных кинетических характеристик и характеристик pH/активности ферментов, а также из-за 25-кратной более высокой активности TRI по сравнению с TRII, большая часть восстановления тропинона происходит из TRI с образованием тропина. [16]

См. также
[ редактировать ]- Бензтропин
- дурман
- 2-Карбометокситропинон (2-СМТ) промежуточный продукт при создании аналогов экгонина кокаина .
- Экгонидин
Ссылки
[ редактировать ]- ^ Jump up to: а б «Тропинон» . Информация о веществе . ЭХА.
- ^ Робинсон Р. (1917). «LXIII. Синтез тропинона» . Журнал Химического общества, Сделки . 111 : 762–768. дои : 10.1039/CT9171100762 .
- ^ Николау К.К. , Вурлумис Д., Винсингер Н., Баран П.С. (2000). «Искусство и наука тотального синтеза на заре двадцать первого века». Angewandte Chemie, международное издание . 39 (1): 44–122. doi : 10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L . ПМИД 10649349 .
- ^ Химические соединения, представляющие биологический интерес. Идентификационный код: ChEBI: 57851 «тропиниумон».
- ^ Jump up to: а б Смит В.А., Смит В.А., Бочков А.Ф., Кейпл Р. (1998). Органический синтез . дои : 10.1039/9781847551573 . ISBN 978-0-85404-544-0 .
- ^ Хамфри Эй.Дж., О'Хаган Д. (2001). «Биосинтез тропановых алкалоидов. Нерешенная проблема вековой давности». Отчеты о натуральных продуктах . 18 (5). Королевское химическое общество : 494–502. дои : 10.1039/b001713m . ПМИД 11699882 .
- ^ Добле М, Крутивенти АК (2007). Зеленая химия и инженерия . Оксфорд: Эльзевир. п. 34. ISBN 978-0-12-372532-5 .
- ^ Берч Эй Джей (1993). «Исследование научной легенды: синтез тропинона сэра Роберта Робинсона, FRS». Заметки и отчеты Лондонского королевского общества . 47 (2): 277–296. дои : 10.1098/rsnr.1993.0034 . JSTOR 531792 . S2CID 143267467 .
- ^ Ван С., Сакамури С., Эньеди И.Дж., Козиковски А.П., Дешо О., Бандиопадьяй Б.К., Телла С.Р., Заман В.А., Джонсон К.М. (2000). «Открытие нового ингибитора переносчика дофамина, 4-гидрокси-1-метил-4-(4-метилфенил)-3-пиперидил-4-метилфенилкетона, в качестве потенциального антагониста кокаина посредством поиска фармакофора в 3D-базе данных. Молекулярное моделирование, структура- отношения активности и поведенческие фармакологические исследования». Журнал медицинской химии . 43 (3): 351–360. дои : 10.1021/jm990516x . ПМИД 10669562 .
- ^ Ван С., Сакамури, Эньеди, Козиковски, Заман, Джонсон (2001). «Молекулярное моделирование, взаимосвязи структура-активность и исследования функционального антагонизма 4-гидрокси-1-метил-4-(4-метилфенил)-3-пиперидил-4-метилфенилкетонов как нового класса ингибиторов переносчика дофамина». Биоорганическая и медицинская химия . 9 (7): 1753–1764. дои : 10.1016/S0968-0896(01)00090-6 . ПМИД 11425577 .
- ^ Финдли С.П. (1957). «Относительно 2-карбометокситропинона». Журнал органической химии . 22 (11): 1385–1394. дои : 10.1021/jo01362a022 .
- ^ Патент США 8 609 690.
- ^ Николау К.К., Монтаньон Т., Баран П.С., Чжун Ю.Л. (2002). «Реагенты йода (V) в органическом синтезе. Часть 4. О-йодоксибензойная кислота как хемоспецифический инструмент для процессов окисления, основанных на переносе одного электрона». Журнал Американского химического общества . 124 (10): 2245–58. дои : 10.1021/ja012127+ . ПМИД 11878978 .
- ^ Бедевиц М.А., Джонс А.Д., Д'Аурия Дж.К., Барри К.С. (2018). «Синтез тропинона посредством атипичной поликетидсинтазы и циклизации, опосредованной P450» . Природные коммуникации . 9 (1): 5281. Бибкод : 2018NatCo...9.5281B . дои : 10.1038/s41467-018-07671-3 . ISSN 2041-1723 . ПМК 6290073 . ПМИД 30538251 .
- ^ А. Портстеффен, Б. Дрегер, А. Нарстедт (1992). «Два тропинонвосстанавливающих фермента из корневых культур Datura stramonium, трансформированных». Фитохимия . 31 (4): 1135. Бибкод : 1992PChem..31.1135P . дои : 10.1016/0031-9422(92)80247-C .
- ^ Босвелл Х.Д., Дрегер Б., Маклаухлан В.Р. и др. (ноябрь 1999 г.). «Особенности ферментов биосинтеза N -алкилтропана у бругмансии и дурмана». Фитохимия . 52 (5): 871–8. Бибкод : 1999PChem..52..871B . дои : 10.1016/S0031-9422(99)00293-9 . ПМИД 10626376 .