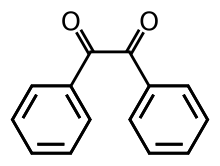
Бензил
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Дифенилэтандион | |
| Систематическое название ИЮПАК 1,2-Дифенилэтан-1,2-дион | |
| Другие имена Дифенилэтан-1,2-дион Бензил Дибензоил Бибензоил Дифенилглиоксаль | |
| Идентификаторы | |
3D model ( JSmol ) | |
| 608047 | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.004.689 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 14 Н 10 О 2 | |
| Молярная масса | 210.232 g·mol −1 |
| Появление | желтый кристаллический порошок |
| Плотность | 1,23 г/см 3 , твердый (1,255 г/см 3 , рентген) |
| Температура плавления | от 94,0 до 96,0°С; от 201,2 до 204,8 °F; от 367,1 до 369,2 К |
| Точка кипения | от 346,0 до 348,0 °С; от 654,8 до 658,4 °F; 619,1–621,1 К |
| нерастворимый | |
| Растворимость в этаноле | растворимый |
| Растворимость в диэтиловом эфире | растворимый |
| Растворимость в бензоле | растворимый |
| -118.6·10 −6 см 3 /моль | |
| Структура | |
| П3 1,2 21 [1] | |
| 3,8 Д [2] | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Раздражающий |
| СГС Маркировка : | |
 | |
| Предупреждение | |
| Х315 , Х319 , Х335 | |
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313, P337+P313 P362 , P403 , P301 , P403+P233 , P405, P5013 +P233, P405, P501, P501, P501 , , P362 , P403+P233, P3 | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | >3 г/кг (мышь, перорально) [3] |
| Родственные соединения | |
Родственные дикетоны | диацетил |
Родственные соединения | бензофенон глиоксаль бензил |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Бензил (т.е. Bz 2 , систематически известный как 1,2-дифенилэтан-1,2-дион) представляет собой органическое соединение с формулой ( C 6 H 5 CO ) 2 , обычно обозначаемое сокращенно ( Ph CO) 2 . Это желтое твердое вещество является одним из наиболее распространенных дикетонов . Его основное применение — в качестве фотоинициатора в химии полимеров . [4]
Структура
[ редактировать ]Наиболее примечательной структурной особенностью соединения является длинная углерод-углеродная связь размером 1,54 Å , что указывает на отсутствие пи-связи между двумя карбонильными центрами. Центры PhCO плоские, но пара бензоильных групп закручена относительно другой на двугранный угол 117°. [5] В менее затрудненных аналогах ( глиоксаль , биацетил , производные щавелевой кислоты ) группа (RCO) 2 принимает плоскую антиконформацию.
Приложения
[ редактировать ]использовать в качестве фотоинициатора при свободнорадикальном отверждении полимерных Большую часть бензила можно сеток. Он поглощает ультрафиолетовое излучение с длиной волны 260 нм, что приводит к разложению с образованием свободных радикалов и образованию поперечных связей внутри материала. Однако это относительно плохой фотоинициатор, и он используется редко. Он подвергается фотообесцвечиванию , что позволяет полимеризующему свету достигать более глубоких слоев материала при более длительном воздействии. [6] Производные ацеталя , такие как 2,2-диметокси-2-фенилацетофенон , обладают лучшими свойствами для этого применения. [6]
Бензил является мощным ингибитором человека карбоксилэстераз , ферментов, участвующих в гидролизе сложных карбоксильных эфиров, и многих клинически используемых лекарств. [7]
Реакции
[ редактировать ]Бензил является стандартным строительным блоком в органическом синтезе . Он конденсируется с аминами с образованием дикетиминовых лигандов. Классической органической реакцией бензила является перегруппировка бензиловой кислоты , при которой основание катализирует превращение бензила в бензиловую кислоту . Эта реактивность используется при приготовлении препарата фенитоин . Бензил также реагирует с 1,3-дифенилацетоном в результате альдольной конденсации с образованием тетрафенилциклопентадиенона .
Подготовка
[ редактировать ]Бензил получают из бензоина , например, с ацетатом меди(II) : [8]
- PhC(O)CH(OH)Ph + 2 Cu 2+ → PhC(O)C(O)Ph + 2 H + + 2 у.е. +
другие подходящие окислители, такие как азотная кислота (HNO 3 Обычно используются ).
Хлорид железа(III) (FeCl 3 ) можно использовать в качестве недорогого катализатора этого химического превращения. [9]
Ссылки
[ редактировать ]- ^ Acta Crystallogr. Б43 398 (1987)
- ^ Спектрохим. Акта А60 (8-9) 1805 (2004)
- ^ «Бензил» .
- ^ Хардо Сигел, Манфред Эггерсдорфер «Кетоны» в Энциклопедии промышленной химии Ульмана Wiley-VCH, 2002, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a15_077
- ^ Куанг. Шен, Кольбьерн. Хаген «Молекулярная структура газовой фазы и конформация бензила, определенная методом дифракции электронов» J. Phys. Chem., 1987, 91 (6), стр. 1357–1360. два : 10.1021/j100290a017 .
- ^ Jump up to: а б Грин, В. Артур (22 апреля 2010 г.). Промышленные фотоинициаторы: Техническое руководство . п. 31. ISBN 9781439827468 . Проверено 21 мая 2022 г.
- ^ Уодкинс. RM и др. «Идентификация и характеристика новых аналогов бензила (дифенилэтан-1,2-диона) как ингибиторов карбоксилэстераз млекопитающих. J. Med. Chem., 2005, 48, стр. 2906–15.
- ^ Депре, П.; Бетенье, Г.; Марсинкаль-Лефевр, А. (1988). «Синтез бензила из бензоина с ацетатом меди (II)». Журнал химического образования . 65 (6): 553. Бибкод : 1988ЖЧЭд..65..553Д . дои : 10.1021/ed065p553 .
- ^ Би, Сяосинь; Ву, Линтао; Ян, Чаого; Цзин, Сяоби; Чжу, Хунсян (2011). «Однореакторный синтез бензилов из альдегидов посредством NHC-катализируемой димеризации бензоина в безметалловых условиях в воде» . Журнал Чилийского химического общества . 56 (2): 663. doi : 10.4067/S0717-97072011000200008 .
