Глиоксаль
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК оксалдегид [1] | |||
| Систематическое название ИЮПАК Этанедиал [1] | |||
| Другие имена | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.003.160 | ||
| КЕГГ | |||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| С 2 Н 2 О 2 | |||
| Молярная масса | 58.036 g·mol −1 | ||
| Температура плавления | 15 ° C (59 ° F; 288 К) | ||
| Точка кипения | 51 ° С (124 ° F; 324 К) | ||
| Термохимия | |||
Теплоемкость ( С ) | 1,044 Дж/(К·г) | ||
| Опасности | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | −4 ° C (25 ° F; 269 К) | ||
| 285 ° С (545 ° F; 558 К) | |||
| Родственные соединения | |||
Родственные альдегиды | ацетальдегид гликольальдегид пропанедиальный метилглиоксаль | ||
Родственные соединения | глиоксиловая кислота гликолевая кислота щавелевая кислота пировиноградная кислота диацетил ацетилацетон | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
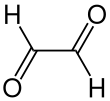
Глиоксаль — органическое соединение с химической формулой OCCHHO. Это наименьший диальдегид (соединение с двумя альдегидными группами). Это кристаллическое твердое вещество, белое при низких температурах и желтое при температуре плавления (15 ° C). Жидкость желтая, а пар зеленый. [2]
Чистый глиоксаль встречается нечасто, поскольку с глиоксалем обычно обращаются как с 40% водным раствором (плотность около 1,24 г/мл). Образует ряд гидратов , в том числе олигомеров . Для многих целей эти гидратированные олигомеры ведут себя так же, как глиоксаль. Глиоксаль производится в промышленных масштабах как предшественник многих продуктов. [3]
Производство
[ редактировать ]Глиоксаль был впервые получен и назван немецко-британским химиком Генрихом Дебусом (1824–1915) путем реакции этанола с азотной кислотой . [4] [5]
Технический глиоксаль получают либо газофазным окислением этиленгликоля (процесс Лапорта) , в присутствии серебряного или медного катализатора либо жидкофазным окислением ацетальдегида кислотой азотной . [3]
Первый коммерческий источник глиоксаля был открыт в Ламотте , Франция, в 1960 году. Самым крупным коммерческим источником является компания BASF в Людвигсхафене , Германия , с объемом производства около 60 000 тонн в год. Другие производственные площадки существуют также в США и Китае. Коммерческий глиоксаль производится в виде 40% раствора в воде по весу. [3] (молярное соотношение глиоксаля к воде примерно 1:5).
Лабораторные методы
[ редактировать ]Глиоксаль можно синтезировать в лаборатории окислением ацетальдегида . селенистой кислотой [6] или озонолизом бензола . [7]
Безводный глиоксаль получают путем нагревания твердого гидрата(ов) глиоксаля с пятиокисью фосфора и конденсации паров в холодной ловушке . [8]
Характеристики
[ редактировать ]Экспериментально определенная константа закона Генри для глиоксаля равна:
Биохимия
[ редактировать ]
Конечные продукты гликирования (AGE) — это белки или липиды, которые гликируются в результате диеты с высоким содержанием сахара. [10] Они являются биомаркерами, участвующими в старении и развитии или ухудшении многих дегенеративных заболеваний , таких как диабет , атеросклероз , хроническое заболевание почек и болезнь Альцгеймера . [11]
Гуаниновые основания в ДНК могут подвергаться неферментативному гликированию под действием глиоксаля с образованием аддуктов глиоксаль-гуанин. [12] Эти аддукты могут затем производить сшивки ДНК . Гликирование ДНК может также приводить к мутациям , разрывам ДНК и цитотоксичности . [13] У людей глиоксаль-гликированные нуклеотиды могут восстанавливаться с помощью белка DJ-1, также известного как Park7. [13]
Приложения
[ редактировать ]В мелованной бумаге и текстильной отделке используется большое количество глиоксаля в качестве сшивающего агента для составов на основе крахмала . Он конденсируется с мочевиной с образованием 4,5-дигидрокси-2-имидазолидинона, который далее реагирует с формальдегидом с образованием бис(гидроксиметил) производного диметилолэтиленмочевины , которое используется для химической обработки одежды, предотвращающей образование складок, то есть для перманентного прессования. [3]
Глиоксаль используется в качестве солюбилизатора и сшивающего агента в химии полимеров .
Глиоксаль является ценным строительным материалом в органическом синтезе , особенно в синтезе гетероциклов, таких как имидазолы . [14] Удобная форма реагента для использования в лаборатории — его бис(полуацеталь) с этиленгликолем , 1,4-диоксан-2,3-диол. Это соединение коммерчески доступно.
Растворы глиоксаля можно использовать и как фиксатор для гистологии , то есть метода консервации клеток для исследования их под микроскопом.
Видообразование в растворе
[ редактировать ]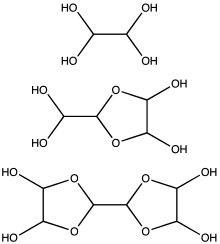
Глиоксаль обычно поставляется в виде 40% водного раствора. [3] Как и другие небольшие альдегиды , глиоксаль образует гидраты. Кроме того, гидраты конденсируются с образованием ряда олигомеров, структура некоторых из которых остается неопределенной. Для большинства применений точная природа частиц в растворе не имеет значения. По меньшей мере один гидрат глиоксаля продается коммерчески, дигидрат тримера глиоксаля: [(CHO) 2 ] 3 (H 2 O) 2 (CAS 4405-13-4).Доступны и другие эквиваленты глиоксаля, такие как полуацеталь этиленгликоля 1,4-диоксан- транс -2,3-диол ( CAS 4845-50-5, т. пл. 91–95 °C).
Подсчитано, что при концентрациях менее 1 М глиоксаль существует преимущественно в виде мономера или его гидратов, т.е. OCHCHO, OCHCH(OH) 2 или (HO) 2 CHCH(OH) 2 . При концентрациях выше 1 М преобладают димеры. Эти димеры, вероятно, представляют собой диоксоланы с формулой [(HO)CH] 2 O 2 CHCHO. Димеры и тримеры осаждаются в виде твердых веществ из холодных растворов. [15]
Другие случаи
[ редактировать ]Глиоксаль наблюдался как примесный газ , например, как продукт окисления углеводородов. в атмосфере [16] в тропосфере концентрациях 0–200 частей на миллиард по объему, а в загрязненных регионах - до 1 частей на миллиард по объему. Сообщалось о [17]
Безопасность
[ редактировать ]ЛД , 50 (перорально, крысы) составляет 3300 мг/кг [3] когда ЛД 50 поваренной соли составляет 3000 мг/кг. [18]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с «Характеристика (функциональные) и замещающие группы». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. 415, 417. doi : 10.1039/9781849733069-00372 . ISBN 978-0-85404-182-4 .
- ^ О'Нил, MJ (2001): Индекс Merck , 13-е издание, стр. 803.
- ^ Перейти обратно: а б с д и ж Маттиода, Жорж; Блан, Ален. «Глиоксаль». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a12_491.pub2 . ISBN 978-3527306732 .
- ^ См.:
- Х. Дебус (1857) «О действии азотной кислоты на спирт при обычных температурах», «Философский журнал » , 4-я серия, 13 : 39–49. Из стр. 40: «Этот остаток почти полностью состоял из альдегида глиоксиловой кислоты; я предложил назвать его Глиоксалем , C 2 H 4 O 3 ».
- Х. Дебус (1857) «О глиоксале», Философский журнал , 4-я серия, 13:66 .
- ^ Генри Энфилд Роско и Карл Шорлеммер, Трактат по химии , том. 3 (Нью-Йорк, Нью-Йорк: Д. Эпплтон и компания, 1890), стр. 101–102.
- ^ Ронцио, Арканзас; Во, Т.Д. (1944). «Глиоксаль бисульфит». Органические синтезы . 24:61 . дои : 10.15227/orgsyn.024.0061 .
- ^ US3637860A , Кивени, Уильям П. и Паппас, Джеймс Дж., «Процесс получения глиоксаля», выпущено 25 января 1972 г.
- ^ Харрис, К.; Темме, Ф. (1907). «О мономолекулярном и тримекулярном глиоксале» . Отчеты . 40 (1): 165–172. дои : 10.1002/cber.19070400124 .
Смесь глиоксаля и пятиокиси фосфора теперь нагревают на открытом огне, и вскоре можно заметить, что, хотя содержимое колбы чернеет, образуется летучий зеленый газ, который конденсируется в охлажденной матрице, образуя красивые кристаллы желтого цвета. [Смесь (сырого) глиоксаля и P 4 O 10 нагревают открытым пламенем и вскоре после почернения содержимого наблюдают подвижный зеленый газ, который конденсируется в охлажденной колбе в виде красивых желтых кристаллов.]
- ^ ИП, ХС; Хуанг, XH; Ю, Дж. З. (2009). «Эффективные константы закона Генри для глиоксаля, глиоксиловой кислоты и гликолевой кислоты» (PDF) . Геофиз. Рез. Летт . 36 (1): L01802. Бибкод : 2009GeoRL..36.1802I . дои : 10.1029/2008GL036212 . S2CID 129747490 .
- ^ Голдин, Элисон; Бекман, Джошуа А.; Шмидт, Энн Мари; Крегер, Марк А. (2006). «Американская кардиологическая ассоциация» . Тираж . 114 (6): 597–605. doi : 10.1161/CIRCULATIONAHA.106.621854 . ПМИД 16894049 .
- ^ Вистоли, Г; Де Маддис, Д; Ципак, А; Жаркович, Н; Карини, М; Альдини, Дж. (август 2013 г.). «Конечные продукты гликооксидации и липоксидации (AGE и ALE): обзор механизмов их образования» (PDF) . Свободный Радик. Рез . 47 : Приложение 1:3–27. дои : 10.3109/10715762.2013.815348 . ПМИД 23767955 . S2CID 207517855 .
- ^ Виланова Б., Фернандес Д., Касасновас Р., Помар А.М., Альварес-Идабой Дж.Р., Эрнандес-Аро Н., Гранд А., Адровер М., Доносо Дж., Фрау Дж., Муньос Ф., Ортега-Кастро Дж. Механизм образования аддукта глиоксаль-ДНК , предшественник перекрестных связей ДНК. Int J Биол Макромол. Май 2017 г.;98:664-675. doi: 10.1016/j.ijbiomac.2017.01.140. Epub, 10 февраля 2017 г. PMID 28192135.
- ^ Перейти обратно: а б Ришарм Г., Лю С., Михуб М., Абдалла Дж., Леже Т., Жоли Н., Либарт Дж. К., Юркунас У.В., Надаль М., Булок П., Дайру Дж., Ламури А. Восстановление гликирования гуанина с помощью DJ-1 / Park7 и его бактериальных гомологов. Наука. 14 июля 2017 г.; 357 (6347): 208-211. doi: 10.1126/science.aag1095. Epub, 8 июня 2017 г. PMID 28596309
- ^ Снайдер, HR; Хэндрик, Р.Г.; Брукс, Луизиана (1942). «Имидазол» . Органические синтезы . 22:65 ; Сборник томов , т. 3, с. 471 .
- ^ Уиппл, Э.Б. (1970). «Структура глиоксаля в воде». Дж. Ам. хим. Соц. 92 (24): 7183–7186. дои : 10.1021/ja00727a027 .
- ^ Врекуссис, М.; Виттрок, Ф.; Рихтер, А.; Берроуз, JP (2009). «Временная и пространственная изменчивость глиоксаля, наблюдаемая из космоса» . Атмосфера. хим. Физ . 9 (13): 4485–4504. Бибкод : 2009ACP.....9.4485V . дои : 10.5194/acp-9-4485-2009 .
- ^ Волкамер, Райнер; и др. (2007). «Отсутствующий поглотитель газообразного глиоксаля в Мехико: образование вторичного органического аэрозоля» . Геофиз. Рез. Летт . 34 (19): 19. Бибкод : 2007GeoRL..3419807V . дои : 10.1029/2007gl030752 . S2CID 17490842 .
- ^ «Данные по безопасности (MSDS) для хлорида натрия» . ox.ac.uk. Архивировано из оригинала 7 июня 2011 г.




![{\displaystyle K_{\text{H}}=4,19\times 10^{5}\times \exp \left[{\frac {6,22\times 10^{4}\,{\text{J}}\, {\text{моль}}^{-1}}{R}}\times \left({\frac {1}{T}}-{\frac {1}{298\,{\text{K}} }}\right)\right]\,{\text{M}}\,{\text{atm}}^{-1}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b0b2a288b5770ef350f3249431764b3c2d799d45)