Диоксолан
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
1,3-диоксолан [ 3 ] | |||
| Систематическое название ИЮПАК
1,3-диоксациклопентан | |||
| Другие имена | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.010.422 | ||
| Номер ЕС |
| ||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
| Число | 1166 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 3 Н 6 О 2 | |||
| Молярная масса | 74.08 g/mol | ||
| Плотность | 1,06 г/см 3 | ||
| Температура плавления | -95 ° C (-139 ° F; 178 К) | ||
| Точка кипения | 75 ° C (167 ° F; 348 К) | ||
| Опасности | |||
| СГС Маркировка : [ 4 ] | |||

| |||
| Опасность | |||
| H225 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P280 , P303+P361+P353 , P370+P378 , P403+P235 , P501 | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
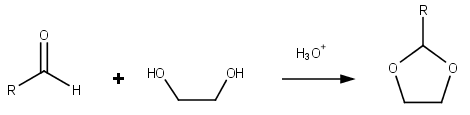
Диоксолан представляет собой гетероциклический ацеталь с химической формулой (CH 2 ) 2 O 2 CH 2 . Он связан с тетрагидрофураном (ТГФ) заменой метиленовой группы (СН 2 ) в положении 2 на атом кислорода. Соответствующие насыщенные 6-членные кольца C 4 O 2 называются диоксанами . Изомерный 1,2-диоксолан ( в котором два кислородных центра расположены рядом) представляет собой пероксид . 1,3-диоксолан используется в качестве и сомономера растворителя в полиацеталях .
Как класс соединений
[ редактировать ]Диоксоланы представляют собой группу органических соединений, содержащих диоксолановое кольцо. получить ацетализацией альдегидов и кетализацией кетонов можно этиленгликолем Диоксоланы . [ 5 ]
(+)- цис -диоксолан — это тривиальное название L -2-метил-4-триметиламмонийметил-1,3-диоксолана йодида , -(+)- цис который является мускариновых ацетилхолиновых рецепторов агонистом .
Защитные группы
[ редактировать ]Органические соединения, содержащие карбонильные группы, иногда нуждаются в защите , чтобы они не вступали в реакции при превращениях других функциональных групп , которые могут присутствовать. Разнообразие подходов к защите и снятию защиты с карбонилов [ 6 ] в том числе в виде диоксоланов [ 7 ] известны. Например, рассмотрим соединение метилциклогексанон-4-карбоксилат, где восстановление литийалюминийгидрида приведет к образованию 4-гидроксиметилциклогексанола. Эфирную функциональную группу можно восстановить, не затрагивая кетон , защищая кетон как кеталь . Кеталь образуется кислотно-катализируемой реакцией с этиленгликолем , проводится реакция восстановления и защитная группа удаляется гидролизом с образованием 4-гидроксиметилциклогексанона.

NaBArF 4 также можно использовать для снятия защиты с ацеталь- или кетально-защищенных карбонильных соединений. [ 6 ] [ 7 ] Например, снятие защиты с 2-фенил-1,3-диоксолана до бензальдегида может быть достигнуто в воде за пять минут при 30 °C. [ 8 ]
- PhCH(OCH 2 ) 2 + H 2 O PhCHO + НОСН 2 СН 2 ОН
Натуральные продукты
[ редактировать ]Неоспорол представляет собой натуральный продукт , включающий 1,3-диоксолановый фрагмент и являющийся изомером спорола , имеющего 1,3-диоксановое кольцо. [ 9 ] обоих полном синтезе Сообщалось о соединений, и каждое из них включает стадию, на которой образуется диоксолановая система с использованием трифторперуксусной кислоты (ТФПАА), полученной методом перекись водорода – мочевина . [ 10 ] [ 11 ] Этот метод не требует использования воды, поэтому дает полностью безводную надкислоту. [ 12 ] В данном случае это необходимо, так как присутствие воды может привести к нежелательным побочным реакциям . [ 10 ]
В случае неоспорола реакция Прилежаева [ 13 ] с трифторперуксусной кислотой используется для превращения подходящего предшественника аллилового спирта в эпоксид , который затем подвергается реакции расширения кольца с ближайшей карбонильной функциональной группой с образованием диоксоланового кольца. [ 10 ] [ 11 ]

Подобный подход используется при полном синтезе спорола, при этом диоксолановое кольцо позже расширяется до диоксановой системы. [ 9 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ 1,3-Диоксолан в Sigma-Aldrich
- ^ формальгликоль - Публичная химическая база данных PubChem
- ^ «Фронт материи». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 145. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
- ^ «1,3-Диоксолан» . pubchem.ncbi.nlm.nih.gov .
- ^ Р. А. Дайно, Э. Л. Элиэль (1973). «2-Циклогексилоксиэтанол (включает ацетализацию циклогексанона)» . Органические синтезы ; Сборник томов , т. 5, с. 303 .
- ^ Jump up to: а б Грин, Теодора В.; Вутс, Питер GM (1999). «Диметилацетали». Защитные группы Грина в органическом синтезе (3-е изд.). Уайли-Интерсайенс . стр. 297–304, 724–727. ISBN 9780471160199 . Архивировано из оригинала 3 декабря 2016 года . Проверено 20 июня 2017 г.
- ^ Jump up to: а б Грин, Теодора В.; Вутс, Питер GM (1999). «1,3-Диоксаны, 1,3-Диоксоланы». Защитные группы Грина в органическом синтезе (3-е изд.). Уайли-Интерсайенс . стр. 308–322, 724–727. ISBN 9780471160199 . Архивировано из оригинала 7 декабря 2016 года . Проверено 20 июня 2017 г.
- ^ Чанг, Чи-Цзин; Ляо, Бэй-Сих; Лю, Шиу-Цунг (2007). «Снятие защиты с ацеталей и кеталей в коллоидной суспензии, полученной тетракис(3,5-трифторметилфенил)боратом натрия в воде». Синлетт . 2007 (2): 283–287. дои : 10.1055/s-2007-968009 .
- ^ Jump up to: а б Пиррунг, Майкл С.; Морхед, Эндрю Т.; Янг, Брюс Г., ред. (2000). «10. Неоспорол, Спорол» . Часть B: Бициклические и трициклические сесквитерпены . Полный синтез натуральных продуктов. Том. 11. Джон Уайли и сыновья . стр. 222–224. ISBN 9780470129630 .
- ^ Jump up to: а б с Зиглер, Фредрик Э.; Меткалф, Честер А.; Нангия, Ашвини; Шульте, Гейл (1993). «Структура и общий синтез спорола и неоспорола». Дж. Ам. хим. Соц. 115 (7): 2581–2589. дои : 10.1021/ja00060a006 .
- ^ Jump up to: а б Кастер, Кеннет К.; Рао, А. Сомасекар; Мохан, Х. Рама; МакГрат, Николас А.; Бричачек, Мэтью (2012). «Трифторперуксусная кислота». Электронная энциклопедия реагентов для органического синтеза EROS . дои : 10.1002/047084289X.rt254.pub2 . ISBN 978-0471936237 .
- ^ Купер, Марк С.; Хини, Гарри ; Ньюболд, Аманда Дж.; Сандерсон, Уильям Р. (1990). «Реакции окисления с использованием мочевины и перекиси водорода; безопасная альтернатива безводной перекиси водорода». Синлетт . 1990 (9): 533–535. дои : 10.1055/s-1990-21156 .
- ^ Хаген, Тимоти Дж. (2007). «Реакция Прилежаева» . Ин Ли, Цзе Джек; Кори, Э.Дж. (ред.). Название Реакции превращений функциональных групп . Джон Уайли и сыновья . стр. 274–281. ISBN 9780470176504 .


![{\displaystyle {\ce {->[{\ce {NaBAr4}}][{\text{30 °C / 5 мин}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fb42849d6133fe653a7fe5dd019b12e0f6184b5)