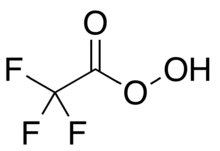
Трифторпероуксусная кислота
| |
| Имена | |
|---|---|
| Предпочтительное имя IUPAC
Трифторэтанепероксовая кислота | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Chemspider | |
PubChem CID
|
|
| НЕКОТОРЫЙ | |
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| C 2 H F3 O 3 | |
| Молярная масса | 130.022 g·mol −1 |
| Появление | бесцветная жидкость |
| Точка кипения | 162 ° C (324 ° F; 435 K) |
| Растворимость | растворимый в ацетонитриле , дихлорметане , диэтиловом эфире , сульфоне |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
Трифторпероукреционная кислота ( трифторпероксиксусная кислота , TFPAA ) представляет собой органофлюориновое соединение, перокси кислоты аналог трифторуксусной кислоты с конденсированной структурной формулой CF
3 COOH . [ Примечание 1 ] Это сильный окислительный агент для реакций органического окисления , например, при -Villiger Baeyer окислении кетонов . [ 1 ] Это наиболее реактивный из органических перокси кислот, позволяющий успешно окислить относительно нереактивные алкены в эпоксиды , где другие перокси кислоты неэффективны. [ 2 ] Это также может окислить халкогены в некоторых функциональных группах, например, путем преобразования Selenoethers в Selones . [ 3 ] Это потенциально взрывной материал [ 4 ] и не является коммерчески доступным, но это может быть быстро подготовлено по мере необходимости. [ 5 ] Его использование в качестве лабораторного реагента было первым и разработано Уильямом Д. Эммонсом . [ 6 ] [ 7 ]
Характеристики
[ редактировать ]При стандартной температуре и давлении окружающей среды трифторпероуперационная кислота представляет собой бесцветную жидкость с темой кипения 162 ° C. [ 8 ] Он растворим в ацетонитриле , дихлорметане , диэтиловом эфире и сульфоне и легко реагирует с водой. [ 5 ] Как и все перокси кислоты, она потенциально взрывоопасна и требует тщательной обработки. [ 4 ] Он не является коммерчески доступным, но может быть сделан в лаборатории и храниться до нескольких недель при -20 ° C. [ 5 ] Некоторые препаративные методы приводят к смесям, содержащим остаточный перекись водорода и трифторуксусную кислоту , а нагревание такой смеси является чрезвычайно опасной; Перекись водорода может быть разлагается с использованием диоксида марганца для безопасности перед нагреванием. [ 5 ] [ 8 ]
Подготовка
[ редактировать ]Трифторпероуксусная кислота может быть легко подготовлена органическими синтезами [ 9 ] Процесс лечения трифторуксусного ангидрида с концентрированным (90%) [ 2 ] Водный раствор перекиси водорода:
- См
3 COOCOCF
3 + ч
2 o
2 → CF
3 куох + cf
3 COOH
Поскольку ангидрид будет образовывать трифторуксусную кислоту при контакте с водой, избыток ангидрида также служит для удаления растворителя из реагента пероксида: [ 9 ]
- См
3 COOCOCF
3 + ч
2 O → 2 CF
3 COOH
Более разбавленный раствор перекиси водорода (30%) может быть использован для образования трифторпетерной кислоты для некоторых реакций из трифторуксусной кислоты. [ 2 ]
- См
3 COOH + H
2 o
2 → CF
3 cooh + h
2 o
Чтобы избежать опасности обработки чистых или высококонцентрированных растворов перекиси водорода, перекись водорода - мочевина может использоваться для получения Peracid. [ 5 ] Этот метод не включает воду, поэтому он дает полностью безводную парекцию, [ 10 ] что является преимуществом, когда присутствие воды приводит к побочным реакциям во время определенных реакций окисления. [ 11 ]
- См
3 COOCOCF
3 + ч
2 o
2 · Ко (NH
2 )
2 → CF
3 куох + cf
3 COOH + CO (NH
2 )
2
В тех случаях, когда для синтеза необходим буферный агент pH и где терпит наличие воды, был разработан другой подход. Реагирование трифторуксом ангидрид с перкарбонатом натрия , 2NA
22
3 ·3H
2 o
2 , дает трифторпероуперационную кислоту и карбонат натрия , что устраняет необходимость в дополнительном буфере. [ 5 ] [ 12 ]
- 3 ср
3 COOCOCF
3 + 4
22
3 · 3 / 2 H
2 o
2 → 6 CF
3 куох + 4 и
22
3 + 3 ч
2 o
Трифторпероукетовая кислота также может быть получена на месте , [ 13 ] позволяя ему быстро реагировать с целевым субстратом, а не предварительно синтезировать партию реагента для последующего использования.
Использование
[ редактировать ]
6 часов
5 I (OOCCF
3 )
2
Трифторпероуклическая кислота в основном используется в качестве окислительного агента . [ 5 ] [ 7 ] В сентябре 1953 года журнал Американского химического общества опубликовал работу Уильяма Д. Эммонса и Артура Ф. Ферриса, сообщившего, что этот реагент, созданный на месте , способен окислить анилин до нитробензола . [ 13 ] В течение следующих двух лет Эммонс сообщил о подготовительном методе для этого реагента и опубликовал шесть еще рукописей в этом журнале по приложениям; [ 14 ] [ 15 ] [ 16 ] Эммонс отчасти помнят как пионер [ 6 ] и разработчик [ 7 ] трифторпероуксусной кислоты как лабораторного реагента, который с тех пор стал полезным в качестве реагента для многих различных типов синтетических реакций.
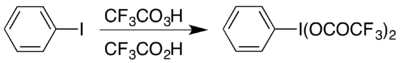
Одним из примеров является образование гипервалентного йодного соединения (BIS (трифтоороацетокси) йодо) бензол , (cf
3 COO)
2 IC
6 часов
5 , который используется для выполнения перестройки Хофманна в кислых условиях. [ 17 ] Гипервалентное соединение доступно двумя способами, и которое выбирается, как правило, зависит от того, какие материалы доступны: оно может быть подготовлено из аналога ацетата с помощью реакции обмена, [ 18 ] или, реагируя йодобензол с комбинацией трифторпероуперационной кислоты и трифторуксусной кислоты: [ 17 ]
Baeyer -villiger Окисление
[ редактировать ]
Трифторпероуксусная кислота является одним из самых сильных реагентов, используемых для окисления Baeyer -Villiger, вследствие его высокой кислотности по сравнению с аналогичными перокидами и пероксидами . [ 19 ] : 17 Эта реакция превращает кетоны прямой цепочки в эфиры или лактоны и названа в честь Адольфа фон Байера и Виктора Виллигера , которые впервые сообщили об этом в 1899 году. [ 1 ] Считается, что реакция проходит через промежуточный [ 5 ] и демонстрирует хорошую региоселективность и химисеалективность для положения вставки атома кислорода, наряду с сохранением стереохимии в соседнем положении, что видно в следующем примере. дистия Фосфат ( NA
2 HPO
4 ) добавляется в виде буфера pH [ 2 ] Для предотвращения побочного продукта с высокой кислой трифторуксусной кислотой вызывает гидролиз [ 20 ] или переэтерификация [ 21 ] эфирного продукта.

Эпоксидирование
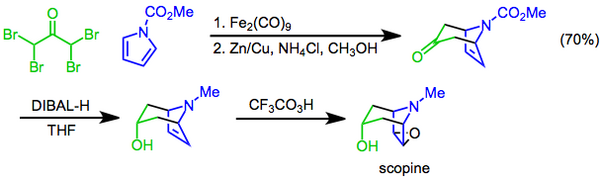
[ редактировать ]Реакция Прилецхаева включает преобразование алкена в эпоксиду с использованием перацида в качестве окислителя [ 22 ] и впервые был зарегистрирован в 1909 году. [ 23 ] Реакция была использована в качестве последней стадии синтеза Scopine , тропанового алкалоида . При таком подходе циклический цикл , опосредованный диронно -неакарбонилом, используется для построения бициклического скелета, гидроксильной функциональной группе затем вводится путем диастереоселективного восстановления кетона с дизобутилалуминовым гидридом и препаратом, завершенным с трифлиореоретическим эпоксидом, приготовленным приготовлением к прилицевиру Полем [ 24 ]
Высокая реакционная способность трифторпекреционной кислоты по сравнению с другими перокси кислоты позволяет ей успешно окислять относительно электронные плохие алкены, такие как 1-гексен и α, β-непристойные сложные эфиры, такие как метиловый мецилат , субстраты, которые обычно устойчивы к эпоксидированию перокси-кислоты. [ 2 ] Включение дополнительной буферированной трифторуксусной кислоты в смеси дает витуинальную гидрокси-трифтор-структуру вместо эпоксида, которая может быть преобразована в диол путем обработки кислым метанолом , например, при следующей конверсии 1-додекена в 1,2-додеканиол. [ 2 ]

В случае аллильского спиртового соединения с ближайшей карбонильной функциональной группой эпоксид может подвергаться реакции с кольцами, образуя диоксолан . [ 5 ] [ 11 ] Процесс ниже использовался как часть синтеза неоспорола общего , натурального продукта : [ 11 ] [ 25 ]

Приготовление изомерного состава спорола включало аналогичное образование диоксолана. В этом случае использование трифторперопаксусной кислоты, полученной из перекиси водорода, которая, следовательно, предположительно содержала следы воды, давало в основном гемиацетальный, а не диоксолан с замкнутым кольцом. Использование комплекса мочевины, которое дало материал без воды, успешно дало диоксолан в качестве основного продукта. [ 11 ] Диоксолан расширяется до 1,3-диоксановой системы, обнаруженной в Sporol на более позднем этапе синтеза. [ 25 ]
Окисление гетероатома
[ редактировать ]Функциональные группы , содержащие гетероатомы в низких состояниях окисления, могут быть окислены трифторпероукеточной кислотой. [ 5 ] [ 7 ] Общие случаи включают окисление йода (например, образование гипервалентного йодового соединения из йодобензола, упомянутого ранее), азота, серы и селена.
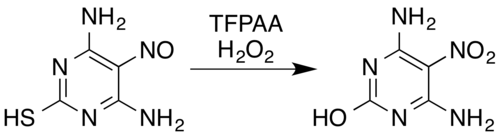
В случае азотных соединений известные трансформации включают оксим [ 5 ] и ароматические первичные амины [ 15 ] к нитро -соединениям [ 7 ] (Даже с заместителями электронов , например, пентафтоороанилином в пентафторнитробензол. [ 26 ] ), нитрозамины в нитрамины , [ 7 ] [ 14 ] образование ароматических н -оксидов и ароматических азиновых оксидов , [ 5 ] [ 27 ] и превращение нитрозовых соединений в нитро -соединения или нитрамины. [ 5 ] Например, смесь перекиси водорода и трифторпероуперационной кислоты окисляет нитрозозамещенную пиримидин 4,6-диамино-5-нитросопиримидин-2-тиол в его аналог нитро, а также удаляет тиол : нитро путем окислительной гидролитической десульфуризации . [ 5 ] [ 28 ]
В случае элементов халкогена сульфидные фрагменты (r - s - r) могут окисляться трифторпероуперационной кислотой до сульфоксид (r - s (o) –r) и/или сульпона (r - s (o) 2 –r) , в зависимости от используемых условий. [ 5 ] В аналогичной системе селена окисление трифторпероуперационной кислоты селенетеров (r -se -r) образует сероне (r -se (o) 2 -r) без образования связанных селеноксидов (r -se (o) –r) как изоляционный продукт, [ 3 ] Реакция, которая особенно эффективна, когда R является арильной группой. [ 29 ] Общий подход к образованию сульфинилхлоридов (RS (O) Cl) - это реакция соответствующего тиола с сульфурилхлоридом ( таким образом
2 кл
2 ). В тех случаях, когда вместо этого приводит к приводу сульфенилхлорида (RSCL), последующее окисление трифторпероуперационной кислоты дает желаемый продукт, как в случае 2,2,2-трифтор-1,1- дифенилэтантиола : [ 30 ]

Окисление тиофена трифторпероукеточной кислоты иллюстрирует конкурирующие пути реакции, при этом как S -окисление, так и эпоксидирование. возможным [ 31 ] [ Примечание 2 ] Основной путь изначально образует сульфоксид, но это химическое вещество быстро подвергается Дильса -Альдера типа димеризации до того, как произошло дальнейшее окисление, -ни те, ни тиофена , или тиофена , S -диоксид среди продуктов реакции. [ 5 ] [ 31 ] Затем димер может быть окислен, преобразуя одну из S -оксидных фрагментов в S , S -диоксид. В незначительном пути реакции эпоксидирование Прилецхаева [ 22 ] приводит к образованию тиофена-2,3-эпоксида, который быстро переставляется в изомер тиофен-2-о-о. [ 31 ] Поиск экспериментов [ 35 ] Продемонстрируйте, что этот эпоксидный путь не является альтернативной реакцией промежуточного соединения S -оксида, и по изотопной маркировке эксперименты демонстрируют, что происходит сдвиг 1,2 -гидрида ( сдвиг NIH ) и, таким образом, что связано с катионным промежуточным. [ 31 ] Выбор метода препарата трифторпероукеточной кислоты важен, поскольку вода подавляет незначительный путь реакции, вероятно, потому что он действует как конкурирующая основа. [ 31 ]

Окисление кислым перестройкой
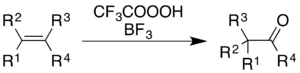
[ редактировать ]Использование трифторпероуксусной кислоты с трифторидом бора вызывает окисление алкенов и ароматических колец с сопутствующей перестройкой молекулярного скелета. [ 5 ]
Для алкенов реакция дает кетоновый продукт, хотя механистический процесс -это не просто эпоксидирование, за которым следует перестройка BF 3 , катализируемое Вагнером -Мервейн : [ 36 ]
Для ароматики примером, продемонстрированным в отчете органических синтезов, является преобразование гексаметилбензола в 2,3,4,5,6,6-гексаметил-2,4-циклогексадиен: [ 9 ]

Окислительное расщепление арены
[ редактировать ]В дополнение к простому окислению ароматических колец с образованием карбонильных соединений (см. § окисление кислой перегрупкой ), трифторпероуперационная кислота может полностью расщеплять углерод -углеродные связи внутри кольца. В отличие от других окислений алкилароматических структур, которые дают бензойные кислоты и родственные соединения путем расщепления алкильной цепи в реактивном положении бензила , трифторпероуперационная кислота вызывает «обратное окисление», расщепляя само ароматическое кольцо, оставляя алкильную группу. [ 37 ] [ 38 ]

Эта селективность для определенных типов связей позволяет использовать ее для разложения сложных смесей углеводородов, таких как уголь , для определения структурных деталей. [ 39 ] [ 37 ]
Ароматические системы, содержащие гетероатомы, устойчивы к этому открытию кольца, поскольку окисление гетероатома происходит преимущественно и деактивирует кольцо в направлении электрофильной атаки перокси кислотой. Например, пурины , пиридины и хинолины вместо этого образуют n -оксиды, [ 5 ] В то время как серные системы, такие как Octafluoro dibenzothiophene, преобразуются в сульфоны. [ 7 ] [ 40 ]
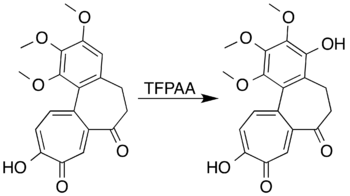
Ароматические системы с активирующими кольцами заместители могут быть окислены с образованием фенолов вместо того, чтобы перенести реакцию от открытия кольца. мезитилен Например, реагирует с трифторпероуксусной кислотой с образованием мезитола (2,4,6-триметилфенол). [ 7 ] Исследователи, пытающиеся сформировать лактон путем окисления Baeyer-Villiger 7-оксодеацетамидо колхицины , не смогли подготовить желаемый продукт, но достигли окисления ароматического кольца с образованием фенол-источника с высокой урожайностью: [ 5 ] [ 41 ]
Примечания
[ редактировать ]- ^ Три конденсированных структурных формула используются для представления трифторпероперационной кислоты, CF
3 Куох , ср.
3 co
3 часа и CF
3 C (O) OOH . Они эквивалентны и могут использоваться взаимозаменяемо. - ^ Такие соревнования могут иметь биохимическое значение. Например, известно, что диуретический фармацевтический агент с диуретическим агентом действует как субстрат самоубийства в ферментах цитохрома р450 , и что процесс включает в себя окисление тиофена, но ответственный путь окисления остается неясным, несмотря на значительную исследовательскую активность. [ 32 ] [ 33 ] [ 34 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный Кюрти, Ласло; Czakó, Barbara (2005). Стратегическое применение названных реакций в органическом синтезе . Elsevier Academic Press . п. 28. ISBN 978-0-12-429785-2 .
- ^ Jump up to: а беременный в дюймовый и фон Хияма, Тамеджиро (2000). «8.2 Трифторуксусная кислота и трифторпероуперационная кислота» . Органофлюорийные соединения: химия и применение . Springer Science & Business Media . С. 255–257. ISBN 978-3-662-04164-2 .
- ^ Jump up to: а беременный Катаока, Т.; Йошимацу, М. (1995). «Алкил-халькогениды: функциональные группы на основе селена и теллурия» . В Лей, Стивен В. (ред.). Синтез: углерод с одним гетероатомом, прикрепленным одной связью . Комплексные трансформации органических функциональных групп. Elsevier . С. 277–296 . ISBN 978-0-08-042323-4 .
- ^ Jump up to: а беременный Кэри, Фрэнсис А.; Сандберг, Ричард Дж. (2007). «5.5 реакции добавления с участием эпоксидов» . Усовершенствованная органическая химия: Часть A: Структура и механизмы (5 -е изд.). Springer Science & Business Media . С. 503–514. ISBN 978-0-387-44897-8 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Кастер, Кеннет С.; Рао, А. Сомасекар; Мохан, Х. Рама; МакГрат, Николас А.; Brichacek, Matthew (2012). «Трифторпероуксусная кислота». Энциклопедия реагентов для органического синтеза . Энциклопедия E-Eeros реагентов для органического синтеза . doi : 10.1002/047084289x.rt254.pub2 . ISBN 978-0-471-93623-7 .
- ^ Jump up to: а беременный Фриман, Иеремия П. (14 ноября 2002 г.). «Уильям Д. Эммонс: 18 ноября 1924 г. - 8 декабря 2001 года» (PDF) . Орг Синтезатор 80 : XXVII - XXIX. Архивировано из оригинала (PDF) 16 марта 2015 года . Получено 21 января 2017 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час Чемберс, Ричард Д. (2004). «Функциональные соединения, содержащие кислород, серу или азот и их производные» . Фтор в органической химии . CRC Press . С. 242–243. ISBN 978-0-8493-1790-3 .
- ^ Jump up to: а беременный Luxon, SG (1992). Опасности в химической лаборатории (5 -е изд.). Королевское общество химии . п. 627. ISBN 978-0-85186-229-3 .
- ^ Jump up to: а беременный в Харт, Гарольд; Ланге, Ричард М.; Коллинз, Питер М. (1968). «2,3,4,5,6,6-гексаметил-2,4-циклогексадиен-1-One» . Органические синтезы . 48 : 87. doi : 10.15227/orgsyn.048.0087 ; Собранные объемы , вып. 5, с. 598 .
- ^ Купер, Марк С.; Хини, Гарри ; Newbold, Amanda J.; Сандерсон, Уильям Р. (1990). «Реакции окисления с использованием пероксида мочевины -гидрогена; безопасная альтернатива безводному перекисью водорода». Синлетт 1990 (9): 533–535. doi : 10.1055/s-1990-21156 . S2CID 196724921 .
- ^ Jump up to: а беременный в дюймовый Зиглер, Фредрик Э.; Metcalf, Chester A.; Нания, Ашвини; Шульте, Гейл (1993). «Структура и общий синтез спорола и неоспорола». J. Am. Химический Соц 115 (7): 2581–2589. doi : 10.1021/ja00060a006 .
- ^ Кан, Хо-Джунг; Чон, Хи-Сун (1996). «Новый метод генерации трифторпероксиксусной кислоты для реакции Baeyer-Villiger» . Бык Корейский хим. Соц 17 (1): 5–6.
- ^ Jump up to: а беременный Эммонс, Уильям Д .; Феррис, Артур Ф. (1953). «Реакции окисления с пертрифторуксусной кислотой». J. Am. Химический Соц 75 (18): 4623–4624. doi : 10.1021/ja01114a539 .
- ^ Jump up to: а беременный Эммонс, Уильям Д. (1954). «Перокситрифторуксусная кислота. I. Окисление нитрозаминов до нитраминов». J. Am. Химический Соц 76 (13): 3468–3470. doi : 10.1021/ja01642a029 .
- ^ Jump up to: а беременный Эммонс, Уильям Д. (1954). «Перокситрифторуксусная кислота. II. Окисление анилинов до нитробензонов». J. Am. Химический Соц 76 (13): 3470–3472. doi : 10.1021/ja01642a030 .
- ^ Эммонс, Уильям Д .; Pagano, Angelo S.; Фриман, Иеремия П. (1954). «Перокситрифторуксусная кислота. III. Гидроксилирование олефинов». J. Am. Химический Соц 76 (13): 3472–3474. doi : 10.1021/ja01642a031 .
Эммонс, Уильям Д .; Pagano, Angelo S. (1955). «Перокситрифторуксусная кислота. IV. Эпоксидирование олефинов». J. Am. Химический Соц 77 (1): 89–92. doi : 10.1021/ja01606a029 .
Эммонс, Уильям Д .; Лукас, Джордж Б. (1955). «Перокситрифторуксусная кислота. V. Окисление кетонов в эфиры». J. Am. Химический Соц 77 (8): 2287–2288. doi : 10.1021/ja01613a077 .
Эммонс, Уильям Д .; Pagano, Angelo S. (1955). «Перокситрифторуксусная кислота. VI. Окисление оксимов нитропарафинами». J. Am. Химический Соц 77 (17): 4557–4559. doi : 10.1021/ja01622a036 . - ^ Jump up to: а беременный Обе, Джеффри; Фел, Чарли; Лю, Ручхан; McLeod, Michael C.; Motiwala, Hashim F. (1993). «6.15 Hofmann, Curtius, Schmidt, Lossen и связанные с ними реакции». Манипуляции с гетероатомом . Комплексный органический синтез II. Тол. 6. С. 598–635. doi : 10.1016/b978-0-08-097742-3.00623-6 . ISBN 978-0-08-097743-0 .
- ^ Миндаль, MR; Stimmel, JB; Томпсон, EA; Лоудон, GM (1988). «Перестраница Хофманна в мягких кислых условиях с использованием [ i , i -BIS (трифтороацетокси)] йодобензол: гидрохлорид циклобутиламина из циклобутанекарбоксида» . Органические синтезы . 66 : 132. doi : 10.15227/orgsyn.066.0132 ; Собранные объемы , вып. 8, с. 132 .
- ^ Майерс, Эндрю Г. "Химия 115 раздаточные материалы: окисление" (PDF) . Гарвардский университет . Архивировано из оригинала (PDF) 16 мая 2017 года . Получено 10 января 2017 года .
- ^ Каррутерс, Уильям (1971). «6.3 окисление олефинов» . Некоторые современные методы органического синтеза . Издательство Кембриджского университета . С. 259–280. ISBN 978-0-521-09643-0 .
- ^ Каррутерс, Уильям (1971). «6,5 Байер -Виллигер Окисление кетонов» . Некоторые современные методы органического синтеза . Издательство Кембриджского университета . С. 287–290. ISBN 978-0-521-09643-0 .
- ^ Jump up to: а беременный Хаген, Тимоти Дж. (2007). «Пресонов Прилецхав» . В Ли, Джи Джек; Кори, EJ (ред.). Имя реакции функциональных групповых преобразований . Джон Уайли и сыновья . С. 274–281. ISBN 978-0-470-17650-4 .
- ^ Prileschajew, Nikolaus (1909). «Окисление ненасыщенных соединений с использованием органического супероксида» [окисление ненасыщенных соединений с помощью органических супероксидов]. Бер DTSCH. Хим . 42 (4): 4811–4815. Doi : 10.1002/cber.190904204100 .
- ^ Hayakawa, Y.; Баба, у.; Makino, S.; Noyori, R. (1978). «Образование углерод-углеродных связей, способствующее переходным металлам карбонилам. J. Am. Химический Соц 100 (6): 1786–1791. doi : 10.1021/ja00474a021 .
- ^ Jump up to: а беременный Пиррунг, Майкл С.; Морхед, Эндрю Т.; Янг, Брюс Г., ред. (2000). «10. Неоспорол, спорол» . Часть B: Бициклические и трициклические сесквитерпены . Общий синтез натуральных продуктов. Тол. 11. Джон Вили и сыновья . С. 222–224. ISBN 978-0-470-12963-0 .
- ^ Брук, GM; Burdon, J.; Tatlow, JC (1961). «Ароматические полифлюровые соединения. Часть VII. Реакция пентафторнитробензола с аммиаком». J. Chem. Соц : 802–807. doi : 10.1039/jr9610000802 .
- ^ Уильямс, В. Майкл; Долбиер, Уильям Р. (1969). «Тепловые и фотохимические перестройки оксидов азина. I. Пиролитическое разложение на нитрилы». J. Org. Химический 34 (1): 155–157. doi : 10.1021/jo00838a034 .
- ^ Тейлор, Эдвард С .; МакКиллоп, Александр (1965). «Новый синтез 5-нитропиримидинов». J. Org. Химический 30 (9): 3153–3155. doi : 10.1021/jo01020a067 .
- ^ Тейлор, ПК (1995). «Винил и арил-халкогениды: функциональные группы на основе селена и теллера» . В Лей, Стивен В. (ред.). Синтез: углерод с одним гетероатомом, прикрепленным одной связью . Комплексные трансформации органических функциональных групп. Elsevier . С. 705–736 . ISBN 978-0-08-042323-4 .
- ^ Page, PCB; Уилкс, Rd; Рейнольдс, Д. (1995). «Алкил-халькогениды: функциональные группы на основе серы» . В Лей, Стивен В. (ред.). Синтез: углерод с одним гетероатомом, прикрепленным одной связью . Комплексные трансформации органических функциональных групп. Elsevier . С. 113–276 . ISBN 978-0-08-042323-4 .
- ^ Jump up to: а беременный в дюймовый и Трибер, Александр (2002). «Механизм ароматического гидроксилирования тиофена при кислотно-катализированном окислении перцида». J. Org. Химический 67 (21): 7261–7266. doi : 10.1021/jo0202177 . PMID 12375952 .
- ^ Мэнсуй, Даниэль; Валадон, Филипп; Erdelmeier, Irene; Лопес Гарсия, Пилар; Амар, Клодин; Жиро, Жан-Пьер; Дансетт, Патрик М. (1991). «Тиофен S -оксиды в виде новых реактивных метаболитов: образование цитохромом P -450 -зависимым окислением и реакцией с нуклеофилами». J. Am. Химический Соц 113 (20): 7825–7826. doi : 10.1021/ja00020a089 .
- ^ Correia, Maria A.; Холленберг, Пол Ф. (2015). «Ингибирование ферментов цитохрома P450» . В Ортисе де Монтеллано, Пол Р. (ред.). Цитохром P450: структура, механизм и биохимия (4 -е изд.). Спрингер . С. 177–260. ISBN 978-3-319-12108-6 .
- ^ Мачери, Энн-Кристин; Дансетт, Патрик М. (2015). «Биотрансформации, ведущие к токсичным метаболитам: химические аспекты» . В Вермуте, Камилла Жорж ; Олдос, Дэвид; Рабиассон, Пьер; Rognan, Didier (Eds.). Практика лекарственной химии (4 -е изд.). Elsevier . С. 585–614. ISBN 978-0-12-417213-5 .
- ^ Анслин, Эрик В . ; Догерти, Деннис А. (2006). «8.8 Разное эксперименты по изучению механизма» . Современная физическая органическая химия . Университетские научные книги . С. 471–482. ISBN 978-1-891389-31-3 .
- ^ Харт, Гарольд; Лернер, Лоуренс Р. (1967). «Окисления перокситрифторуксусным трифторидом и бором. J. Org. Химический 32 (9): 2669–2673. doi : 10.1021/jo01284a004 .
- ^ Jump up to: а беременный Дено, Норман С .; Григер, Барбара А.; Страуд, Стивен Г. (1978). «Новый метод для выяснения структур угля». Топливо . 57 (8): 455–459. doi : 10.1016/0016-2361 (78) 90153-9 .
- ^ Дено, Норман С .; Григер, Барбара А.; Мессер, Лорен А.; Мейер, Майкл Д.; Страуд, Стивен Г. (1977). «Ароматическое окисление кольца алкилбензен». Тетраэдр Летт. 18 (20): 1703–1704. doi : 10.1016/s0040-4039 (01) 93253-8 .
- ^ Дено, Норман С .; Карри, Кеннет У.; Григер, Барбара А.; Джонс, А. Даниэль; Ракицкий, Уолтер Г.; Смит, Карен А.; Вагнер, Карен; Минард, Роберт Д. (1980). «Дигидроароматическая структура Иллинойса № 6 угля Монтерей» . Топливо . 59 (10): 694–698. doi : 10.1016/0016-2361 (80) 90021-6 .
- ^ Chambers, Rd; Каннингем, JA; Весна, DJ (1968). «Полифторил -органометаллические соединения. Часть VIII. Синтез и нуклеофильной замещения в октафтородибензофуране». J. Chem. Соц C : 1560–1565. doi : 10.1039/j39680001560 .
- ^ Берг, Ульф; Бладха, Хокан; Mpamposa, Konstantinos (2004). «Стереохимические вариации мотива колхицины. Перацидное окисление тиоколхикона. Синтез, конформация и ингибирование сборки микротрубочек». Орг Биомол. Химический 2 (14): 2125–2130. doi : 10.1039/b402840f . PMID 15254641 .