Фотоинициатор

В химии фотоинициатор — это молекула, которая создает реактивные частицы ( свободные радикалы , катионы или анионы ) при воздействии радиации ( УФ или видимой ). Синтетические фотоинициаторы являются ключевыми компонентами фотополимеров (например, фотоотверждаемых покрытий, клеев и стоматологических реставраций).
Некоторые небольшие молекулы в атмосфере также могут действовать как фотоинициаторы, разлагаясь с образованием свободных радикалов (фотохимический смог ). Например, диоксид азота ( NO 2 ) производится в больших количествах бензиновыми сгорания двигателями внутреннего . NO 2 в тропосфере придает смогу коричневую окраску и катализирует образование токсичного приземного озона ( О 3 ). Молекулярный кислород ( O 2 ) также служит фотоинициатором в стратосфере, распадаясь на атомарный кислород и соединяясь с O 2 для образования озона в озоновом слое.
Реакции
[ редактировать ]Фотоинициаторы могут создавать реактивные соединения различными путями, включая фотодиссоциацию и перенос электрона . В качестве примера диссоциации перекись водорода может подвергаться гомолитическому расщеплению с Связь О-О расщепляется с образованием двух гидроксильных радикалов .
- Н 2 О 2 → 2 ·ОН
Некоторые азосоединения (например, азобисизобутиронитрил ) также могут фотолитически расщепляться с образованием двух алкильных радикалов и газообразного азота:
- RCH 2 −N=N−H 2 CR → 2 RCH 2 + N 2
Эти свободные радикалы теперь могут способствовать другим реакциям.
Атмосферные фотоинициаторы
[ редактировать ]Пероксиды
[ редактировать ]
Поскольку молекулярный кислород может отрывать атомы H от определенных радикалов, легко образуется радикал HOO·. Этот конкретный радикал может дополнительно отрывать атомы H, создавая H 2 O 2 или перекись водорода; пероксиды могут дополнительно фотолитически расщепляться на два гидроксильных радикала. Чаще всего HOO может реагировать со свободными атомами кислорода с образованием гидроксильного радикала (·OH) и газообразного кислорода. В обоих случаях образующиеся радикалы ·OH могут служить для окисления органических соединений в атмосфере. [1]
- Н 2 О 2 → 2 ·ОН
- НО· + О → О 2 + ·ОН
- ·ОН + СН 4 → ·СН 3 + Н 2 О
Диоксид азота
[ редактировать ]
Диоксид азота также может фотолитически расщепляться фотонами с длиной волны менее 400 нм. [2] производство атомарного кислорода и оксида азота .
- НЕТ 2 → НЕТ + О
Атомарный кислород является высокореактивной разновидностью и может отделять атом H от чего угодно, включая воду.
- О + Н 2 О → 2 ·ОН
Диоксид азота можно регенерировать посредством реакции между некоторыми пероксисодержащими радикалами и NO.
- РОО· + НЕТ → НЕТ 2 + РО·
Молекулярный кислород
[ редактировать ]В стратосфере молекулярный кислород (O 2 ) является важным фотоинициатором, который начинает процесс образования озона в озоновом слое . Кислород может фотолизоваться в атомарный кислород светом с длиной волны менее 240 нм. [3]
- О 2 → 2О
Затем атомарный кислород может объединиться с большим количеством молекулярного кислорода, образуя озон.
- О + О 2 → О 3
Однако озон также может фотолизоваться обратно в O и О 2 .
- О3 → О + О2
Кроме того, атомарный кислород и озон могут объединяться в О 2 .
- О + О 3 → 2 О 2
Этот набор реакций управляет образованием озона и может быть объединен для расчета его равновесной концентрации.
Коммерческие фотоинициаторы и использование
[ редактировать ]АИБН
[ редактировать ]
Азобисизобутиронитрил представляет собой белый порошок, часто используемый в качестве фотоинициатора для полимеров на основе винила, таких как поливинилхлорид , также известный как ПВХ. Потому что именно этот фотоинициатор производит газообразный азот. (N 2 ) при разложении его часто используют в качестве пенообразователя для изменения формы и/или текстуры пластмасс.
Бензоил пероксид
[ редактировать ]
Пероксид бензоила, как и азобисизобутиронитрил, представляет собой белый порошок, используемый в качестве фотоинициатора в различных коммерческих и промышленных процессах, включая производство пластмасс. Однако, в отличие от AIBN, пероксид бензоила при разложении выделяет газообразный кислород, что дает этому соединению также множество медицинских применений. [4]
При контакте с кожей пероксид бензоила распадается, выделяя, среди прочего, газообразный кислород. Газообразный кислород впитывается в поры кожи, где он убивает вызывающую прыщи бактерию Cutibacterium Acnes .
Кроме того, образующиеся свободные радикалы могут разрушать омертвевшие клетки кожи. Очистка этих мертвых клеток предотвращает закупорку пор и, как следствие, появление прыщей. [5]
2,2-Диметокси-2-фенилацетофенон
[ редактировать ]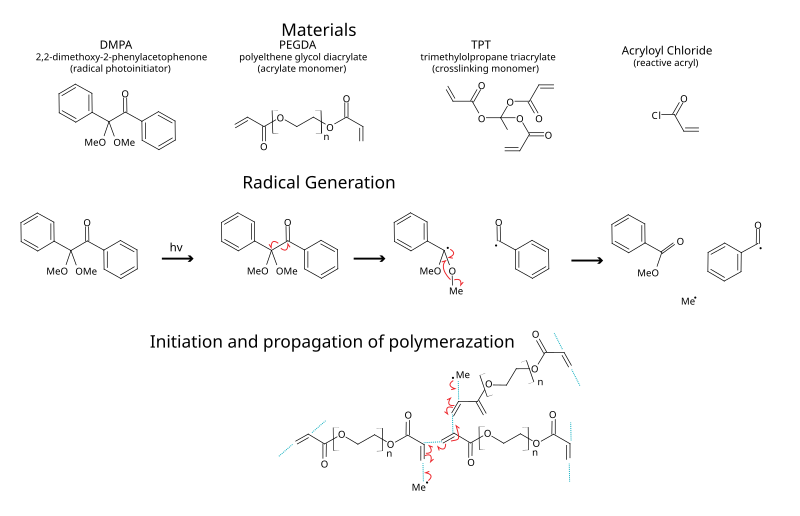
Камфорхинон
[ редактировать ]Камфорхинон (CQ) представляет собой фотосенсибилизатор, используемый с аминной системой, который генерирует первичные радикалы при световом облучении. Эти свободные электроны затем атакуют двойные связи мономеров смолы, что приводит к полимеризации. На физические свойства отвержденных смол влияет образование первичных радикалов на начальной стадии полимеризации.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ванЛун, стр. 52–53
- ^ ванЛун, стр. 74–79
- ^ ванЛун, стр. 48–49
- ^ «Перекись бензоила» , Chemicalland21.com, по состоянию на 29 октября 2009 г.
- ^ «Перекись бензоила». Архивировано 26 мая 2010 г. на Wayback Machine , http://www.about.com , по состоянию на 29 октября 2009 г.
- ^ Ляо К.К., Хоген-Эш Т., Ричмонд Ф.Дж., Марку Л., Клифтон В., Леб Г.Е. (2008). «Чрескожный оптоволоконный датчик для хронического мониторинга уровня глюкозы in vivo» (PDF) . Биосенс Биоэлектрон . 23 (10): 1458–65. дои : 10.1016/j.bios.2008.01.012 . ПМИД 18304798 . Архивировано из оригинала (PDF) 26 апреля 2012 г.
Библиография
[ редактировать ]- ванЛун, Гэри В.; Даффи, Стивен Дж. (2005). Химия окружающей среды: глобальная перспектива . Нью-Йорк, штат Нью-Йорк: Издательство Оксфордского университета. ISBN 0-19-927499-1 .