Окисление Баблера
Окисление Баблера , также известное как окисление Баблера-Даубена , представляет собой реакцию окислительного органическую транспозиции третичных аллильных спиртов в еноны с использованием хлорхромата пиридиния (PCC): [ 1 ]
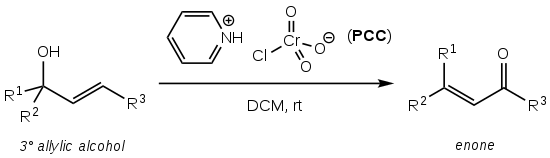
Он назван в честь Джеймса Бэблера, который впервые сообщил о реакции в 1976 году. [ 1 ] [ 2 ] и Уильям Добен, который в 1977 году расширил область применения циклических систем, тем самым значительно увеличив синтетическую полезность: [ 1 ] [ 3 ]

Реакция дает желаемый еноновый продукт с высоким выходом (обычно >75%), проста в эксплуатации и не требует безвоздушных технологий или нагрева. [ 1 ] Однако он страдает очень высокой токсичностью и опасностью для окружающей среды, которую представляет окислительный реагент шестивалентного хрома PCC.
Растворителем обычно является сухой дихлорметан (DCM) или хлороформ (CHCl 3 ). [ 1 ] [ 2 ]
Реакцию использовали как стадию полного синтеза различных соединений, например морфина . [ 1 ] [ 4 ]
Механизм
[ редактировать ]
Реакция протекает через образование сложного эфира хромовой кислоты ( 1 ) в результате нуклеофильной атаки хлорхромата аллиловым спиртом. Затем сложный эфир претерпевает [3,3]-сигматропный сдвиг с образованием изомерного сложного эфира хромовой кислоты ( 2 ). Наконец, окисление этого промежуточного продукта дает α,β-ненасыщенный альдегид или кетон ( 3 ). [ 1 ]
Альтернативные реагенты
[ редактировать ]Обеспокоенность по поводу высокой токсичности и канцерогенности окислителя PCC, а также роли разновидностей хрома (VI) как загрязнителей окружающей среды в подземных водах, привели к исследованиям по замене PCC в реакции. Одна успешная альтернатива, о которой сообщается из нескольких источников, включает использование солей N -оксоаммония, полученных из ТМП : [ 1 ] [ 5 ]
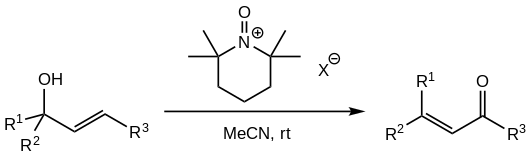
оксоаммониевые соли с некоординирующими анионами Используются (такими как тетрафторборат , перхлорат , гексафторфосфат или гексафторантимонат ). [ 5 ] Окислитель добавляют в стехиометрических количествах, обычно 1,5 экв. спирта.
Другой подход к минимизации использования токсичного хрома (VI) предполагает проведение реакции только с использованием каталитического количества PCC и избытка другого окислителя для повторного окисления частиц хрома как части каталитического цикла . Обычно используемые для этой цели стехиометрические реагенты включают ди- трет -бутилпероксид , 2-иодоксибензойную кислоту или периодаты . [ 1 ]
Вторичные спирты
[ редактировать ]Окисление Баблера-Даубена вторичных аллильных спиртов контролировать сложнее, чем третичных аналогов, так как наряду с целевым продуктом ( а смесь с высоким содержанием побочных продуктов ( б ) и ( в ): ) получается [ 1 ]
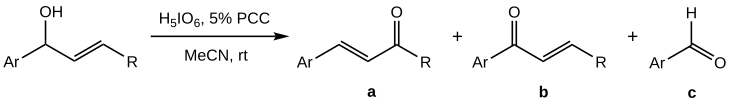
Обнаружено, что выход а максимизируется, когда PCC используется не в стехиометрических количествах, а в качестве соокислителя; Наилучший эффект (выход 50–70% а ) достигается при использовании ортопериодной кислоты как основного окислителя с 5%-м молярным содержанием ПКК. [ 1 ] ацетонитрил В качестве растворителя используется (MeCN) над обычным DCM.
Примечательно, что в отличие от общего окисления третичных спиртов, случай вторичного спирта работает только с ароматическими субстратами (Ar-: арильная группа). Это, наряду с сильнокислыми условиями из-за стехиометрического количества иодной кислоты, позволяет предположить, что первоначально образовавшийся сложный эфир хромовой кислоты изомеризуется по карбокатионному пути, а не по сигматотропной реакции, как в случае третичных спиртов. [ 1 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л Киллоран, Патрик М.; Россингтон, Стивен Б.; Уилкинсон, Джеймс А.; Хэдфилд, Джон А. (31 августа 2016 г.). «Расширение возможностей окисления Баблера-Даубена: 1,3-окислительная транспозиция вторичных аллильных спиртов» . Буквы тетраэдра . 57 (35): 3954–3957. дои : 10.1016/j.tetlet.2016.07.076 . ISSN 0040-4039 .
- ^ Jump up to: а б Баблер, Джеймс Х.; Коглан, Майкл Дж. (1 января 1976 г.). «Простой метод бишомологирования кетонов в α,β-ненасыщенные альдегиды: применение к синтезу циклогексаноидных компонентов полового аттрактанта долгоносика» . Синтетические коммуникации . 6 (7): 469–474. дои : 10.1080/00397917608082626 . ISSN 0039-7911 .
- ^ Добен, Уильям Г.; Мично, Дрейк М. (1 марта 1977 г.). «Прямое окисление третичных аллильных спиртов. Простой и эффективный метод алкилативной карбонильной транспозиции» . Журнал органической химии . 42 (4): 682–685. дои : 10.1021/jo00424a023 . ISSN 0022-3263 .
- ^ Нагата, Хироши; Миядзава, Норио; Огасавара, Кунио (1 января 2001 г.). «Краткий путь к (-)-морфину» . Химические коммуникации (12): 1094–1095. дои : 10.1039/B101668G . ISSN 1364-548X .
- ^ Jump up to: а б Сибуя, Масатоши; Томизава, Масаки; Ивабучи, Ёсихару (1 июня 2008 г.). «Окислительная перегруппировка третичных аллиловых спиртов с использованием оксоаммониевых солей» . Журнал органической химии . 73 (12): 4750–4752. дои : 10.1021/jo800634r . ISSN 0022-3263 . ПМИД 18500838 .