Гексафторфосфат
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК
Гексафторфосфат
| |||
| Систематическое название ИЮПАК | |||
| Другие имена
Гексафторфосфат(V)
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| КЭБ | |||
| ХЭМБЛ |
| ||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.111.656 | ||
| Номер ЕС |
| ||
| 2704 | |||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| [ПФ 6 ] − | |||
| Молярная масса | 144.964181 g/mol | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
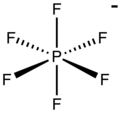
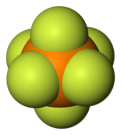
Гексафторфосфат представляет собой анион с химической формулой [ПФ 6 ] − . Это октаэдрический вид, который не придает цвет своим солям. [ПФ 6 ] − изоэлектронен серы гексафториду , SF 6 и гексафторсиликатный дианион, [СиФ 6 ] 2− и гексафторантимонат [СбФ 6 ] − . В этом анионе фосфор имеет валентность 5. Будучи плохо нуклеофильным , гексафторфосфат классифицируется как некоординирующий анион . [ 2 ] [ 3 ]
Синтез
[ редактировать ]
Гексафторфосфатные соли можно получить реакцией пентахлорида фосфора и галогенида щелочи или аммония в растворе плавиковой кислоты : [ 4 ]
- PCl 5 + MCl + 6 HF → M[PF 6 ] + 6 HCl
Гексафторфосфорную кислоту можно получить прямой реакцией фтористого водорода с пентафторидом фосфора . [ 5 ] Это сильная кислота Бренстеда , которая обычно образуется на месте непосредственно перед использованием.
- ПФ 5 + ВЧ → H[PF 6 ]
Эти реакции требуют специального оборудования для безопасного устранения опасностей, связанных с плавиковой кислотой и фтористым водородом.
Количественный анализ
[ редактировать ]несколько методов количественного анализа Разработано гексафторфосфат-иона. тетрафениларсония хлорид, [(C 6 H 5 ) 4 As]Cl использовался как для титриметрического [ 6 ] и гравиметрический [ 7 ] количественное определение гексафторфосфата. Оба эти определения зависят от образования гексафторфосфата тетрафениларсония:
- [(C 6 H 5 ) 4 As] + + [ПФ 6 ] − → [(C 6 H 5 ) 4 As][PF 6 ]
Гексафторфосфат также можно определить спектрофотометрически с ферроином . [ 8 ]
Реакции
[ редактировать ]Гидролиз в основных условиях протекает чрезвычайно медленно. [ 9 ] Кислотно-катализируемый гидролиз до фосфат- иона также протекает медленно. [ 10 ] Тем не менее, гексафторфосфат склонен к разложению с выделением фтористого водорода в ионные жидкости . [ 11 ]

Металлоорганический и неорганический синтез
[ редактировать ]Гексафторфосфат является распространенным противоанионом для катионных комплексов металлов . Это один из трех широко используемых некоординирующих анионов: гексафторфосфат, тетрафторборат. [БФ 4 ] − и перхлорат ClO - 4 . Из них гексафторфосфат-ион имеет наименьшую координирующую тенденцию. [ 12 ]
Соли гексафторфосфата можно получить реакцией гексафторфосфата серебра с галогенидными солями. Осаждение нерастворимого галогенида серебра помогает довести эту реакцию до завершения. Поскольку соли гексафторфосфата часто нерастворимы в воде, но растворимы в полярных органических растворителях, даже добавление гексафторфосфата аммония ( [NH 4 ][PF 6 ] ) в водных растворах многих органических и неорганических солей дает твердые осадки гексафторфосфатных солей. Одним из примеров является синтез солей родоцения : [ 13 ] Общее уравнение преобразования:
- RhCl 3 · n H 2 O + 2 C 5 H 6 + [NH 4 ][PF 6 ] → [( η 5 -C 5 H 5 ) 2 Rh][PF 6 ] + 2 HCl + [NH 4 ]Cl + n H 2 O
Гексафторфосфат тетракис(ацетонитрил)меди(I) получают добавлением гексафторфосфорной кислоты к суспензии оксида меди(I) в ацетонитриле: [ 14 ]
- Cu 2 O + 2 H[PF 6 ] + 8 CH 3 CN → 2 [Cu(CH 3 CN) 4 ][PF 6 ] + H 2 O
Гидролиз гексафторфосфатных комплексов
[ редактировать ]Хотя гексафторфосфат-ион обычно инертен и, следовательно, является подходящим противоионом , его сольволиз может быть индуцирован высокоэлектрофильными металлоцентрами. Например, трис( сольвенто ) родия. комплекс [( час 5 -C 5 Me 5 )Rh(Me 2 CO) 3 ][PF 6 ] 2 подвергается сольволизу при нагревании в ацетоне , образуя дифторфосфат- мостиковый комплекс. [( час 5 -C 5 Me 5 )Rh( μ -OPF 2 O) 3 Rh( η 5 -C 5 Me 5 )][PF 6 ] . [ 15 ] [ 16 ]
Приложения
[ редактировать ]Практическое использование иона гексафторфосфата обычно использует одно или несколько из следующих свойств: он является некоординирующим анионом ; что гексафторфосфатные соединения обычно растворимы в органических растворителях, особенно полярных , но имеют низкую растворимость в водных растворах ; или что он имеет высокую степень стабильности, включая устойчивость как к кислотному, так и к основному гидролизу .
Аккумуляторные батареи
[ редактировать ]Основное коммерческое использование гексафторфосфата — его литиевая соль — гексафторфосфат лития . Эта соль в сочетании с диметилкарбонатом является распространенным электролитом в коммерческих вторичных батареях, таких как литий-ионные элементы . В этом приложении используется высокая растворимость солей гексафторфосфата в органических растворителях и устойчивость этих солей к восстановлению катодом щелочного металла. [ 17 ] Поскольку ионы лития в этих батареях обычно присутствуют в виде координационных комплексов внутри электролита, [ 18 ] некоординационная природа иона гексафторфосфата также является полезным свойством для этих применений.
Ионные жидкости
[ редактировать ]ионные жидкости комнатной температуры, такие как гексафторфосфат 1-бутил-3-метилимидазолия (обычно обозначаемый сокращенно bmimPF 6 ). Были приготовлены [ 19 ] Преимущество анионного обмена в пользу некоординирующего аниона состоит в том, что образующаяся ионная жидкость обладает гораздо большей термической стабильностью. Хлорид 1-бутил-3-метилимидазолия разлагается до N -метилимидазола и 1-хлорбутана или до N -бутилимидазола и хлорметана . Такое разложение невозможно для bmimPF 6 . термические разложения гексафторфосфатных ионных жидкостей с образованием газообразного фторида водорода . Однако известны [ 11 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б «Гексафторфосфат(1-) (CHEBI:30201)» . Химические соединения биологического интереса (ХЭБИ) . Великобритания: Европейский институт биоинформатики.
- ^ Дэвис, Дж. А. (1996). Синтетическая координационная химия: принципы и практика . Всемирная научная. п. 165. ИСБН 981-02-2084-7 .
- ^ Констант, С.; Лакур, Дж. (2005). Ж.-П. Майораль (ред.). Новые тенденции в химии гексакоординированного фосфора . Новые аспекты в химии фосфора. Том. 5. Спрингер. п. 3. ISBN 3-540-22498-Х .
- ^ Войский, ММ (1950). «Гексафлуофосфаты натрия, аммония и калия». Неорганические синтезы . Том. 3. С. 111–117. дои : 10.1002/9780470132340.ch29 . ISBN 9780470132340 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Мольнар, А.; Сурья Пракаш, ГК; Соммер, Дж. (2009). Химия суперкислот (2-е изд.). Уайли-Интерсайенс. п. 44. ИСБН 978-0-471-59668-4 .
- ^ Аффспрунг, HE; Арчер, В.С. (1963). «Определение гексафторфосфата амперометрическим титрованием хлоридом тетрафениларсония». Анальный. хим. 35 (8): 976–978. дои : 10.1021/ac60201a017 .
- ^ Аффспрунг, HE; Арчер, В.С. (1963). «Гравиметрическое определение гексафторфосфата как гексафторфосфата тетрафениларсония». Анальный. Хим . 35 (12): 1912–1913. дои : 10.1021/ac60205a036 .
- ^ Арчер, В.С.; Дулитл, Ф.Г. (1967). «Спектрофотометрическое определение гексафторфосфата с ферроином». Анальный. Хим . 39 (3): 371–373. дои : 10.1021/ac60247a035 .
- ^ Ryss, I. G.; Tulchinskii, V. B. (1964). "Kinetika Gidroliza Iona Geksaftorofosfata PF −
6 ". Ж. Неорг. Хим . 9 (4): 836–840. - ^ Гебала, А.Е.; Джонс, ММ (1969). «Кислотно-катализируемый гидролиз гексафторфосфата». Дж. Неорг. Нукл. хим. 31 (3): 771–776. дои : 10.1016/0022-1902(69)80024-2 .
- ^ Jump up to: а б Дайсон, Пи Джей (2005). Гельдбах, Ти Джей (ред.). Реакции, катализируемые металлами, в ионных жидкостях . Катализ металлокомплексами. Том. 29. Спрингер Наука и Бизнес. п. 27. ISBN 1-4020-3914-Х .
- ^ Мэйфилд, ХГ; Бык, МЫ (1971). «Координационные тенденции иона гексафторфосфата». Дж. Хим. Соц. А (14): 2279–2281. дои : 10.1039/J19710002279 .
- ^ Багхерст, ДР; Мингос, DMP ; Уотсон, MJ; Уотсон, Майкл Дж. (1989). «Применение эффектов нагревания СВЧ-диэлектрических потерь для быстрого и удобного синтеза металлоорганических соединений». Дж. Органомет. хим. 368 (3): C43–C45. дои : 10.1016/0022-328X(89)85418-X .
- ^ Кубас, Г.Дж. (1979). «Тетракис (ацетонитирил) меди (I) гексафторрофосфат». Неорг. Синтез. 19 : 90–91. дои : 10.1002/9780470132593.ch15 .
- ^ Томпсон, С.Дж.; Бейли, премьер-министр; Уайт, К.; Питер Мейтлис (1976). «Сольволиз иона гексафторфосфата и структура [трис (μ-дифторфосфат) бис (пентаметилциклопентадиенилродия)] гексафторфосфата». Энджью. хим. Межд. Эд. 15 (8): 490–491. дои : 10.1002/anie.197604901 .
- ^ Уайт, К.; Томпсон, С.Дж.; Питер Мейтлис (1977). «Комплексы пентаметилциклопентадиенилродия и -иридия XIV. Сольволиз координированных видов растворителя ацетона до трис( μ -дифторфосфато)бис[ η 5 -пентаметилциклопентадиенилродий(III)] Гексафторфосфат, к η 5 -(2,4-диметил-1-оксапента-1,3-диенил)(пентаметилциклопентадиенил)иридий катион, или η 5 -(2-гидрокси-4-метилпентадиенил)( η 5 Катион -пентаметилциклопентадиенил)иридия». Журнал металлоорганической химии . 134 (3): 319–325. doi : 10.1016/S0022-328X(00)93278-9 .
- ^ Гуденаф, Джей Би; Ким, Ю. (2010). «Проблемы с литиевыми аккумуляторами». хим. Матер. 22 (3): 587–603. дои : 10.1021/cm901452z .
- ^ «Паспорт безопасности: Литий-ионные батареи National Power Corp» (PDF) . tek.com . Tektronix Inc., 7 мая 2004 г. Архивировано из оригинала (PDF) 26 июня 2011 г. . Проверено 11 июня 2010 г.
- ^ Гордон, CM; Джон Д. Холбри; Алан Р. Кеннеди; Кеннет Р. Седдон (1998). «Ионные жидкие кристаллы: гексафторфосфатные соли». Журнал химии материалов . 8 (12): 2627–2636. дои : 10.1039/a806169f .