Уравнение Ван 'т-Гоффа
Уравнение Ван'т-Гоффа связывает изменение равновесия константы K eq химической реакции с изменением T температуры при стандартном энтальпии изменении Δ r H. ⊖ , для процесса. Индекс означает «реакция», а верхний индекс означает «стандартный». Он был предложен голландским химиком Якобусом Хенрикусом ван 'т Хоффом в 1884 году в его книге «Этюды де динамической химии» ( «Исследования по динамической химии »). [ 1 ]
Уравнение Ван'т-Гоффа широко использовалось для исследования изменений функций состояния в термодинамической системе . График Ван'т-Гоффа , полученный на основе этого уравнения, особенно эффективен при оценке изменения энтальпии и энтропии реакции химической .
Уравнение
[ редактировать ]Резюме и использование
[ редактировать ]давление Стандартное , , используется для определения эталонного состояния для уравнения Ван 'т-Гоффа, которое [ 2 ] [ 3 ]
где ln обозначает натуральный логарифм , – константа термодинамического равновесия , а R – постоянная идеального газа . Это уравнение является точным при любой температуре и всех давлениях и выведено из требования, чтобы свободная энергия реакции Гиббса была стационарной в состоянии химического равновесия .
На практике уравнение часто интегрируется между двумя температурами в предположении, что стандартная энтальпия реакции постоянна (и более того, ее также часто считают равной ее значению при стандартной температуре ). Поскольку на самом деле и стандартная энтропия реакции меняются в зависимости от температуры для большинства процессов, [ 4 ] интегрированное уравнение является лишь приближенным. На практике также производятся аппроксимации коэффициентов активности в пределах константы равновесия.
Основное использование интегрированного уравнения состоит в том, чтобы оценить новую константу равновесия при новой абсолютной температуре, предполагая постоянное стандартное изменение энтальпии во всем температурном диапазоне. Чтобы получить интегральное уравнение, удобно сначала переписать уравнение Ван 'т-Гоффа в виде [ 2 ]
определенный интеграл между температурами T 1 и T 2 Тогда равен
В этом уравнении K 1 представляет собой константу равновесия при абсолютной температуре T 1 , а K 2 представляет собой константу равновесия при абсолютной температуре T 2 .
Развитие термодинамики
[ редактировать ]Объединив известную формулу для свободной энергии реакции Гиббса
где S - энтропия системы с уравнением изотермы свободной энергии Гиббса: [ 5 ]
мы получаем
Дифференцирование этого выражения по переменной T в предположении, что оба и не зависят от T, дает уравнение Ван 'т-Гоффа. Ожидается, что эти предположения несколько нарушатся при больших изменениях температуры.
При условии, что и постоянны, предыдущее уравнение дает ln K как линейную функцию от 1 / T и, следовательно, известен как линейная форма уравнения Ван 'т-Гоффа. Следовательно, когда диапазон температур достаточно мал, и стандартная энтальпия реакции и энтропия реакции практически постоянны, график зависимости натурального логарифма константы равновесия от обратной температуры представляет собой прямую линию. Наклон линии можно умножить на газовую константу R, чтобы получить стандартное изменение энтальпии реакции, а точку пересечения можно умножить на R, чтобы получить стандартное изменение энтропии .
Изотерма Ван 'т-Гоффа
[ редактировать ]Изотерму Ван 'т-Гоффа можно использовать для определения температурной зависимости свободной энергии Гиббса реакции для реакций нестандартного состояния при постоянной температуре: [ 6 ]
где – свободная энергия Гиббса реакции в нестандартных состояниях при температуре , свободная энергия Гиббса для реакции при , – степень реакции , а Q r – термодинамический коэффициент реакции . С температурная зависимость обоих членов может быть описана уравнениями Ван-т'Гоффа как функция T . Это находит применение в области электрохимии . особенно при изучении температурной зависимости гальванических элементов.
Изотерму также можно использовать при фиксированной температуре для описания закона действия масс . Когда реакция находится в равновесии , Q r = K eq и . В противном случае изотерма Ван'т-Гоффа предсказывает направление, в котором система должна сместиться, чтобы достичь равновесия; когда ∆rG . , < 0 движется в прямом направлении, тогда как когда ∆rG реакция , > 0 реакция движется в обратном направлении См. Химическое равновесие .
Сюжет Ван'т-Гоффа
[ редактировать ]Для обратимой реакции константу равновесия можно измерить при различных температурах. Эти данные можно отобразить на графике с ln K eq по оси y и 1 / T по оси x . Данные должны иметь линейную зависимость, уравнение которой можно найти, подобрав данные с помощью линейной формы уравнения Ван 'т-Гоффа.
Этот график называется «графиком Ван'т-Гоффа» и широко используется для оценки энтальпии и энтропии реакции химической . Из этого сюжета — Δ r H / R — наклон, а Δ r S / R — это точка пересечения линейной аппроксимации.
Измеряя равновесия константу K eq при различных температурах, график Ван-т-Гоффа можно использовать для оценки реакции при изменении температуры. [ 7 ] [ 8 ] Зная наклон и точку пересечения графика Ван 'т-Гоффа, энтальпию и энтропию реакции можно легко получить, используя
График Ван'т-Гоффа можно использовать для быстрого определения энтальпии химической реакции как качественно, так и количественно. Это изменение энтальпии может быть положительным или отрицательным, что приводит к двум основным формам графика Ван 'т-Гоффа.
Эндотермические реакции
[ редактировать ]
При эндотермической реакции тепло поглощается, в результате чего чистое изменение энтальпии становится положительным. Таким образом, согласно определению уклона:
Когда реакция эндотермическая , Δ r H > 0 (и газовая постоянная R > 0 ), поэтому
Таким образом, для эндотермической реакции график Ван'т-Гоффа всегда должен иметь отрицательный наклон.
Экзотермические реакции
[ редактировать ]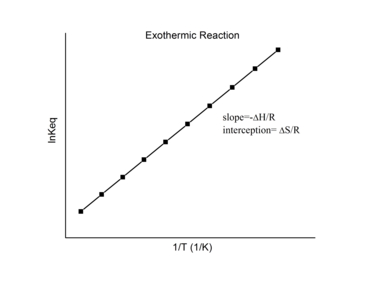
При экзотермической реакции выделяется тепло, в результате чего изменение чистой энтальпии становится отрицательным. Таким образом, согласно определению уклона:
Для экзотермической реакции Δ r H < 0 , поэтому
Таким образом, для экзотермической реакции график Ван'т-Гоффа всегда должен иметь положительный наклон.
Распространение ошибок
[ редактировать ]На первый взгляд, используя тот факт, ∆r что G ⊖ = − RT ln K = Δ r H ⊖ − Т Δ р С ⊖ кажется, что двух измерений K будет достаточно, чтобы получить точное значение Δ r H ⊖ :
где К 1 и К 2 - значения констант равновесия, полученные при температурах Т 1 и Т 2 соответственно. Однако точность Δ r H ⊖ Значения, полученные таким способом, сильно зависят от точности измеренных значений констант равновесия.
Использование распространения ошибок показывает, что ошибка в Δ r H ⊖ будет примерно в 76 кДж/моль, умноженной на экспериментальную неопределенность в (ln K 1 - ln K 2 ) , или примерно на 110 кДж/моль, умноженную на неопределенность в ln K. значениях Аналогичные соображения применимы и к энтропии реакции, полученной из Δ r S ⊖ = 1 / Т (Δ H ⊖ + RT ln K ) .
Примечательно, что когда константы равновесия измеряются при трех или более температурах, значения Δ r H ⊖ и ΔrS ⊖ часто получаются прямой аппроксимацией . [ 9 ] Ожидается, что эта процедура уменьшит ошибку, хотя предположение о том, что энтальпия и энтропия реакции постоянны, может оказаться, а может и не оказаться верным. Если существует значительная температурная зависимость одной или обеих величин, это должно проявляться в нелинейном поведении на графике Ван 'т-Гоффа; однако для наблюдения за этим предположительно потребуется более трех точек данных.
Применение графика Ван'т-Гоффа
[ редактировать ]Анализ Ван 'т-Гоффа
[ редактировать ]
В биологических исследованиях график Ван'т-Гоффа также называют анализом Ван'т-Гоффа. [ 10 ] Он наиболее эффективен при определении предпочтительного продукта реакции. Он может давать результаты, отличные от результатов прямой калориметрии, таких как дифференциальная сканирующая калориметрия или изотермическая титровальная калориметрия, из-за различных эффектов, помимо экспериментальной ошибки. [ 11 ]
Предположим, что в реакции образуются два продукта B и C:
- а А + d D → б B,
- а А + d D → с C.
В этом случае K eq можно определить как отношение B к C, а не как константу равновесия.
Когда B / C > 1, B — предпочтительный продукт, а данные на графике Ван’т-Гоффа будут в положительной области.
Когда B / C < 1, C – предпочтительный продукт, а данные на графике Ван’т-Гоффа будут находиться в отрицательной области.
Используя эту информацию, анализ Ван 'т-Гоффа может помочь определить наиболее подходящую температуру для предпочтительного продукта.
В 2010 году анализ Ван 'т-Гоффа был использован для определения того, образует ли вода преимущественно связь с C -концом или N -концом аминокислоты водородную пролина. [ 12 ] Константа равновесия для каждой реакции была найдена при различных температурах и построен график Ван 'т-Гоффа. Этот анализ показал, что энтальпически вода предпочитала водородную связь с С -концом, но энтропийно она была более благоприятна для водородной связи с N -концом. В частности, они обнаружили, что водородная связь на С -конце благоприятствует 4,2–6,4 кДж/моль. Образование водородной связи на N -конце благоприятствует 31–43 Дж/(К моль).
Сами по себе эти данные не могли сделать вывод, с каким местом вода будет преимущественно образовывать водородную связь, поэтому были использованы дополнительные эксперименты. Было установлено, что при более низких температурах предпочтение отдается энтальпийно предпочтительному виду, воде, связанной водородными связями с С -концом. При более высоких температурах предпочтение отдавалось энтропийно предпочтительному виду — воде, связанной водородными связями с N -концом.
Механистические исследования
[ редактировать ]
Химическая реакция может проходить по разным механизмам при разных температурах. [ 13 ]
В этом случае можно использовать график Ван 'т-Гоффа с двумя или более линейными аппроксимациями. Каждая линейная аппроксимация имеет разный наклон и точку пересечения, что указывает на разные изменения энтальпии и энтропии для каждого отдельного механизма. График Ван 'т-Гоффа можно использовать для определения изменения энтальпии и энтропии для каждого механизма и предпочтительного механизма при различных температурах.
На рисунке в качестве примера реакция протекает по механизму 1 при высокой температуре и по механизму 2 при низкой температуре.
Температурная зависимость
[ редактировать ]
Если энтальпия и энтропия примерно постоянны при изменении температуры в определенном диапазоне, то график Ван 'т-Гоффа является примерно линейным, если построить его в этом диапазоне. Однако в некоторых случаях энтальпия и энтропия резко изменяются с температурой. Приближение первого порядка состоит в том, чтобы предположить, что два разных продукта реакции имеют разную теплоемкость. Учет этого предположения дает дополнительный член с / Т 2 в выражении для константы равновесия как функции температуры. Затем можно использовать полиномиальную аппроксимацию для анализа данных, которые демонстрируют непостоянную стандартную энтальпию реакции: [ 14 ]
где
Таким образом, энтальпию и энтропию реакции все же можно определить при определенных температурах, даже если существует температурная зависимость.
Самосборка поверхностно-активного вещества
[ редактировать ]Соотношение Ван-т-Гоффа особенно полезно для определения мицеллообразования энтальпии Δ H. ⊖
м ПАВ ( из температурной зависимости критической концентрации мицеллообразования ККМ):
Однако соотношение теряет свою силу, если число агрегации также зависит от температуры, и вместо него следует использовать следующее соотношение: [ 15 ]
где G N + 1 и G N — свободная энергия ПАВ в мицелле с числом агрегации N + 1 и N соответственно. Этот эффект особенно актуален для неионогенных этоксилированных поверхностно-активных веществ. [ 16 ] или блок-сополимеры полиоксипропилена и полиоксиэтилена (Poloxamers, Pluronics, Synperonics). [ 17 ] Расширенное уравнение можно использовать для извлечения чисел агрегации самоорганизующихся мицелл из термограмм дифференциальной сканирующей калориметрии . [ 18 ]
См. также
[ редактировать ]- Отношение Клаузиуса – Клапейрона
- Фактор Ван 'т-Гоффа ( i )
- Уравнение Гиббса – Гельмгольца
- Равновесие растворимости
- уравнение Аррениуса
Ссылки
[ редактировать ]- ^ Биография на сайте Нобелевской премии . Nobelprize.org (1 марта 1911 г.). Проверено 8 ноября 2013 г.
- ^ Jump up to: а б Аткинс, Питер; Де Паула, Хулио (10 марта 2006 г.). Физическая химия (8-е изд.). WH Фриман и компания. п. 212 . ISBN 978-0-7167-8759-4 .
- ^ Айвз, DJG (1971). Химическая термодинамика . Университетская химия. Макдональд Технический и научный. ISBN 978-0-356-03736-3 .
- ^ Крейг, Норман (1996). «Энтропийные диаграммы». Дж. Хим. Образование . 73 (8): 710. Бибкод : 1996JChEd..73..710C . дои : 10.1021/ed073p710 .
- ^ Дикерсон, Р.Э.; Гейс, И. (1976). Химия, материя и Вселенная . штата Вашингтон Бенджамин Инк. США: ISBN 978-0-19-855148-5 .
- ^ Монк, Пол (2004). Физическая химия: понимание нашего химического мира . Уайли. п. 162 . ISBN 978-0471491811 .
- ^ Ким, Тэ У (2012). «Динамическая [2] катенация самособирающихся макроциклов Pd (II) в воде». хим. Летт . 41:70 . дои : 10.1246/cl.2012.70 .
- ^ Итикава, Такаюки (2010). «Термодинамические свойства амидов металлов, определяемые изотермами состава аммиака от давления» (PDF) . Дж. Хим. Термодинамика . 42 : 140. doi : 10.1016/j.jct.2009.07.024 .
- ^ Чанг, Раймонд; Томан-младший, Джон В. (2014). Физическая химия для химических наук . США: Университетские научные книги. стр. 322–325. ISBN 978-1-891389-69-6 .
- ^ «Анализ Ван'т-Гоффа» . Группа анализа и дизайна белков.
- ^ Купер, Алан (2018), Робертс, Гордон; Уоттс, Энтони (ред.), «Анализ Вант-Гоффа и скрытые термодинамические переменные» , Энциклопедия биофизики , Берлин, Гейдельберг: Springer, стр. 1–4, номер документа : 10.1007/978-3-642-35943-9_10066- 1 , ISBN 978-3-642-35943-9 , получено 4 июля 2023 г.
- ^ Прелл, Джеймс; Уильямс Э. (2010). «Энтропия перемещает присоединенную молекулу воды от C -к N -концу протонированного пролина». Дж. Ам. хим. Соц . 132 (42): 14733–5. дои : 10.1021/ja106167d . ПМИД 20886878 .
- ^ Чатаке, Тосиюки (2010). «Подход к кристаллизации ДНК с использованием термообратимого процесса дуплексов ДНК». Крист. Рост Дес . 10 (3): 1090. doi : 10.1021/cg9007075 .
- ^ Дэвид, Виктор (28 апреля 2011 г.). «Отклонение от зависимости Ван 'т-Гоффа в RP-LC, вызванное таутомерным взаимопревращением, наблюдается для четырех соединений». Журнал науки о разделении . 34 (12): 1423–8. дои : 10.1002/jssc.201100029 . ПМИД 21538875 .
- ^ Хольцер, Альфред; Хольцер, Мэрилин Ф. (1 мая 2002 г.). «Использование соотношения Ван 'т-Гоффа для определения энтальпии образования мицелл». Журнал физической химии . 78 (14): 1442–1443. дои : 10.1021/j100607a026 .
- ^ Херклотц, Хейко; Цамалукас, Алекос; Кита-Токарчик, Катажина; Струнц, Павел; Гутберлет, Томас (25 ноября 2004 г.). «Структурная, объемная и термодинамическая характеристика перехода мицеллярной сферы в стержень». Журнал Американского химического общества . 126 (50): 16544–16552. дои : 10.1021/ja045525w . ПМИД 15600359 .
- ^ Табоада, Пабло; Москера, Виктор; Эттвуд, Дэвид; Ян, Чжо; Бут, Колин (5 июня 2003 г.). «Энтальпия мицеллообразования диблок-сополи (оксиэтилен/оксипропилен) методом изотермической титровальной калориметрии. Сравнение со значением Ван 'т-Гоффа». Физическая химия Химическая физика . 5 (12): 2625–2627. Бибкод : 2003PCCP....5.2625T . дои : 10.1039/b303108j .
- ^ Кьяппизи, Леонардо; Лаццара, Джузеппе; Градзельски, Майкл; Милиото, Стефана (6 декабря 2012 г.). «Количественное описание термограмм самоагрегации, вызванной температурой, определенных методом дифференциальной сканирующей калориметрии» (PDF) . Ленгмюр . 28 (51): 17609–17616. дои : 10.1021/la303599d . hdl : 10447/96872 . ПМИД 23171124 .

























![{\displaystyle {\begin{aligned}\Delta _{r}H_{1}&=-R\times {\text{slope}}_{1},&\Delta _{r}S_{1}&= R\times {\text{intercept}}_{1};\\[5pt]\Delta _{r}H_{2} &=-R\times {\text{наклон}}_{2},&\Delta _{r}S_{2}&=R\times {\text{intercept}}_{2}.\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b7e4e668b82b9ee277ed6bf1aaae55cb12f15a8)



