Ионы металлов в водном растворе
Ион металла в водном растворе или акваион — это катион растворенный в воде химической формулы [M(H 2 O) n ] г+ . Число сольватации , n определенное различными экспериментальными методами, равно 4 для Li. + и быть 2+ и 6 для большинства элементов в периодах 3 и 4 периодической таблицы . Аква-ионы лантаноидов и актинидов имеют более высокие числа сольватации (часто от 8 до 9), причем самое высокое известное значение составляет 11 для Ac. 3+ . Прочность связей между ионом металла и молекулами воды в первичной сольватной оболочке увеличивается с ростом электрического заряда z на ионе металла и уменьшается с увеличением его ионного радиуса r . Аква-ионы подвержены гидролизу. Логарифм первой константы гидролиза пропорционален z 2 / r для большинства акваионов.
Аква-ион связан посредством водородных связей с другими молекулами воды во вторичной сольватной оболочке. Молекулы воды в первой гидратной оболочке обмениваются с молекулами второй сольватной оболочки и молекулами в объеме жидкости. Время пребывания молекулы в первой оболочке варьируется у разных химических элементов от примерно 100 пикосекунд до более 200 лет. Аква-ионы играют важную роль в электрохимии .
Знакомство с акваионами металлов
[ редактировать ]Элементы, образующие аквакатионы ЧАС Он Что Быть Б С Н ТО Ф Ne Уже мг Ал И П С кл. С К Что наук Из V Кр Мин. Фе Ко В С Зн Здесь Ге* Как Се Бр НОК руб. старший И Зр Нб Мо Тс Ру резус ПД В компакт-диск В Сн Сб* Te я Машина Cs Нет La Этот Пр Нд вечера см Евросоюз Б-г Тб Те К Является Тм Ыб Лу хф Облицовка В Ре Ты И Пт В ртуть Тл Pb С Po* В* Рн Пт* День* И че Хорошо В Например Мог Являюсь См Бк См. Является* Фм* Мд* Нет* Лр* РФ ДБ Сг Бх Хс гора Дс Рг Сп Нх В Мак Лев Ц И
- * Нет экспериментальной информации о структурах акваионов.
Большинство химических элементов являются металлическими . Соединения металлических элементов обычно образуют простые акваионы формулы [M(H 2 O) n ] г+ в низких степенях окисления . При более высоких степенях окисления простые акваионы диссоциируют, теряя ионы водорода с образованием комплексов, которые содержат как молекулы воды, так и ионы гидроксида или оксида, такие как соединения ванадия (IV) [VO(H 2 O) 5 ] 2+ . В высших степенях окисления только оксианионы , такие как ион перманганата (VII), MnO. −
4 , известны. Некоторые металлические элементы, которые обычно встречаются только в высоких степенях окисления, такие как ниобий и тантал , не образуют аква-катионы; вблизи границы металл-неметалл мышьяк и теллур известны только как гидролизованные соединения. Некоторые элементы, такие как олово и сурьма , явно являются металлами, но образуют только ковалентные соединения в высших степенях окисления: их аква-катионы ограничены их более низкими степенями окисления. [1] Германий является скорее полупроводником, чем металлом, но, по-видимому, образует аквакатион; Точно так же водород образует аквакатион, как и металлы, несмотря на то, что он является газом. Трансактиниды выделены серым цветом из - за отсутствия экспериментальных данных. Для некоторых высокорадиоактивных элементов была проведена экспериментальная химия, и, возможно, образовались аква-катионы, но нет экспериментальной информации о структуре этих предполагаемых аква-ионов.


Говорят, что в водном растворе молекулы воды, непосредственно связанные с ионом металла, принадлежат первой координационной сфере , также известной как первая или первичная сольватная оболочка. Связь между молекулой воды и ионом металла представляет собой дативную ковалентную связь , при которой атом кислорода отдает на связь оба электрона. Каждая координированная молекула воды может быть присоединена водородными связями к другим молекулам воды. Говорят, что последние находятся во второй координационной сфере. Вторая координационная сфера не является четко определенным объектом для ионов с зарядом 1 или 2. В разбавленных растворах она сливается со структурой воды, в которой существует нерегулярная сеть водородных связей между молекулами воды. [2] В случае триположительных ионов высокий заряд катиона поляризует молекулы воды в первой сольватной оболочке до такой степени, что они образуют достаточно прочные водородные связи с молекулами во второй оболочке, чтобы сформировать более стабильное образование. [3]
Прочность связи металл-кислород можно оценить различными способами. Энтальпия гидратации, хотя и основана косвенно на экспериментальных измерениях, является наиболее надежным показателем. Шкала значений основана на произвольно выбранном нуле, но это не влияет на различия между значениями для двух металлов. Другие меры включают частоту колебаний M–O и длину связи M–O. Прочность связи МО имеет тенденцию увеличиваться с увеличением заряда и уменьшаться по мере увеличения размера иона металла. Фактически существует очень хорошая линейная корреляция между энтальпией гидратации и отношением квадрата заряда к ионному радиусу z. 2 /р. [4] Для ионов в растворе наиболее часто используемой мерой является «эффективный ионный радиус» Шеннона. [5]
Молекулы воды в первой и второй сольватных оболочках могут меняться местами. Скорость обмена сильно варьируется в зависимости от металла и степени его окисления. Акваионы металлов всегда сопровождаются в растворе сольватированными анионами, но о сольватации анионов известно гораздо меньше, чем о сольватации катионов. [6]
Пониманию природы акваионов помогает информация о природе сольватированных катионов в смешанных растворителях. [7] и неводные растворители , такие как жидкий аммиак , метанол , диметилформамид и диметилсульфоксид , и это лишь некоторые из них. [8]
Встречаемость в природе
[ редактировать ]Аква-ионы присутствуют в большинстве природных вод. [9] Уже + , К + , мг 2+ и Ca 2+ являются основными компонентами морской воды .
Аква-ионы в морской воде ( соленость = 35) Ион Уже + К + мг 2+ Что 2+ Концентрация
(моль кг −1 )0.469 0.0102 0.0528 0.0103
Многие другие аква-ионы присутствуют в морской воде в концентрациях от ppm до ppt . [9] Концентрации натрия, калия, магния и кальция в крови аналогичны концентрациям в морской воде. В крови также более низкие концентрации таких важных элементов , как железо и цинк. Спортивный напиток изотоничен с и содержит минералы, которые теряются потом .
Ионы магния и кальция являются обычными компонентами бытовой воды и отвечают за постоянную и временную жесткость соответственно. Они часто встречаются в минеральной воде .
Экспериментальные методы
[ редактировать ]Полученная информация о природе ионов в растворе зависит от характера используемого экспериментального метода. Некоторые методы непосредственно выявляют свойства катиона, другие — свойства, зависящие как от катиона, так и от аниона. Некоторые методы дают информацию статического характера, своего рода снимок усредненных свойств, другие дают информацию о динамике решения.
Ядерный магнитный резонанс (ЯМР)
[ редактировать ]Ионы, для которых скорость водообмена медленна в шкале времени ЯМР, дают отдельные пики для молекул в первой сольватной оболочке и для других молекул воды. Число сольватации получают как отношение площадей пиков. Здесь речь идет о количестве молекул воды в первой сольватной оболочке. Молекулы во второй сольватной оболочке быстро обмениваются с молекулами растворителя, что приводит к небольшому изменению значения химического сдвига некоординированных молекул воды по сравнению со значением самой воды. Основным недостатком этого метода является то, что он требует достаточно концентрированных растворов, что связано с риском образования ионной пары с анионом.
| Ион | Быть 2+ | мг 2+ | Ал 3+ | Здесь 3+ | В 3+ | Фе 2+ | Ко 2+ | В 2+ | Зн 2+ | че 4+ |
|---|---|---|---|---|---|---|---|---|---|---|
| Число | 4 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 9 |
| Ядро | 1 ЧАС 17 ТО | 1 ЧАС | 1 ЧАС | 1 ЧАС 17 ТО | 1 ЧАС | 17 ТО | 1 ЧАС | 1 ЧАС 17 ТО | 1 ЧАС | 1 ЧАС |
Рентгеновская дифракция (XRD)
[ редактировать ]Раствор, содержащий акваион, не имеет дальнего порядка, который присутствовал бы в кристалле, содержащем тот же ион, но есть ближний порядок. Дифракция рентгеновских лучей на растворах дает функцию радиального распределения , из которой можно определить координационное число иона металла и расстояние металл-кислород. Для акваионов с большим зарядом получается некоторая информация о второй сольватной оболочке. [11] [12]
Этот метод требует использования относительно концентрированных растворов. Рентгеновские лучи рассеиваются электронами, поэтому сила рассеяния увеличивается с увеличением атомного номера. Это делает атомы водорода практически невидимыми для рассеяния рентгеновских лучей.
Рассеяние рентгеновских лучей под большим углом было использовано для характеристики второй сольватной оболочки с трехвалентными ионами, такими как Cr. 3+ и резус 3+ . Вторая гидратная оболочка Cr 3+ Было обнаружено, что он имеет 13 ± 1 молекулу на среднем расстоянии 402 ± 20 пм . Это означает, что каждая молекула в первой гидратной оболочке связана водородной связью с двумя молекулами во второй оболочке. [13]
Нейтронная дифракция
[ редактировать ]Дифракция на нейтронах также дает радиальную функцию распределения . В отличие от дифракции рентгеновских лучей, нейтроны рассеиваются ядрами и связи с атомным номером нет. [14] Действительно, можно воспользоваться тем фактом, что разные изотопы одного и того же элемента могут иметь совершенно разную рассеивающую способность. В классическом эксперименте измерения проводились на четырех растворах хлорида никеля с использованием комбинаций 58 В, 60 В, 35 кл и 37 Изотопы Cl дают очень подробную картину сольватации катионов и анионов. [15] Данные для ряда солей металлов показывают некоторую зависимость от концентрации соли.
| Соль | LiCl | СаСl 2 | NiCl 2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Моляльность соли | 27.77 | 9.95 | 3.57 | 4.49 | 2.80 | 1.0 | 3.05 | 0.85 | 0.46 | 0.086 |
| Число гидратации катиона † | 2.3 (2) | 3.0 (5) | 5.5 (3) | 6.4 (3) | 7.2 (2) | 10.0 (6) | 5.8 (2) | 6.6 (5) | 6.8 (8) | 6.8 (8) |
| θ / град ‡ | 75 (5) | 52 (5) | 40 (5) | 34 (9) | 34 (9) | 38 (9) | 42 (8) | 27 (10) | 17 (10) | 0 (20) |
| Соль | Ni(ClO 4 ) 2 | Cu(ClO 4 ) 2 | Fe( NO3 ) 3 | NdCl 3 | DyClDyCl3 |
|---|---|---|---|---|---|
| Моляльность соли | 3.80 | 2.00 | 2.0 | 2.85 | 2.38 |
| Число гидратации катиона † | 5.8 (2) | 4.9 (3) | 5.0 (2) | 8.5 (2) | 7.4 (5) |
| θ / град ‡ | 42 (8) | 38 (6) | 22 (4) | 24 (4) | 17 (3) |
- † Цифры в скобках представляют собой стандартные отклонения последней значащей цифры значения. ‡ угол между связью М-ОН 2 и плоскостью молекулы воды.
Большая часть этих данных относится к концентрированным растворам, в которых очень мало молекул воды, не находящихся в первичных гидратных сферах катиона или аниона, что может объяснить некоторое изменение числа сольватации с концентрацией, даже если нет контактного иона. спаривание. Угол θ дает угол наклона молекул воды относительно плоскости в акваионе. На этот угол влияют водородные связи, образующиеся между молекулами воды в первичной и вторичной сольватных оболочках.
Измеренное сольватное число представляет собой усредненное по времени значение для раствора в целом. Когда измеренное первичное число сольватации является дробным, существуют два или более вида с целыми числами сольватации, присутствующими в равновесии друг с другом. Это также относится к числам сольватации, которые являются целыми числами в пределах экспериментальной ошибки. Например, сольватное число 5,5 для раствора хлорида лития можно интерпретировать как наличие двух разных акваионов с равными концентрациями.
- [Лий(Н 2 О) 6 ] + ⇌ [Li(H 2 O) 5 ] + + Н 2 О
Другая возможность состоит в том, что между сольватированным катионом и анионом происходит взаимодействие, образующее ионную пару . Это особенно актуально, когда измерения проводятся на концентрированных растворах солей. Например, сольватное число 3 для раствора хлорида лития можно интерпретировать как обусловленное равновесием.
- [Лий(Н 2 О) 4 ] + + Cl − ⇌ [Li(H 2 O) 3 Cl] + H 2 O
полностью лежит в пользу ионной пары.
Колебательные спектры
[ редактировать ]Инфракрасные спектры и спектры комбинационного рассеяния света можно использовать для измерения частоты растяжения МО в акваионах металлов. Рамановская спектроскопия особенно полезна, поскольку спектр комбинационного рассеяния воды слабый, тогда как инфракрасный спектр воды интенсивный. Интерпретация частот колебаний несколько осложняется наличием в октаэдрических и тетраэдрических ионах двух колебаний: симметричного, измеряемого в спектре комбинационного рассеяния света, и антисимметричного, измеряемого в инфракрасном спектре.
| ион металла | Быть 2+ | мг 2+ | Мин. 2+ | Фе 2+ | В 2+ | С 2+ | Зн 2+ | ртуть 2+ | Ал 3+ | Здесь 3+ | В 3+ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| волновое число /см −1 | 530-543 | 360-365 | 395 | 389 | 405 | 440 | 385-400 | 380 | 520-526 | 475 | 400 |
Хотя связь между частотой колебаний и силовой постоянной непроста, общий вывод, который можно сделать из этих данных, заключается в том, что прочность связи МО увеличивается с увеличением заряда иона и уменьшением размера иона. Частоту растяжения МО акваиона в растворе можно сравнить с его аналогом в кристалле известной структуры. Если частоты очень близки, можно заключить, что координационное число иона металла в растворе такое же, как и в соединении в твердом состоянии.
Динамические методы
[ редактировать ]Такие данные, как проводимость , электрическая подвижность и диффузия, относятся к движению ионов через раствор. Когда ион движется через раствор, он стремится захватить с собой как первую, так и вторую сольватные оболочки. Следовательно, числа сольватации, измеренные на основе динамических свойств, обычно намного выше, чем числа, полученные на основе статических свойств.
Числа гидратации, измеренные динамическими методами [19] Что + Уже + Cs + мг 2+ Что 2+ Нет 2+ Зн 2+ Кр 3+ Ал 3+ Ионно-транспортное число 13-22 7-13 4 12-14 8-12 3-5 10-13 Подвижность ионов 3-21 2-10 10-13 7-11 5-9 10-13 Диффузия 5 3 1 9 9 8 11 17 13
Числа и структуры сольватации
[ редактировать ]Водород
[ редактировать ]
Водород не является металлом, но, как и они, он имеет тенденцию терять свой валентный электрон в химических реакциях, образуя катион H. + . В водном растворе он немедленно присоединяется к молекуле воды. [20] образуя разновидность, обычно обозначаемую как H 3 O + (иногда вольно пишется H + ). Такая гидратация образует катионы, которые по сути можно рассматривать как [H(OH 2 ) n ] + . [21]
Сольватация H + в воде не полностью охарактеризован, и было предложено множество различных структур. Двумя хорошо известными структурами являются катион Цунделя и катион Собственного . Собственная сольватная структура имеет ион гидроксония в центре Комплекс H 9 O + 4 , в котором гидроксоний прочно связан водородными связями с тремя соседними молекулами воды. В Зунделе В комплексе H 5 O + 2 протон принадлежит поровну двум молекулам воды в симметричной водородной связи . [22] [23] [24] [25] [26]
Щелочные металлы
[ редактировать ]Гидратированный катион лития в воде, вероятно, тетраэдрический и четырехкоординированный. [27] В первичной сольватной сфере октаэдрического иона натрия , скорее всего, находится шесть молекул воды . [27] [28] Калий является семикоординатным, а рубидий и цезий , вероятно, восьмикоординатным квадратным антипризматическим. [27] нет Данных по францию .
Щелочноземельные металлы
[ редактировать ]| [Be(H 2 O) 4 ] 2+ | [Мг(Н 2 О) 6 ] 2+ | Что 2+ (вода) | старший 2+ (вода) | Нет 2+ (вода) | |
|---|---|---|---|---|---|
| Расстояние МО (пм) | 167 | 209 | 242 § | 263 § | 281 § |
| сольватация (кДж моль −1 ) | 2494 | 1921 | 1577 | 1443 | 1305 |
- § Значения, экстраполированные на основе данных для твердотельных кристаллических структур
[ Катион бериллия Be(H 2 O) 4 ] 2+ имеет очень четко выраженную первичную сольватную оболочку с тетраэдрическим ядром BeO 4 . [29] Для магния [Mg(H 2 O) 6 ] 2+ также является хорошо охарактеризованным видом с октаэдрическим ядром MgO 6 . [29] ситуация С кальцием сложнее. Данные нейтронографии дали число сольватации хлорида кальция CaCl 2 , которое сильно зависит от концентрации: 10,0 ± 0,6 при 1 моль·дм. −3 , уменьшаясь до 6,4 ± 0,3 при 2,8 моль·дм −3 . Энтальпия сольватации уменьшается с увеличением ионного радиуса. Известны различные твердые гидраты с 8-координацией в квадратной антипризме и додекаэдрической геометрией. [30] В воде кальций и стронций , скорее всего, являются восьмикоординационными квадратными антипризматическими (хотя семикоординацию для кальция в настоящее время нельзя исключать). Барий не так хорошо изучен: по-видимому, его координационное число равно восьми или девяти. Теоретическое моделирование радия предполагает, что его аквакатион является десятикоординатным. [27]
Металлы 3 группы, лантаноиды и актиниды
[ редактировать ]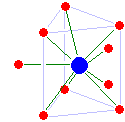
Скандий (III) и иттрий (III) являются восьмикоординатными, но имеют разную структуру: скандий имеет необычную треугольную призматическую структуру с двуглавыми колпачками (с пустым местом на колпачке), а иттрий имеет квадратную антипризматическую структуру. Лютеций (III) представляет собой трехглавую треугольную призму, но имеет значительный дефицит воды: одна из покрывающих молекул воды находится значительно ближе к лютецию, чем остальные, а среднее координационное число составляет всего 8,2, а не 9. Судя по его ионному радиусу, Lawrencium (III), вероятно, представляет собой девятикоординатную трехглавую треугольную призматическую форму без дефицита воды. [27]
Трехвалентные ионы лантаноидов постепенно уменьшаются в размерах от лантана к лютецию ; этот эффект известен как сокращение лантаноидов . [31] От лантана до диспрозия координационное число сохраняется на уровне 9 с трехглавой тригонально-призматической структурой, хотя, начиная с самария, покрывающие молекулы воды уже не связаны столь же прочно. Затем возникает дефицит воды для гольмия через лютеций, при этом среднее координационное число падает до 8,2 у лютеция(III). Конфигурация сохраняется, несмотря на малый размер катионов и дефицит воды, вероятно, за счет прочных водородных связей. [32] Европий (II) семикоординирован, а церий (IV) гидролизуется до кислород-мостикового димера [(H 2 O) 7 Ce–O–Ce(OH 2 ) 7 ] 6+ . [27]
Актиний (III) является одиннадцатикоординатным в водном растворе. Торий (IV) представляет собой девятикоординатную трехглавую тригональную призму, и предполагается, что то же самое верно и для других катионов актинида (IV) в водных растворах (поскольку это также их твердотельная конфигурация). Исследования координационного числа и/или структуры актинидов(III) на сегодняшний день распространяются только на калифорний . [32] [33] Однако, поскольку лоуренсий (III) имеет такой же ионный радиус, как и диспрозий (III), вполне вероятно, что от урана (III) до лоуренция (III) все представляют собой девятикоординатную трехглавую треугольную призму с полностью занятыми закрывающими позициями. [32] [27] (II) данные отсутствуют Для фермия (II), менделевия (II) и нобелия .
Металлы группы 4-12
[ редактировать ]
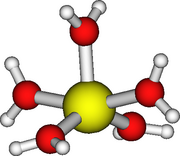
Ионы этих металлов в степенях окисления +2 и +3 имеют число сольватации 6. Все они имеют правильную октаэдрическую структуру, за исключением акваионов хрома (II) и меди (II), которые подвержены ян-теллеровскому искажению. В случае меди два осевых расстояния Cu-O составляют 238 пм, тогда как четыре экваториальных расстояния Cu-O составляют 195 пм в твердом состоянии. [35] Однако неясно, является ли Cu 2+ имеет число сольватации 5 или 6 в водном растворе, экспериментальные данные противоречивы. [32] Строение кобальта (III) в водном растворе не установлено. [27] Медь(I) оценивается как четырехкоординатный тетраэдр. [27]
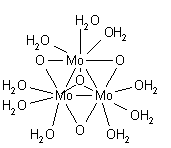
Число сольватации 6 при октаэдрической структуре хорошо установлено для цинка (II) и кадмия (II) в разбавленных растворах. В концентрированных растворах Zn 2+ ион может принимать 4-координатную тетраэдрическую структуру, но доказательства не убедительны из-за возможности образования ионных пар и/или гидролиза. [36] Сольватное число ртути (II), скорее всего, будет равно 6. [37] Цинк (II) представляет собой шестикоординационный октаэдр, но кадмий (II) может находиться в равновесии между шести- и семикоординацией. Меркурий (II) представляет собой октаэдр, искаженный псевдоЯном-Теллером. [27] Бис-акваструктура иона ртути(I), [(H 2 O)-Hg-Hg-(OH 2 )] + , содержится в твердых соединениях, [38] это не то же самое, что в растворе, в котором три молекулы воды координированы с каждой ртутью, образуя искаженное тетраэдрическое расположение. [27] Другой вид воды, в котором существует связь металл-металл, - это вид молибдена (II), формулируемый как [(H 2 O) 4 Mo≣Mo(H 2 O) 4 ] 4+ . [39] Каждый молибден окружен четырьмя молекулами воды в плоско-квадратном расположении, структура которого аналогична известной структуре хлорокомплекса [Mo 2 Cl 8 ] 4− . [40]
Во втором и третьем переходном ряду имеется несколько двухвалентных и трехвалентных акваионов переходных металлов: рутения (II) и (III), родия (III) и иридия (III), все октаэдрические. (Структуры рутения и иридия исследованы только в твердом состоянии, но предполагается, что в водном растворе они одинаковы.) [27] Молибден (III) сомнительный (и может быть сильно гидролизован в водном растворе), а молибден (II) димеризуется, при этом каждый молибден связывает четыре молекулы воды. [27] [32] палладия (II) и платины (II) имеют плоскую квадратную форму, но на самом деле они имеют сильно вытянутую в тетрагональном направлении квадратно-пирамидальную или октаэдрическую форму с одной или двумя дополнительными молекулами воды, чрезвычайно слабо связанными. Первоначально считалось, что акваионы [27] Строение серебра (I) является спорным: оно может быть двухкоординатным, а может быть и четырехкоординатным с двумя лишними, очень слабосвязанными молекулами воды. [27] Золото (III) представляет собой четырехкоординатный плоский квадрат в твердом состоянии, и предполагается, что оно имеет такую же структуру в водном растворе. [27] Искажение возникает у низкокоординатных металлов с сильными ковалентными тенденциями из-за эффекта Яна-Теллера второго порядка. Однако со степенью окисления 4 единственными негидролизованными частицами являются квадратный антипризматический цирконий (IV), [Zr(H 2 O) 8 ] 4+ , и гафний (IV), [Hf(H 2 O) 8 ] 4+ , и даже они чрезвычайно склонны к гидролизу. [32] Такой катион циркония образуется только в разбавленных растворах Zr. IV в сильной кислоте, и на практике встречающиеся катионные частицы циркония и гафния являются полиядерными. [41]
Элементы группы 13-18
[ редактировать ]Бор не является металлом, а бор(III) слишком кислый для существования акваиона: депротонирование продолжается до борной кислоты , боратов и гидроксиборатов. [42] ( Аква -ион алюминия III), [Al(H 2 O) 6 ] 3+ очень хорошо охарактеризован в растворе и твердом состоянии. AlO 6 имеет октаэдрическую симметрию, точечную группу Oh Ядро . Аква-ионы галлия (III), индия (III) и таллия (III) также являются шестикоординатными октаэдрическими. [27] Координационная геометрия таллия(I) экспериментально не известна, но, вероятно, она полунаправленная с большим разрывом в координационной сфере. [27]
Кремний также не является металлом, а кремний (IV) является достаточно сильной кислотой, чтобы депротонировать связанный OH. − . Таким образом образуются различные формы гидратированного кремнезема ( кремниевой кислоты ). [43] Имеются данные о том, что германия акваионы (II) могут образовываться в хлорнокислых средах. [44] Квантово-механические расчеты показывают, что акваион германия (II) демонстрирует сильное искажение первой координационной сферы из-за высокой плотности заряда и стереохимически активных неподеленных пар. По расчетам, первая оболочка обычно имеет число сольватации 6, но возможны также числа 4–7, и оболочка распадается на две части, находящиеся на разных расстояниях от центрального Ge. 2+ . [45] Однако германий(II) легко окисляется до германия(IV). [46] для которых ожидаются только гидролизованные виды. [47] Важные разновидности германия(IV) представляют собой анионные смешанные оксо-гидроксо-разновидности, таким образом, демонстрируя промежуточное поведение между кремнием и оловом: основными разновидностями, по-видимому, являются [GeO(OH) 3 ] − и октамерный [Ge 8 O 16 (OH) 3 ] 3− , с [GeO 2 (OH) 2 ] 2− происходят в меньших количествах. [43] Олово (II) 3-координатное полунаправленное. [48] [49] с очень большим разрывом в координационной сфере олова(II). [27] Гидратное число свинца (II) точно не установлено и может составлять от пяти до семи. [27] На практике эти катионы имеют тенденцию быть полиядерными. [46] Для олова(IV) и свинца(IV) существуют только гидролизованные соединения. [47]
мышьяк (III) образует только гидролизованные формы. Предполагается, что [47] По расчетам, стабильные катионные формы мышьяка(III) в воде составляют [As(OH) 2 ] + , [50] хотя гидролиз обычно продолжается до нейтральных и анионных частиц. [51] Аква -ионы сурьмы (III) могут существовать в разбавленных растворах сурьмы (III) в концентрированных кислотах. [51] [52] Квантово-механические расчеты показывают, что число сольватации равно 8, при этом первая координационная сфера разделяется на две гидратные полусферы по 4 молекулы воды в каждой. [53] Висмут (III) представляет собой восьмикоординатную квадратную антипризматику в водном растворе, хотя в твердом состоянии это девятикоординатная трехгранная треугольная призматика. [27] Хотя неподеленные пары влияют на структуры таллия (I), германия (II), олова (II), свинца (II) и сурьмы (III), в случае висмута (III) это не так. [32]
Селен (IV) в основном присутствует в виде селенистой кислоты (H 2 SeO 3 ) при pH ниже 2; при более высоком pH он депротонируется до HSeO 3 − а затем SeO 3 2− . [54] Катионный теллур (IV) представляет собой [Te(OH) 3 ] + ; он преобладает в разбавленных растворах с pH ниже 2. При pH выше 4 доминирующей разновидностью становится TeO(OH) 3 − , а выше pH 8 становится TeO 2 (OH) 2 2− . [55] Полоний (IV) должен быть подобен теллуру (IV), но немного слабее по своей склонности к гидролизу. [56] Строение полония(II), по-видимому, не изучено.
Галогены . , будучи сильно неметаллическими, предпочитают образовывать в водных растворах анионы, а не катионы [57] Анионная сольватация сложна, потому что молекулы воды указывают в другую сторону: катионы связываются с атомом кислорода воды водородом, обращенным в сторону, в то время как анионы предпочитают связываться асимметрично только с одним из атомов водорода в соседней молекуле воды. вода-вода Это приводит к значительному образованию водородных связей и образованию сетки уже внутри первой гидратной оболочки, чего не происходит при сольватации катионов. Такие взаимодействия сильнее для более тяжелых и крупных галогенидов; Прочность водородной связи уменьшается по мере перехода от йодида к фториду из-за увеличения отрицательного заряда молекул воды, увеличения индуктивного эффекта, обусловленного более сильными электрическими полями, и увеличения геометрической деформации водородной связи. [58] Редкий и чрезвычайно радиоактивный астат, по-видимому, более металлический: катионная разновидность астата (I) выводится из экспериментов в следовых количествах в кислых растворах и иногда обозначается символом At. + , но его структура не определена. [59]
Благородные газы не реагируют с водой, но их растворимость в воде увеличивается при понижении группы. Атомы аргона в воде, по-видимому, имеют первую гидратную оболочку, состоящую из 16±2 молекул воды, на расстоянии 280–540 пм, а до 800 пм обнаруживается более слабая вторая гидратная оболочка. Подобные гидратные сферы были обнаружены для атомов криптона и ксенона в воде. [60]
Оксо-аква-катионы
[ редактировать ]Некоторые элементы в степени окисления выше 3 образуют стабильные водные оксо-ионы. Хорошо известными примерами являются ионы ванадила (IV) и уранила (VI). Их можно рассматривать как особенно стабильные продукты гидролиза в такой гипотетической реакции, как
- [V(H 2 O) 6 ] 4+ → [VO(H 2 O) 5 ] 2+ +2Ч +
Ванадий имеет искаженное октаэдрическое окружение ( точечная группа C 4v ) из одного оксидного иона и 5 молекул воды. [61] Титанил, TiO 2+ , имеет аналогичную структуру. [32] Считается, что ванадий(V) существует в виде диоксо-иона [VO 2 (H 2 O) 4 ] + при pH менее 2, но наличие этого иона зависит от образования комплексов, таких как оксалатные комплексы, которые, как было показано, имеют VO +
2 единица, со связями цис -VO, в твердом состоянии. [62] Ион хрома 2 (IV) [CrO(H O ) 5 ] 2+ , аналогичный иону ванадия, было предложено на основании косвенных данных. [63]
Уранил-ион, UO 2+
2 , имеет транс -структуру. Аква-ион UO 2+
2 (aq) имеет пять молекул воды в плоскости, перпендикулярной оси OUO, в пентагональной бипирамидальной структуре, точечная группа D 5h . Нептунил и плутонил имеют одинаковую структуру. О структурах актинида(V) ничего не известно. [27]
Термодинамика
[ редактировать ]Основная цель термодинамики в этом контексте — получить оценки одноионных термодинамических величин, таких как энтальпия гидратации и энтропия гидратации . Эти величины относятся к реакции
- М г+ (газ) + растворитель → М г+ (в растворе)
Энтальпию этой реакции невозможно измерить напрямую, поскольку во всех измерениях используются солевые растворы, содержащие как катион, так и анион. Большинство экспериментальных измерений относятся к теплу, выделяющемуся при растворении соли в воде, что дает сумму энтальпий сольватации катионов и анионов. Затем, рассматривая данные для разных анионов с одним и тем же катионом и разных катионов с одним и тем же анионом, получают значения для отдельных ионов относительно произвольного нуля.
Одноионная стандартная энтальпия гидратации /кДж моль −1 [64] Что +
-514.6Быть 2+
-2487.0Уже +
-404.6мг 2+
-1922.1Ал 3+
-4659.7К +
-320.9Что 2+
-1592.4наук 3+
-3960.2... Здесь 3+
-4684.8руб. +
-296.2старший 2+
-1444.7И 3+
-3620.0... В 3+
-4108.7Сн 2+
-1554.4Cs +
-263.2Нет 2+
-1303.7La3+
-3282.8... Тл 3+
-4184.0Pb 2+
-1479.9
Другие значения включают Zn. 2+ -2044.3, Кд 2+ -1805,8 и Ag + -475,3 кДж моль −1 .
Существует отличная линейная корреляция между энтальпией гидратации и отношением квадрата заряда z 2 , к расстоянию МО, r eff . [65]
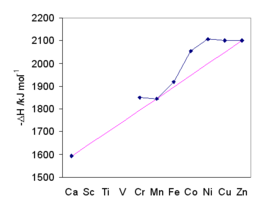
На значения переходных металлов влияет стабилизация кристаллического поля . Общую тенденцию демонстрирует пурпурная линия, проходящая через Ca. 2+ , Мн 2+ и цинк 2+ , для которого отсутствует стабилизация в октаэдрическом кристаллическом поле. Энергия гидратации увеличивается по мере уменьшения размера. Расщепление кристаллического поля придает акваиону дополнительную стабильность. Максимальная энергия стабилизации кристаллического поля наблюдается при Ni 2+ . Согласие энтальпий гидратации с предсказаниями послужило основой для общего принятия теории кристаллического поля. [66]
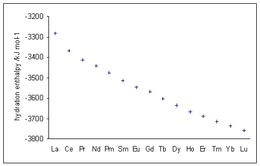
Энтальпии гидратации трехвалентных ионов лантаноидов демонстрируют все более отрицательные значения с увеличением атомного номера, что соответствует уменьшению ионного радиуса, известному как сокращение лантаноидов .
Можно определить энтропию гидратации одного иона. Значения показаны в следующей таблице. Чем более отрицательное значение, тем больше порядка в формировании акваиона. Примечательно, что тяжелые щелочные металлы имеют довольно небольшие значения энтропии, что позволяет предположить, что как первая, так и вторая сольватные оболочки несколько нечетки.
Энтропия гидратации одноионного стандарта при 25 °C/Дж град. −1 моль −1 [67] Что +
-118.8Уже +
-87.4мг 2+
-267.8Ал 3+
-464.4К +
-51.9Что 2+
-209.2... Здесь 3+
-510.4руб. +
-40.2старший 2+
-205.0... В 3+
-426.8Cs +
-36.8Нет 2+
-159.0La3+
-368.2...
Гидролиз акваионов
[ редактировать ]Есть два способа взглянуть на равновесие, связанное с гидролизом акваиона. Учитывая диссоциационное равновесие
- [М(Н 2 О) н ] г+ - Ч + ⇌ [М(Н 2 О) n-1 (ОН)] (з-1)+
активность выражением продукта гидролиза без учета молекул воды определяется
Альтернативой является запись равновесия в виде реакции комплексообразования или замещения.
- [М(Н 2 О) н ] г+ +ОХ − ⇌ :[M(H 2 O) n-1 (OH)] (з-1)+ + Н 2 О
В этом случае
Концентрации ионов водорода и гидроксида связаны самоионизацией воды , K w = {H + } {ОЙ − } поэтому две константы равновесия связаны соотношением
На практике первое определение более полезно, поскольку константы равновесия определяются на основе измерений концентраций ионов водорода. В общем,
сборы опущены для общности, а деятельность заменена концентрацией. – кумулятивные константы гидролиза.
Моделирование реакций гидролиза, протекающих в растворе, обычно основано на определении констант равновесия по данным потенциометрического (рН) титрования. Этот процесс далеко не прост по ряду причин. [68] Иногда соединения в растворе могут быть осаждены в виде солей, и их структура подтверждена рентгеновской кристаллографией. В других случаях выпавшие в осадок соли не имеют никакого отношения к тому, что, как предполагается, находится в растворе, поскольку отдельные кристаллические вещества могут иметь как низкую растворимость, так и очень низкую концентрацию в растворах.
Первая константа гидролиза
[ редактировать ]Логарифм константы гидролиза K 1,-1 для отрыва одного протона от акваиона
- [М(Н 2 О) н ] г+ - Ч + ⇌ [М(Н 2 О) n-1 (ОН)] (з-1)+
- [[М(ОН)] {(z-1)+ ] = К 1,-1 [М г+ ] [Ч + ] −1
показывает линейную зависимость с отношением заряда к расстоянию МО, z/d. Ионы делятся на четыре группы. Наклон прямой линии одинаков для всех групп, но точка пересечения А разная. [69]
log K 1,-1 = A + 11,0 z/d катион А мг 2+ , Как 2+ , сэр 2+ , Нет 2+
Ал 3+ , И 3+ , 3+−22.0 ± 0.5 Что + , уже + , К +
Быть 2+ , Мн 2+ , Фе 2+ , Ко 2+ , Является 2+ , С 2+ , Зн 2+ , компакт-диск 2+
наук 3+ , Если 3+ , V 3+ , Кр 3+ , Фе 3+ , Rh 3+ , Га 3+ , В 3+
Этот 4+ , Чт 4+ , Хорошо 4+ , У 4+ , например 4+ , Мог 4+ ,−19.8 ± 1 В + , Тл +
Pb 2+
Из 3+ , С 3+ ,−15.9 ± 1 Сн 2+ , ртуть 2+ , Пд 2+ что. 12
Катионами, наиболее устойчивыми к гидролизу по размеру и заряду, являются ионы жестких предпереходных металлов или ионы лантаноидов. В несколько менее устойчивую группу входят ионы переходных металлов. Третья группа содержит преимущественно мягкие ионы ионов постпереходных металлов. Ионы, которые проявляют наибольшую склонность к гидролизу из-за своего заряда и размера, - это Pd. 2+ , Сн 2+ и ртуть 2+ . [69] Это связано с низкими координационными числами ионов этой части таблицы Менделеева (в том числе Ag + и Ау + ), так что вокруг катиона присутствует меньше молекул воды, и они испытывают большую электростатическую силу, чем обычно. Похожая ситуация касается и Be 2+ , наименьший аквакатион, который также более кислый, чем обычно можно было бы ожидать. [70]
Стандартное изменение энтальпии первой стадии гидролиза обычно не сильно отличается от изменения энтальпии диссоциации чистой воды. Следовательно, стандартное изменение энтальпии реакции замещения
- [М(Н 2 О) н ] г+ +ОХ − ⇌ :[M(H 2 O) n-1 (OH)] (з-1)+ + Н 2 О
близко к нулю. Это типично для реакций между жестким катионом и жестким анионом, например гидроксид-ионом. [71] Это означает, что стандартный заряд энтропии вносит основной вклад в стандартное изменение свободной энергии и, следовательно, в константу равновесия.
За этот эффект отвечает изменение ионного заряда, поскольку акваион оказывает большее упорядочивающее действие на раствор, чем менее заряженный гидроксокомплекс.
Множественные реакции гидролиза
[ редактировать ]

Гидролиз бериллия демонстрирует многие характеристики, типичные для реакций множественного гидролиза. Концентрации различных частиц, в том числе полиядерных с мостиковыми гидроксид-ионами, изменяются в зависимости от рН вплоть до выпадения в осадок нерастворимого гидроксида. Гидролиз бериллия необычен тем, что концентрация [Be(H 2 O) 3 (OH)] + слишком мал, чтобы его можно было измерить. Вместо этого тример ([Be 3 (H 2 O) 6 (OH 3 )) 3+ образуется, структура которого подтверждена в твердых солях. Образование полиядерных частиц обусловлено уменьшением плотности заряда внутри молекулы в целом. Локальное окружение ионов бериллия приближается к [Be(H 2 O) 2 (OH) 2 ] + . Уменьшение эффективного заряда высвобождает свободную энергию в виде уменьшения энтропии упорядочения в центрах заряда. [72]
Некоторые продукты полиядерного гидролиза [73] Видовая формула катионы структура М 2 (ОН) + Быть 2+ , Мн 2+ , Ко 2+ , Является 2+
Зн 2+ , компакт-диск 2+ , ртуть 2+ , Пб 2+одиночный гидроксидный мостик между двумя катионами М 2 (ОН) (2з-2)+
2С 2+ , Сн 2+
Ал 3+ , наук 3+ , Лин 3+ , Если 3+ , Кр 3+
че 4+
VO 2+ , ДРУЗЬЯ 2+
2 , Нпо 2+
2 , ПуО 2+
2двойной гидроксидный мостик между двумя катионами М
3 (О) 3+
3Быть 2+ , ртуть 2+ шестичленное кольцо с альтернативным M п+ и ох − группы М
3 (О) (3з-4)+
4Сн 2+ , Пб 2+
Ал 3+ , Кр 3+ , Фе 3+ , В 3+Куб с альтернативными вершинами M п+ и ох − группы, одна вершина отсутствует М
4 (ОН) 4+
4мг 2+ , Ко 2+ , Является 2+ , компакт-диск 2+ , Пб 2+ Куб с альтернативными вершинами M п+ и ох − группы М
4 (ОН) 8+
8Зр 4+ , Чт 4+ Квадрат М п+ ионы с двойными гидроксидными мостиками на каждой стороне квадрата
Продукт гидролиза алюминия , сформулированный как [Al 13 O 4 (OH) 24 (H 2 O) 12 ] 7+ очень хорошо охарактеризован и может присутствовать в природе в воде при pH ок. 5.4. [74]
Общую реакцию потери двух протонов акваионом можно записать как
- [М(Н 2 О) н ] г+ - 2 часа + ⇌ [M(H 2 O) n-2 (OH) 2 ] (з-2)+
Однако константа равновесия потери двух протонов одинаково хорошо применима и к равновесию
- [М(Н 2 О) н ] г+ - 2 часа + ⇌ [МО(H 2 O) n-2 ] (з-2)+ + Н 2 О
поскольку концентрация воды предполагается постоянной. Это справедливо в целом: любая константа равновесия одинаково справедлива как для продукта с оксид-ионом, так и для продукта с двумя гидроксильными ионами. Различить две возможности можно только определив структуру соли в твердом состоянии. Оксо-мостики обычно возникают при высокой степени окисления металла. [75] Примером может служить комплекс молибдена (IV) [Mo 3 O 4 (H 2 O) 9 ] 4+ в котором имеется треугольник атомов молибдена, соединенных σ-связями , с оксидным мостиком на каждом ребре треугольника и четвертый оксид, соединяющий все три атома Мо. [76]
оксианионы
[ редактировать ]Оксо-аква-ионов металлов в степени окисления +5 и выше очень мало. Скорее всего, в водном растворе встречаются мономерные и полимерные оксианионы. Оксианионы можно рассматривать как конечные продукты гидролиза, при которых к металлу не присоединяются молекулы воды, а только оксид-ионы.
Кинетика обмена
[ редактировать ]Молекула воды в первой сольватной оболочке акваиона может меняться местами с молекулой воды в объеме растворителя. Обычно полагают, что определяющей скорость стадией является реакция диссоциации .
- [М(Н 2 О) н ] г+ → [М(Н 2 О) n-1 ] г+ * + Н 2 О
Символ * означает, что это переходное состояние химической реакции. Скорость этой реакции пропорциональна концентрации акваиона [А].
- .
Константу пропорциональности k называют константой скорости первого порядка при температуре Т. За единицу скорости реакции водообмена обычно принимают моль-дм. −3 с −1 .
Период полураспада этой реакции равен log e 2 /k. Эта величина с измерением времени полезна, поскольку она не зависит от концентрации. Величина 1/k, также имеющая размерность времени, равная периоду полураспада, делённому на 0,6932, известна как время пребывания или постоянная времени . [77]
Время пребывания при водообмене варьируется примерно от 10 −10 s для Cs + примерно до 10 +10 с (более 200 лет ) для ИК 3+ . Это зависит от таких факторов, как размер и заряд иона, а также, в случае ионов переходных металлов, от эффектов кристаллического поля . Очень быстрые и очень медленные реакции трудно изучать. Наибольшую информацию о кинетике водообмена дают системы со временем пребывания от 1 мкс до 1 с. Энтальпия и энтропия активации, ΔH ‡ и ΔS ‡ можно получить, наблюдая за изменением константы скорости с температурой.
Кинетические параметры (при 25 °С) водообмена: двухвалентные ионы, М 2+ (вода) [78] Быть мг V Кр Мин. Фе Ко В С Зн УО 2 Время пребывания (мкс) 0.001 2 0.00013 0.0032 0.0316 0.32 0.79 40 0.0005 0.032 1.3 ΔH ‡ (кДж моль −1 ) 43 69 13 34 32 33 43 23 ΔS ‡ (Джей ты −1 моль −1 ) 8 21 -13 12 -13 -17 -22 25
Обратите внимание на общее увеличение времени пребывания от ванадия к никелю, что отражает уменьшение размера ионов с увеличением атомного номера, что является общей тенденцией в периодической таблице , хотя и получает конкретное название только в случае сокращения лантаноидов . Эффекты энергии стабилизации кристаллического поля накладываются на периодический тренд.
Кинетические параметры (при 25 °С) водного обмена – трехвалентные ионы, М 3+ (вода) [78] Ал Из Кр Фе Здесь резус В время пребывания (мкс) 6.3×10 6 16 2.0×10 12 316 501 3.2×10 13 50 0.050 ΔH ‡ (кДж моль −1 ) 11 26 109 37 26 134 17 ΔS ‡ (Джей ты −1 моль −1 ) 117 -63 0 -54 -92 59
Обмен растворителя обычно происходит медленнее для трехвалентных, чем для двухвалентных ионов, поскольку более высокий электрический заряд катиона приводит к более прочным связям M-OH 2 и, как следствие, к более высокой энергии активации стадии диссоциативной реакции, [M(H 2 O) n ] 3+ → [М(Н 2 О) n-1 ] 3+ + H 2 O. Значения в таблице показывают, что это обусловлено как энтальпией активации, так и энтропийным фактором. [79]
Ион [Al(H 2 O) 6 ] 3+ относительно инертен к реакциям замещения, поскольку его электроны фактически находятся в электронной конфигурации замкнутой оболочки, [Ne]3s 2 3р 6 , что делает диссоциацию энергозатратной реакцией. Кр 3+ , который имеет октаэдрическую структуру и ад 3 электронная конфигурация также относительно инертна, как и Rh 3+ и Ир 3+ которые имеют низкоспиновый d 6 конфигурация.
Образование комплексов
[ редактировать ]Аква-ионы металлов часто участвуют в образовании комплексов . Реакцию можно записать как
- вечер х+ (водн.) + qл y- → [M п L q ] (px-qy)+
На самом деле это реакция замещения, в которой одна или несколько молекул воды из первой гидратной оболочки иона металла заменяются лигандами L. Комплекс описывается как внутрисферный комплекс. Комплекс типа [ML] (пк)+ можно описать как контактную ионную пару .
Когда молекула(ы) воды второй гидратной оболочки заменяется лигандами, говорят, что комплекс представляет собой внешнесферный комплекс или общую ионную пару растворителя. Образование общих с растворителем или контактных ионных пар особенно актуально для определения чисел сольватации аква-ионов методами, требующими использования концентрированных растворов солей, поскольку ионное спаривание зависит от концентрации. Рассмотрим, например, образование комплекса [MgCl] + в растворах MgCl 2 . Константа образования K составляет около 1, но меняется в зависимости от ионной силы. комплекса [80] Концентрация довольно слабого комплекса возрастает примерно от 0,1% для 10 мМ раствора до примерно 70% для 1М раствора (1М = 1 моль дм −3 ).
Электрохимия
[ редактировать ]Стандартный электродный потенциал для равновесия полуячейки M г+ + с е − ⇌ M( s ) измерено для всех металлов, кроме самых тяжелых трансурановых элементов.
Стандартные электродные потенциалы /В для пар М г+ /РС) [81] [82] [83] [84] [85] ЧАС +
0Что +
−3.040Быть 2+
−1.85Уже +
−2.71мг 2+
−2.372Ал 3+
−1.66К +
−2.931Что 2+
−2.868наук 3+
−2.90... Зн 2+
−0.751Здесь 3+
−0.53Ге 2+
+0.1руб. +
−2.98старший 2+
−2.899И 3+
−2.37... компакт-диск 2+
−0.403В 3+
−0.342Сн 2+
−0.136Сб 3+
+0.15Cs +
−3.026Нет 2+
−2.912Лу 3+
−2.25... ртуть 2+
−0.854Тл 3+
+0.73Pb 2+
−0.126С 3+
+0.16Po 4+
+0.76Пт +
−2.9Солнце 2+
−2.8лр 3+
−1.96La3+
−2.52Этот 3+
−2.32Пр 3+
−2.34Нд 3+
−2.32вечера 3+
−2.30см 3+
−2.28Евросоюз 3+
−1.98Б-г 3+
−2.27Тб 3+
−2.27Те 3+
−2.32К 3+
−2.37Является 3+
−2.33Тм 3+
−2.30Ыб 3+
−2.23И 3+
−2.18че 4+
−1.83Хорошо 4+
−1.46В 4+
−1.51Например 4+
−1.33Мог 4+
−1.80Являюсь 3+
−2.06См 3+
−2.07Бк 3+
−2.03См. 3+
−2.01Является 3+
−1.99Фм 3+
−1.97Мэриленд 3+
−1.65Нет 3+
−1.20
Стандартные электродные потенциалы /В для 1-го. ионы переходных металлов ряда [81] Пара Из V Кр Мин. Фе Ко В С М 2+ / М −1.63 −1.18 −0.91 −1.18 −0.473 −0.28 −0.228 +0.345 М 3+ / М −1.37 −0.87 −0.74 −0.28 −0.06 +0.41
Разные стандартные электродные потенциалы /В [81] В + / В ПД 2+ / Пд Пт 2+ / Пт Зр 4+ / Зр хф 4+ / Вч В 3+ / В Этот 4+ / Этот +0.799 +0.915 +1.18 −1.53 −1.70 +1.50 −1.32
акваион труднее Поскольку стандартный электродный потенциал более отрицателен, восстановить . Например, сравнивая потенциалы цинка (-0,75 В) с потенциалами железа (Fe(II)-0,47 В, Fe(III)-0,06 В) видно, что ионы железа восстанавливаются легче, чем ионы цинка. Это является основанием для использования цинка для анодной защиты крупных конструкций из железа или для защиты небольших конструкций путем гальванизации .
Ссылки
[ редактировать ]- ^ Берджесс, Раздел 1.2.
- ^ Берджесс, с. 20.
- ^ Риченс, с. 25
- ^ Берджесс, с. 181.
- ^ Шеннон, РД (1976). «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Акта Кристаллогр. А. 32 (5): 751–767. Бибкод : 1976AcCrA..32..751S . дои : 10.1107/S0567739476001551 . . Риченс, Приложение 2.
- ^ Берджесс, глава 11.
- ^ Берджесс, Глава 6.
- ^ Чипперфилд, Джон (1999). Неводные растворители . Оксфорд: ОУП. ISBN 978-0-19-850259-3 .
- ^ Jump up to: а б Штумм и Морган
- ^ Берджесс, с. 53.
- ^ Йоханссон, Георг (1992). Сайкс, А.Г. (ред.). Структуры комплексов в растворах, полученные на основе рентгеновских дифракционных измерений . Достижения неорганической химии. Том. 39. Сан-Диего: Академик Пресс. стр. 161–232. ISBN 978-0-12-023639-8 .
- ^ Отаки, Х.; Раднаи, Т. (1993). «Структура и динамика гидратированных ионов». хим. Преподобный . 93 (3): 1157–1204. дои : 10.1021/cr00019a014 .
- ^ Маджини, М.; Личери, Г.; Пащина Г.; Пиккалуга, Г.; Пинна, Г. (1988). Рентгеновская дифракция ионов в водных растворах: гидратация и комплексообразование . Бока-Ратон, Флорида: CRC Press. ISBN 978-0-8493-6945-2 .
- ^ Эндерби, JE; Нильсон, Г.В. (1989). Сайкс, А.Г. (ред.). Координация металлических акваионов . Достижения неорганической химии. Том. 34. Сан-Диего: Академик Пресс. стр. 100-1 195–218. дои : 10.1016/S0898-8838(08) 60017-3 ISBN 978-0-12-023634-3 .
- ^ Нилсон, Г.В.; Эндерби, Дж. Э. (1983). «Структура водного раствора хлорида никеля». Труды Королевского общества А. 390 (1799): 353–371. Бибкод : 1983RSPSA.390..353N . дои : 10.1098/rspa.1983.0136 . S2CID 95824687 .
- ^ Эндерби, Дж. Э. (1987). «Дифракционные исследования водных ионных растворов». В Беллисент-Фюнеле, MC.; Нилсон, Г.В. (ред.). Физика и химия водных растворов . Серия НАТО ASI. Рейдель. стр. 129–145. ISBN 978-90-277-2534-9 . п. 138.
- ^ Адамс, DM (1967). Металл-лиганд и родственные колебания . Лондон: Эдвард Арнольд. стр.254.
- ^ Берджесс, с. 85.
- ^ Риченс, с. 40
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 36–37. ISBN 978-0-08-037941-8 .
- ^ Риченс, с. 123
- ^ Завицас, А.А. (2001). «Свойства водных растворов электролитов и неэлектролитов». Журнал физической химии Б. 105 (32): 7805–7815. дои : 10.1021/jp011053l .
- ^ Хульте, Г.; Стенхаген, Г.; Веннерстрем, О.; Оттоссон, Ч. (1997). «Кластер воды, изученный методом масс-спектрометрии электрораспылением». Журнал хроматографии А. 512 : 155–165. дои : 10.1016/S0021-9673(97)00486-X .
- ^ Зундель, Г.; Мецгер, Х. (1968). «Энергетические зоны туннелирования избыточных протонов в жидких кислотах. ИК-спектроскопическое исследование природы группировок H5O2+». Журнал физической химии . 58 (5_6): 225–245. дои : 10.1524/зпч.1968.58.5_6.225 . S2CID 101048854 .
- ^ Вике, Э.; Эйген, М.; Акерманн, Т. (1954). «О состоянии протона (иона гидроксония) в водном растворе». Журнал физической химии . 1 (5_6): 340–364. дои : 10.1524/зпч.1954.1.5_6.340 .
- ^ Стоянов Евгений С.; Стоянова Ирина В.; Рид, Кристофер А. (15 января 2010 г.). «Структура иона водорода ( H +
aq ) в воде» . Журнал Американского химического общества . 132 (5): 1484–1485. : 10.1021 /ja9101826 . PMC 2946644. . PMID 20078058 doi - ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v Перссон, Ингмар (2022). «Структура гидратированных ионов металлов в твердом состоянии и водных растворах» . Жидкости . 2 (3): 210–242. дои : 10.3390/liquids2030014 .
- ^ Риченс, с. 127
- ^ Jump up to: а б Риченс, с. 129
- ^ Риченс, раздел 2.3.
- ^ Риченс, с. 185
- ^ Jump up to: а б с д и ж г час я Перссон, Ингмар (2010). «Гидратные ионы металлов в водном растворе: насколько регулярна их структура?» . Чистая и прикладная химия . 82 (10): 1901–1917. doi : 10.1351/PAC-CON-09-10-22 .
- ^ Тирер, Лаура М.; Томсон, Нил К. (2017). «Актиниум Аква Ион: столетие в процессе создания» . АКС Цент. Наука . 3 (3): 153–155. дои : 10.1021/accentsci.7b00074 . ПМК 5364445 . ПМИД 28386590 .
- ^ Фрэнк, Патрик; Бенфатто, Маурицио; Силадьи, Роберт К.; Д'Анджело, Паола; Делла Лонга, Стефано; Ходжсон, Кейт О. (2005). «Структура раствора [Cu(aq)] 2+ и ее последствия для связей, индуцированных стойкой, в активных центрах синего медного белка». Inorganic Chemistry . 44 (6): 1922–1933. doi : 10.1021/ic0400639 . PMID 15762718 .
- ^ Риченс, главы 4–12.
- ^ Риченс, с. 544
- ^ Риченс, с. 555
- ^ Риченс, с. 551
- ^ Финхолт, Джеймс Э.; Люпен, Питер; Сайкс, А. Джеффри (1983). «Кинетика и механизм замещения четырехсвязного аквадимера молибдена (II) тиоцианатом и оксалатом». Неорганическая химия . 22 (22): 3315–3333. дои : 10.1021/ic00164a027 .
- ^ Риченс, с. 282.
- ^ Риченс, стр. 215–220
- ^ Риченс, стр. 141–143
- ^ Jump up to: а б Богатство, с. 151–152
- ^ Пан, Куан; Фу, И-Чанг; Хуан, Тех-Шун (декабрь 1964 г.). «Полярографическое поведение перхлората германия (II) в растворах хлорной кислоты». Журнал Китайского химического общества . 11 (4): 176–184. дои : 10.1002/jccs.196400020 .
- ^ Азам, СС; Лим, Л.; Хофер, Т.С.; Рэндольф, БР; Роде, Б.М. (2009). «Гидратированный германий (II): нерегулярные структурные и динамические свойства, выявленные с помощью исследования молекулярной динамики квантово-механического поля заряда». Журнал вычислительной химии . 31 (2): 278–285. дои : 10.1002/jcc.21315 . ПМИД 19479764 . S2CID 22766649 .
- ^ Jump up to: а б Риченс, с. 152–4
- ^ Jump up to: а б с Хофер, Томас С.; Вайс, Александр Х.; Рэндольф, Бернхард Р.; Роде, Бернд М. (2011). «Гидратация высокозарядных ионов» (PDF) . Письма по химической физике . 512 (4–6): 139–145. Бибкод : 2011CPL...512..139H . дои : 10.1016/j.cplett.2011.05.060 . ПМЦ 3268562 . ПМИД 22298911 .
- ^ Перссон, Ингмар; д'Анджело, Паола; Лундберг, Дэниел (2016). «Гидратированные и сольватированные ионы олова (II) в растворе и твердом состоянии, а также обзор координационной химии ионов металла d10s2» (PDF) . Химия - Европейский журнал . 22 (51): 18583–18592. дои : 10.1002/chem.201603904 . ПМИД 27862415 .
- ^ Перссон, Ингмар; Лычко, Кшиштоф; Лундберг, Дэниел; Эрикссон, Ларс; Плачек, Анна (2011). «Координационно-химическое исследование гидратированных и сольватированных ионов свинца (II) в растворе и твердом состоянии». Неорганическая химия . 50 (3): 1058–1072. дои : 10.1021/ic1017714 . ПМИД 21226482 .
- ^ Бхаттачарджи, Анирбан; Хофер, Томас С.; Прибил, Андреас Б.; Рэндольф, Бернхард Р.; Роде, Бернд М. (2009). «Гидролиз As (III): фемтосекундный процесс». Письма по химической физике . 473 (1–3): 176–178. Бибкод : 2009CPL...473..176B . дои : 10.1016/j.cplett.2009.03.011 .
- ^ Jump up to: а б Риченс, с. 155
- ^ Джандер, Г.; Хартманн, Х.-Й. (1965). «О реакциях сурьмы(III) в водном растворе. III: Полярографические измерения». Журнал неорганической и общей химии (на немецком языке). 339 (5–6): 256–261. дои : 10.1002/zaac.19653390505 .
- ^ Лим, Лен Геральд В.; Бхаттачарджи, Анирбан; Асам, С. Сикандер; Хофер, Томас С.; Рэндольф, Бернхард Р.; Роде, Бернд М. (2010). «Структурные и динамические аспекты несимметричной гидратации Sb (III): ab initio моделирование молекулярной динамики квантово-механического зарядового поля». Неорганическая химия . 49 (5): 2132–2140. дои : 10.1021/ic901737y . ПМИД 20121188 .
- ^ Баес и Месмер, с. 385
- ^ Риченс, стр. 159–160
- ^ Аяла, Регла; Мартинес, Хосе Мануэль; Паппалардо, Рафаэль Р.; Санчес Маркос, Энрике (2012). «Квантово-механическое исследование акваионов и гидролизованных форм Po(IV), Te(IV) и Bi(III) в воде». Журнал физической химии Б. 116 (51): 14903–14914. дои : 10.1021/jp309439f .
- ^ Риченс, стр. 161–162
- ^ Робертсон, Уильям Х.; Джонсон, Марк А. (2003). «Молекулярные аспекты гидратации галогенид-ионов: кластерный подход». Ежегодный обзор физической химии . 54 (1): 173–213. doi : 10.1146/annurev.physchem.54.011002.103801 .
- ^ Куглер, Гонконг; Келлер, К. (1985). «Ат, Астат», Система № 8а . Гмелина Справочник по неорганической и металлоорганической химии. Том. 8 (8-е изд.). Спрингер-Верлаг. стр. 220–221. ISBN 978-3-540-93516-2 .
- ^ Риченс, с. 163
- ^ Риченс, с. 236
- ^ Риченс, с. 240
- ^ Риченс, с. 278
- ^ Jump up to: а б с Данные Берджесса, с. 182.
- ^ Риченс, Рисунок 1.2.
- ^ Оргель, Леси Э. (1966). Введение в химию переходных металлов. Теория поля лигандов (2-е изд.). Лондон: Метуэн. п. 76.
- ^ Берджесс, с. 187.
- ^ Баес и Месмер, глава 3.
- ^ Jump up to: а б Баес и Месмер, стр. 407
- ^ Вульфсберг, Гэри (2000). Неорганическая химия . Университетские научные книги. п. 68. ИСБН 9781891389016 .
- ^ Баес и Месмер, стр. 409.
- ^ Баес и Месмер, раздел 18.2.
- ^ Баес и Месмер, Таблица 18.3.
- ^ Риченс, с. 145
- ^ Баес и Месмер, с. 420.
- ^ Риченс, рисунок 6.26, с. 295
- ^ * Аткинс, П.В.; де Паула, Дж. (2006). Физическая химия (8-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-870072-2 . Глава 22.
- ^ Jump up to: а б Адаптировано из Берджесса, Таблицы 11.4 и 11.5.
- ^ Берджесс, с. 326.
- ^ База данных IUPAC SC Полная база данных опубликованных данных о константах равновесия металлокомплексов и лигандов.
- ^ Jump up to: а б с Бёрджесс, таблица 8.1
- ^ Лиде, Дэвид Р., изд. (2006). Справочник CRC по химии и физике (87-е изд.). Бока-Ратон, Флорида: CRC Press . ISBN 0-8493-0487-3 .
- ^ Ванисек, Петр (2011). «Электрохимическая серия» . В Хейнсе, Уильям М. (ред.). Справочник CRC по химии и физике (92-е изд.). ЦРК Пресс. стр. 5–80–9. ISBN 978-1-4398-5512-6 .
- ^ Стандартные электродные потенциалы и температурные коэффициенты в воде при 298,15 К , Стивен Г. Братч (NIST)
- ^ Сурьма - Физико-химические свойства - DACTARI
Библиография
[ редактировать ]- Баес, CF; Месмер, Р.Э. (1986) [1976]. Гидролиз катионов . Малабар, Флорида: Роберт Э. Кригер. ISBN 978-0-89874-892-5 .
- Берджесс, Джон (1978). Ионы металлов в растворе . Чичестер: Эллис Хорвуд. ISBN 978-0-85312-027-8 .
- Риченс, Дэвид. Т. (1997). Химия аква-ионов . Уайли. ISBN 978-0-471-97058-3 .
- Штумм, Вернер; Морган, Джеймс Дж. (1995). Водная химия - химическое равновесие и скорости в природных водах (3-е изд.). Уайли-Блэквелл. ISBN 978-0-471-51185-4 .
- Швейцер, Джордж К.; Пестерфилд, Лестер Л. (2010). Водная химия элементов . Оксфорд: ОУП. ISBN 978-0-19-539335-4 .
Дальнейшее чтение
[ редактировать ]- Х. Л. Фридман, Ф. Франкс, Водные растворы простых электролитов, Springer; перепечатка издания 1973 г., 2012 г. ISBN 1468429574


![{\displaystyle \{[{\ce {M(OH)}}]^{(z-1)+}\}=K_{1,-1}\{{\ce {M}}^{z+}\ }\{{\ce {H}}^{+}\}^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e176d25b98e44f238e312388c7778c2dd0da6fa5)
![{\displaystyle \{[{\ce {M(OH)}}]^{(z-1)+}\}=K_{1,1}\{{\ce {M}}^{z+}\} \{{\что {OH}}^{-}\}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd140779b1efcea8279dd45e357bccbb9703423e)

![{\displaystyle [{\ce {M}}_{x}({\ce {OH}})_{y}]=\beta _{x, -y}*[{\ce {M}}]^ {x}[{\ce {H}}]^{-y}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0f51eff3529039469fab7a042189cb722207509)


![{\displaystyle \mathrm {rate} =-\left({\frac {d[A]}{dt}}\right)_{T}=k[A]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b55c4231b71d8a68c7ed0c741392e23a2ae8c18b)