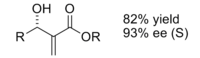Хиральная кислота Льюиса
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
Хиральные кислоты Льюиса (CLA) представляют собой тип катализатора на основе кислоты Льюиса . Эти кислоты влияют на хиральность субстрата, реагируя с ним. В таких реакциях синтез благоприятствует образованию определенного энантиомера или диастереомера . Метод представляет собой реакцию энантиоселективного асимметрического синтеза . Поскольку они влияют на хиральность, они производят оптически активные продукты из оптически неактивных или смешанных исходных материалов. Этот тип преимущественного образования одного энантиомера или диастереомера по сравнению с другим формально известен как асимметричная индукция . В этом виде кислоты Льюиса электроноакцепторный атом обычно представляет собой металл, такой как индий , цинк , литий , алюминий , титан или бор . Хиральные основных -изменяющие лиганды, используемые для синтеза этих кислот, часто имеют несколько центров Льюиса (часто диоловую или диазотную структуру), которые позволяют образовывать кольцевую структуру с участием атома металла. [1] [2]
Ахиральные кислоты Льюиса использовались на протяжении десятилетий для стимулирования синтеза рацемических смесей в множестве различных реакций. С 1960-х годов химики использовали хиральные кислоты Льюиса для индукции энантиоселективных реакций. Это полезно, когда желаемый продукт представляет собой конкретный энантиомер, как это обычно бывает при синтезе лекарств. включают реакции Дильса-Альдера , еновую реакцию , реакции [2+2] циклоприсоединения , гидроцианирование альдегидов Общие типы реакций и, в первую очередь, эпоксидирование Шарплесса . [3]
Теория
[ редактировать ]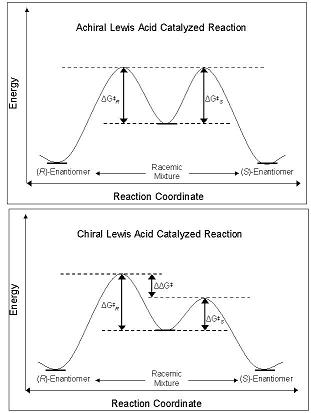
Энантиоселективность CLA обусловлена их способностью нарушать барьер свободной энергии наряду с координатным путем реакции , который приводит либо к R- , либо к S -энантиомеру. Диастереомеры и энантиомеры основного состояния имеют одинаковую энергию в основном состоянии, а при реакции с ахиральной кислотой Льюиса их диастереомерные промежуточные соединения, переходные состояния и продукты также имеют одинаковую энергию. Это приводит к образованию рацемических смесей . Однако когда в той же реакции используется CLA, энергетический барьер образования одного диастереомера меньше, чем у другого; реакция находится под кинетическим контролем . Если разница в энергетических барьерах между диастереомерными переходными состояниями достаточна, то высокий энантиомерный избыток одного изомера. наблюдается [4]
Асимметричный синтез
[ редактировать ]Реакция Дильса-Альдера
[ редактировать ]Реакции Дильса-Альдера происходят между сопряженным диеном и алкеном (широко известным как диенофил ). Этот процесс циклоприсоединения позволяет стереоселективно образовывать циклогексеновые кольца, способные иметь до четырех смежных стереогенных центров.
Реакции Дильса-Альдера могут приводить к образованию множества структурных изомеров и стереоизомеров. Теория молекулярных орбиталей считает, что предпочтение отдается эндопереходному состоянию, а не экзопереходному состоянию (правило эндоприсоединения). Также постулируется, что усиленные вторичные орбитальные взаимодействия являются источником усиленной эндодиастереоселекции.
Обычно CLA используются для активации диенофила. Типичный катализатор CLA получают из Mg. 2+ центр сделан хиральным путем присоединения бинолофосфатного эфира . CLA были применены к ряду внутримолекулярных реакций Дильса-Альдера. [5]
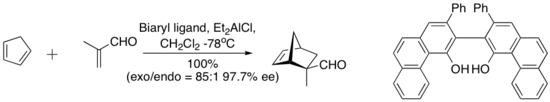
Комплекс, полученный из хлорида диэтилалюминия и «сводчатого» биарильного лиганда, показанного ниже, катализирует энантиоселективную реакцию Дильса-Альдера между циклопентадиеном и метакролеином. Хиральный лиганд количественно выделяют хроматографией на силикагеле . [6]
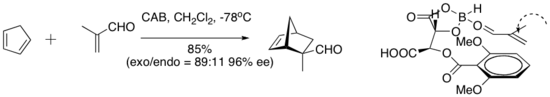
Хиральный (ацилокси)борановый комплекс (КАБ) эффективен в катализе ряда альдегидных реакций Дильса-Альдера. Эксперименты по ЯМР-спектроскопии показали непосредственную близость альдегида и арильного кольца. Укладка Pi между арильной группой и альдегидом была предложена как организационная особенность, которая придает высокую энантиоселективность циклоприсоединению. [7]
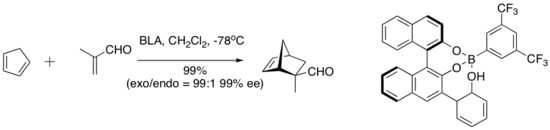
Хиральная кислота Льюиса (BLA) с участием кислоты Бренстеда катализирует ряд реакций диен-альдегидного циклоприсоединения. [8]
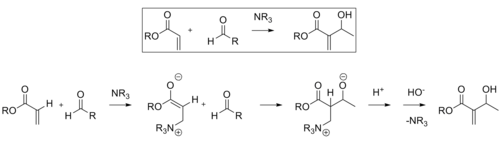
Альдольная реакция
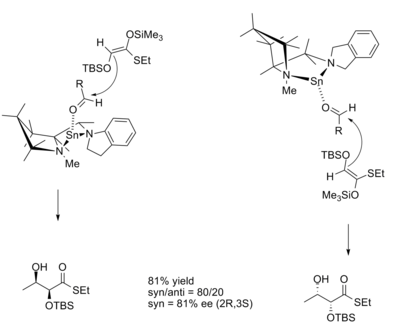
[ редактировать ]В альдольной реакции диастереоселективность продукта часто определяется геометрией енолята. Модель Циммермана-Тракслера Z предсказывает, что енолят будет давать син -продукты, а еноляты E будут давать анти- продукты. Реакции, катализируемые CLA на основе олова, позволяют продуктам отклоняться от этой схемы. [9]
катализатора R и S Переходные структуры для реакций с энантиомерами :
Реакция Бейлиса-Хиллмана
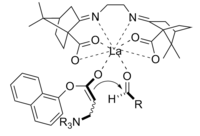
[ редактировать ]Реакция Бейлиса-Хиллмана представляет собой путь образования связи CC между альфа-, бета-ненасыщенным карбонилом и альдегидом , который требует нуклеофильного катализатора, обычно третичного амина , для присоединения и отщепления типа Михаэля. Стереоселективность этих реакций обычно низкая. лантан Было продемонстрировано, что CLA, содержащие (III), улучшают стереоселективность. Аналогично, для достижения стереоселективности также можно использовать хиральный амин. [10]
Продукт, полученный в результате реакции с использованием хирального катализатора, был получен с хорошим выходом и превосходной энантиоселективностью.
Эне реакция
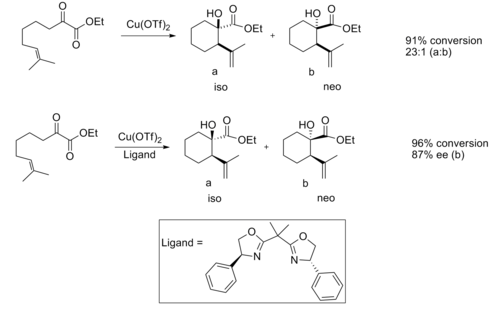
[ редактировать ]Хиральные кислоты Льюиса оказались полезными в еновой реакции . При катализе ахиральной кислотой Льюиса реакция обычно обеспечивает хорошую диастереоселективность. [11]
Хорошая энантиоселективность наблюдалась при использовании хирального катализатора на основе кислоты Льюиса.
Считается, что энантиоселективность обусловлена стерическими взаимодействиями между метильной и фенильной группой, что делает переходную структуру изопродукта значительно более выгодной.
Ахиральные кислоты Льюиса в стереоселективном синтезе
[ редактировать ]В некоторых случаях ахиральная кислота Льюиса может обеспечивать хорошую стереоселективность. Кимура и др. продемонстрировали регио- и диастереоселективное сочетание 1,3- диенов с альдегидами с использованием никелевого катализатора. [12]
Ссылки
[ редактировать ]- ^ Ямамото, Хисаши (2007). Реагенты кислоты Льюиса – практический подход . Кновел. ISBN 978-1-60119-442-8 . OCLC 315587750 .
- ^ Кори, Э.Дж.; Имвинкельрид, Рене; Пикуль, Станислав; Сян, И Бинь (июль 1989 г.). «Практические энантиоселективные реакции Дильса-Альдера и альдольные реакции с использованием новой системы хирального контроллера» . Журнал Американского химического общества . 111 (14): 5493–5495. дои : 10.1021/ja00196a081 . ISSN 0002-7863 .
- ^ Нарасака, Коичи (1991). «Хиральные кислоты Льюиса в каталитических асимметричных реакциях» . Синтез . 1991 (1): 1–11. дои : 10.1055/s-1991-26364 . ISSN 0039-7881 .
- ^ Моррисон, JD, Мошер, HS (1971). Асимметричные органические реакции . Прентис-Холл, Inc. ISBN 978-0-13-049551-8 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ша, Цян; Дэн, Юнмин; Дойл, Майкл П. (2015). «Будущее катализа хиральными кислотами Льюиса». Хиральные кислоты Льюиса . Темы металлоорганической химии. Том. 62. стр. 1–25. дои : 10.1007/3418_2015_141 . ISBN 978-3-319-70804-1 .
- ^ Бао, Цзяньмин; Вульф, Уильям Д.; Рейнгольд, Арнольд Л. (май 1993 г.). «Сводчатые биарилы как хиральные лиганды для асимметричных каталитических реакций Дильса-Альдера» . Журнал Американского химического общества . 115 (9): 3814–3815. дои : 10.1021/ja00062a073 . ISSN 0002-7863 .
- ^ Исихара, Кадзуаки; Гао, Цинчжи; Ямамото, Хисаси (ноябрь 1993 г.). «Механистические исследования асимметричной реакции Дильса-Альдера, катализируемой CAB» . Журнал Американского химического общества . 115 (22): 10412–10413. дои : 10.1021/ja00075a088 . ISSN 0002-7863 .
- ^ Исихара, Кадзуаки; Ямамото, Хисаси (февраль 1994 г.). «Катализатор асимметричной реакции Дильса-Альдера на основе хиральной кислоты Льюиса (BLA) с кислотой Бренстеда» . Журнал Американского химического общества . 116 (4): 1561–1562. дои : 10.1021/ja00083a048 . ISSN 0002-7863 .
- ^ Кобаяши, Шу; Хорибе, Минеко (сентябрь 1997 г.). «Синтез, контролируемый хиральной кислотой Льюиса (синтез CLAC): хиральные кислоты Льюиса влияют на ход реакции в асимметричных альдольных реакциях для синтеза энантиомерных производных дигидрокситиоэфиров в присутствии хиральных диаминов, полученных из L-пролина» . Химия - Европейский журнал . 3 (9): 1472–1481. дои : 10.1002/chem.19970030914 . ISSN 0947-6539 .
- ^ Ян, Кун-Шо; Ли, Вей-Дер; Пан, Цзя-Фу; Чен, Квунмин (февраль 2003 г.). «Асимметричные реакции Бейлиса-Хиллмана, катализируемые хиральной кислотой Льюиса» . Журнал органической химии . 68 (3): 915–919. дои : 10.1021/jo026318m . ISSN 0022-3263 . ПМИД 12558416 .
- ^ Ян, Дэн; Ян, Мин; Чжу, Нянь-Юн (октябрь 2003 г.). «Энантиоселективные внутримолекулярные карбонильные реакции ненасыщенных α-кетоэфиров, катализируемые хиральной кислотой Льюиса» . Органические письма . 5 (20): 3749–3752. дои : 10.1021/ol035486d . ISSN 1523-7060 . ПМИД 14507221 .
- ^ Кимура, Масанари; Эзоэ, Акихиро; Мори, Масахико; Ивата, Кейсуке; Тамару, Ёсинао (июль 2006 г.). «Регио- и стереоселективное никель-катализируемое гомоаллилирование альдегидов 1,3-диенами» . Журнал Американского химического общества . 128 (26): 8559–8568. дои : 10.1021/ja0608904 . ISSN 0002-7863 . ПМИД 16802822 .